Definição e importância do problema
Por síndroma do coração esquerdo hipoplásico (SCEH) entende-se um conjunto de anomalias caracterizadas por hipodesenvolvimento do ventrículo esquerdo, válvulas mitral e aórtica, e da aorta. Este defeito representa cerca de 1% de todas as cardiopatias congénitas e 9% das cardiopatias do recém-nascido. Predomina no sexo masculino (cerca de 67% dos doentes) e, em mais de 10% dos doentes, existem anomalias extracardíacas associadas. Trata-se da cardiopatia com mais elevada mortalidade durante o primeiro mês de vida (95%) na ausência de tratamento.
Além das anomalias já referidas, a aurícula esquerda na SCEH é pequena; em 15% dos casos existe comunicação interauricular e em 10% o foramen ovale está permeável. Em cerca de 10% dos doentes com septo interauricular intacto e nos casos em que o foramen ovale permeável é restritivo, a mortalidade é elevada, mesmo depois da descompressão auricular esquerda.
Fisiopatologia
Durante a vida fetal, as resistências vasculares pulmonares são superiores às resistências sistémicas, e o ventrículo direito, (dominante), mantém uma pressão de perfusão normal na aorta descendente e placenta através do canal arterial. A aorta proximal, as coronárias e as artérias cerebrais são perfundidas por via retrógrada, razão pela qual o feto com SCEH tolera bem esta grave patologia cardíaca. Após o nascimento, verifica-se:
- inversão das resistências vasculares (resistência sistémica > resistência pulmonar), aumento da pressão na aurícula esquerda e consequente encerramento do foramen ovale;
- encerramento do canal arterial, por aumento da saturação de Hb-oxigénio (SpO2) e diminuição das prostaglandinas.
Provoca-se, assim, uma acentuada redução do débito cardíaco sistémico e da pressão na aorta, desencadeando um quadro de choque circulatório e acidose metabólica. A manutenção de débito sistémico adequado depende: da permeabilidade do canal arterial com dimensões adequadas de modo a permitir ao ventrículo direito ejectar sangue para a aorta; e da existência de uma comunicação interauricular que possa descomprimir a aurícula esquerda. Se a comunicação interauricular for grande, o shunt esquerdo-direito não será restritivo e a SpO2 poderá aproximar-se de 80%. Nos casos com septo interauricular intacto ou com comunicação interauricular restritiva, haverá edema pulmonar e a SpO2 será baixa. Sem tratamento, o recém-nascido poderá morrer em pouco tempo.
Devido ao baixo débito cardíaco, existe acidose metabólica e a PaCO2 está habitualmente normal, ou até, diminuída. A hipoxémia é ligeira a moderada e os lactatos estão elevados.
O diagnóstico pré-natal desta cardiopatia tem importância fundamental, dado que nos casos com septo interauricular restritivo, poderá fazer-se septostomia ou dilatação com balão in utero (entre 26 e 34 semanas de idade gestacional).
Quando ocorre um encerramento precoce in utero do foramen ovale, a obstrução à drenagem das veias pulmonares é tão significativa que se desenvolvem linfangiectasias pulmonares que funcionam como via de descompressão do grave edema pulmonar que se instala. Tal situação comporta mortalidade de 100%, mesmo com descompressão da aurícula esquerda.
Dada a gravidade da doença e a inexistência de tratamento definitivo, em determinados centros pondera-se a interrupção da gravidez.
O diagnóstico neonatal precoce destes doentes poderá permitir a descompressão da aurícula esquerda por atriosseptostomia.
Manifestações clínicas
A SCEH manifesta-se logo nas primeiras horas de vida com o quadro típico dos obstáculos esquerdos graves: insuficiência cardíaca de baixo débito (choque), que se manifesta por dificuldade respiratória, hipoxémia, acidose, vasoconstrição das extremidades, pulsos débeis e taquicardia. Existe sempre certo grau de cianose, variável, em função do volume de shunt a nível auricular. Também coexistem os sinais típicos de aumento de débito pulmonar, traduzidos por polipneia, gemido, taquicardia e hepatomegalia. Como foi referido antes, quanto maior o débito pulmonar, menor o grau de cianose e sintomatologia mais exuberante de insuficiência cardíaca.
Na auscultação cardíaca, o segundo ruído é único e de intensidade aumentada; habitualmente não existem sopros, auscultando-se quase sempre um terceiro ruído e, frequentemente, ritmo de galope.
O baixo débito deixa os recém-nascidos prostrados e debilitados, por vezes com recusa alimentar. O quadro clínico agrava-se durante a primeira semana de vida; na ausência de terapêutica, surge desfecho fatal em poucos dias.
Exames complementares
Radiografia do tórax
Revela sinais de cardiomegalia com evidente hipertrofia do ventrículo direito e a ponta supradiafragmática. Pode ainda ocorrer dilatação da aurícula direita e sinais de congestão venosa pulmonar e de edema (por comunicação interauricular muito pequena ou ausente). Os campos pulmonares, em relação com o edema, revelam sinais de hipotransparência generalizada “tipo microgranitado/granular” ou “pulmão branco” semelhantes aos sinais habituais nos casos de infecção por Streptococcus do grupo B, ou da doença da membrana hialina no recém-nascido. (Figura 1)
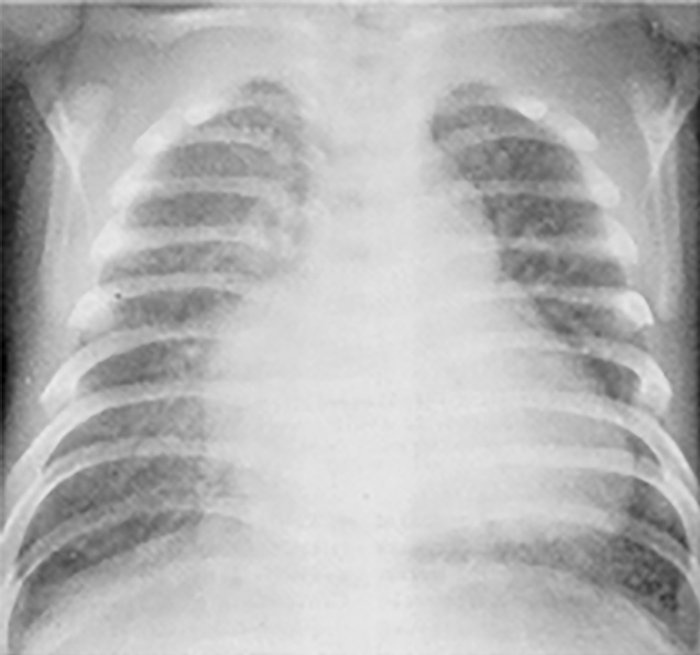
FIGURA 1. Radiografia do tórax de recém-nascido com SCEH: note-se o aumento da silhueta cardíaca à custa do ventrículo direito (ponta supradiafragmática) e da artéria pulmonar; plétora e edema pulmonar
Electrocardiograma
Revela sinais de taquicardia sinusal e hipertrofia ventricular direita com padrão qR ou R exclusivo nas derivações pré-cordiais direitas e inferiores; monotonia na progressão R/S nas derivações pré-cordiais, consequente à diminuição da massa ventricular esquerda. Podem registar-se ondas R amplas nas derivações precordiais V5 e V6, as quais recolhem potenciais do ventrículo direito dilatado e hipertrofiado. Geralmente observam-se também alterações generalizadas da repolarização ventricular com T negativos; nas derivações direitas a onda T é geralmente positiva reflectindo a hipertrofia ventricular direita.
Ecocardiograma
O ecocardiograma é suficiente para fazer o diagnóstico morfológico, avaliar a gravidade da situação, estabelecer a emergência da terapêutica, avaliar a função ventricular direita, detectar regurgitação tricúspide, e identificar cardiopatias associadas. Existe, frequentemente, coarctação da aorta associada e, raramente, defeito completo do septo aurículo-ventricular e comunicação interventricular.
Na avaliação inicial do doente assume também um papel fundamental a observação da função neurológica e da perfusão cerebral através da ecografia transfontanelar, sendo sempre de mau prognóstico qualquer alteração deste sistema.
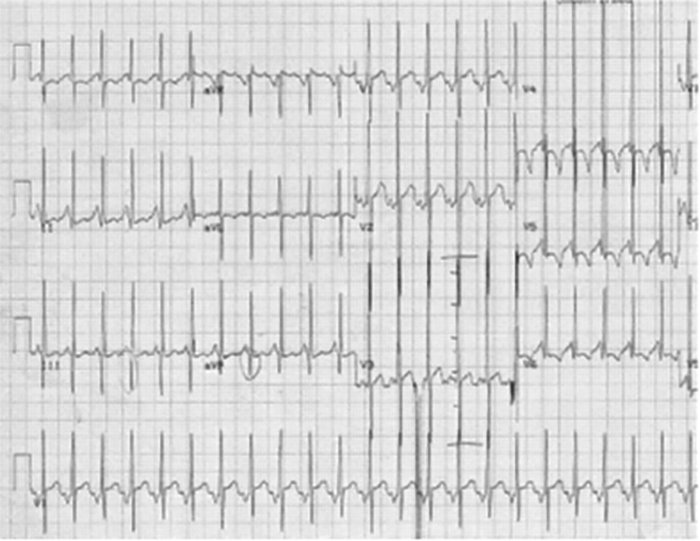
FIGURA 2. Electrocardiograma do mesmo recém-nascido da Figura 1: podem observar-se os achados típicos descritos no texto
Cateterismo cardíaco
Esta técnica está apenas indicada para intervenção em situação de emergência para realizar atriosseptostomia com cateter de balão, ou para perfuração septal e angioplastia com colocação de stent no septo interauricolar.
Tratamento
O tratamento do SCEH envolve geralmente quatro opções: (1) correcção cirúrgica, (2) paliação híbrida com banding cirúrgico das artérias pulmonares e implantação de stent no canal arterial, (3) transplante cardíaco ou (4) conduta expectante e conforto.
Tratamento médico
O tratamento médico tem como finalidade essencial a estabilização hemodinâmica através da permeabilidade do canal arterial; para tal deve iniciar-se tão cedo quanto possível a perfusão de prostaglandina E1 (dose inicial de 0,5-1 μg/Kg/min). Simultaneamente convém corrigir todas as alterações que potenciem o agravamento clínico: correcção da acidose metabólica ou outras alterações iónicas; corrigir a anemia; em casos extremos pode ser necessário proceder a ventilação mecânica e/ou suporte inotrópico, para melhorar temporariamente o quadro de baixo débito.
Tratamento cirúrgico
Na última década verificaram-se avanços consideráveis na abordagem pré, peri e pós-operatória dos doentes com SCEH.
A correcção cirúrgica prevê uma reconstrução por fases, sendo necessárias três intervenções: a primeira realizada de preferência nas duas primeiras semanas de vida; a segunda por volta dos 5-6 meses de vida; e a terceira, cerca dos 3-4 anos.
O objectivo final é criar uma separação entre as circulações pulmonar e sistémica, resultando em alívio da cianose, redução da sobrecarga de volume sobre o ventrículo direito e permitindo manter um débito cardíaco adequado, sem aumento significativo da pressão venosa central.
O risco das intervenções cirúrgicas é, contudo, ainda significativo. Um estudo multicêntrico utilizando dados colectados pela Congenital Heart Surgeons Society, descreveu os desfechos da correcção cirúrgica para SCEH. Este estudo mostrou que a sobrevida imediata após a cirurgia é de 72%. A probabilidade de sobrevida aos 5 anos é de apenas 60 a 70%.
Os objectivos da chamada abordagem híbrida, efectuada pela primeira vez em Portugal no Hospital de Santa Marta, são os de assegurar um débito sistémico não restritivo através do canal arterial (implantando um stent); facilitar o retorno venoso pulmonar através de uma ampla comunicação interauricular (angioplastia e implantação de stent); reduzir as pressões da artéria pulmonar; e, balancear os fluxos sistémico e pulmonar através da limitação do último (pela colocação de bandings em ambos os ramos principais). Tem particular indicação em doentes de alto risco (peso <3 kg; prematuridade e aortas muito hipoplásicas).
O sucesso do transplante cardíaco depende da disponibilidade de órgãos para transplante. No período neonatal, a disponibilidade de corações para transplante é reconhecidamente pequena, resultando em elevada mortalidade na lista de espera.
A atitude de prestar apenas cuidados de suporte, sem intervenção cirúrgica, é sempre questionável e tem vindo a ter cada vez menos adeptos.
Prognóstico
Os sobreviventes têm limitações de esforço físico necessitando de acompanhamento para toda a vida, exames cardiovasculares e internamentos, assim como de terapêutica médica. São frequentes várias complicações, das quais as arritmias (taquicardias auriculares ou bradiarritmias) são as mais prevalentes, a cianose de agravamento progressivo, o risco aumentado de fenómenos trombo-embólicos, a enteropatia exsudativa com perda de proteínas, bronquite, disfunção hepática com evolução para cirrose e, por fim, insuficiência cardíaca. A esperança média de vida encontra-se muitíssimo reduzida tal como referido antes, mesmo nos doentes que foram submetidos a tratamento “correcto e bem sucedido”.
BIBLIOGRAFIA
Allen HD, et al (eds). Moss and Adams, Heart Disease in Infants, Children and Adolescents including the Fetus and Young Adult. Philadelphia: Williams & Wilkins, 2001
Anderson RH, Baker EJ Macartney FJ, Rigby ML, Shinebourne EA, Tynan M (eds). Paediatric Cardiology. London: Churchil Livingstone, 2002
Bacha EA, Daves S, Hardin J, et al. Single-ventricle palliation for high-risk neonates: the emergence of an alternative hybrid stage I strategy. J Thorac Cardiovasc Surg. 2006; 131:163 -171.
Boucek RJJr, Chrisant MR. Cardiac transplantation for hypoplastic left heart syndrome. Cardiol Young 2004; 14 (Suppl 1): 83-87
Bove EL, Ohye RG, Devaney EJ. Hypoplastic left heart syndrome: conventional surgical management. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu 2004; 7: 3-10
Galantowicz M, Cheatham JP. Lessons learned from the development of a new hybrid strategy for the management of hypoplastic left heart syndrome. Pediatr Cardiol 2005; 26:190-199
Grossfeld P, Nie S, Lin L, et al. Hypoplastic left heart syndrome: a new paradigm for an old disease? J Cardiovasc Dev Dis 2019; 6(1):10. doi: 10.3390/jcdd6010010
Jacobs ML. Orchestrating a symphony – fetal and transitional interventions for congenital heart disease. Mayo Clin Proceed 2019; 94:194-198
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Konn AA, Ackerson L, Lo B. How pediatricians counsel parents when no “best-choice” management exists: lessons to be learned from hypoplastic left heart syndrome. Arch Pediatr Adolesc Med 2004; 158: 436-441
Laranjo S , Costa G, Freitas I, Martins JDF, Bakero L, Trigo C, Fragata I , Fragata J, Pinto FF. The hybrid approach for palliation of hypoplastic left heart syndrome: Intermediate results of a single-center experience. Rev Port Cardiol 2015; 34: 347-355
Marshall AC, van der Velde ME, Tworetzky W, Gomez CA, Wilkins-Haug L, Benson CB, Jennings RW, Lock JE. Creation of an atrial septal defect in utero for fetuses with hypoplastic left heart syndrome and intact or highly restrictive atrial septum. Circulation 2004; 110: 253-258
Norwood WI, Lang P, Hansen DD. Physiologic repair of aortic atresia-hypoplastic left heart syndrome. N Engl J Med 1983; 308:23-26
Park MK (ed). Park’s Pediatric Cardiology for practitioners. Philadelphia: Elsevier, 2014
Razzouk AJ, Chinnock RE, Gundry SR, et al. Transplantation as a primary treatment for hypoplastic left heart syndrome: intermediate-term results. Ann Thorac Surg. 1996; 62:1-7
Rebelo M, Veiga E, Machado AJ, Pinto F, Kaku S. Síndrome do coração esquerdo hipoplásico com encerramento in utero do foramen ovale: Caso clínico. Rev Port Cardiol 2006; 25: 331-336
Tabbutt S, Ghanayem N, Ravishankar C, et al. Risk factors for hospital morbidity and mortality after the Norwood procedure: a report from the Pediatric Heart Network Single Ventricle Reconstruction Trial. J Thorac Cardiovasc Surg. 2012; 144:882-95
Vlahos AP, Lock JE, McElhinney DB, van der Velde ME. Hypoplastic left heart syndrome with intact or highly restrictive atrial septum. Outcome after neonatal transcatheter atrial septostomy. Circulation 2004; 109: 2326-2330