Aspectos epidemiológicos e importância do problema
Nas últimas duas décadas, a incidência de acidentes vasculares cerebrais (AVC) em idade pediátrica tem aumentado, sendo referidas actualmente frequências entre 2 e 8 por 100.000 habitantes em idade pediátrica por ano. Essencialmente, duas circunstâncias poderão explicar este aumento: a utilização dos métodos de neuroimagem mais sensíveis e específicos – tomografia axial computadorizada (TAC), ressonância magnética (RM), angiorressonância (ARM) e estudos ecográficos cranianos – permitindo o diagnóstico de pequenas lesões anteriormente indetectáveis; por outro lado, tratamentos mais eficazes têm permitido maior sobrevivência de doentes em risco de complicações vasculares, incluindo prematuridade, cardiopatia congénita, doença de células falciformes e leucemia.
Diferenças importantes entre os AVC de adultos e crianças colocam, por vezes, dificuldade no reconhecimento e tratamento desta situação. Estas diferenças incluem: 1) a relativa raridade desta patologia nas crianças, aliada a apresentações clínicas subtis e inespecíficas nas mais jovens; 2) a multiplicidade de factores de risco que muitas vezes se sobrepõem; 3) diferenças de desenvolvimento nos sistemas neurológico, cerebrovascular e da coagulação. Estas diferenças limitam muitas vezes a extrapolação dos resultados dos estudos de investigação em adultos sobre AVC para a idade pediátrica.
A importância deste problema pode sintetizar-se do seguinte modo:
- afecção cada vez mais reconhecida como causa de morte (uma das dez principais), e de incapacidade, na criança e jovem;
- frequência semelhante à dos tumores do SNC, e incidência aumentando com a idade: de cerca de 2 a 8 casos por 100.000 habitantes, dos 5 aos 14 anos por ano;
- no período neonatal surge em cerca de 1 para 2.300 partos de termo, com uma frequência 17 vezes superior à verificada noutras idades pediátricas.
Classificação e etiopatogénese
Os AVC podem ser de tipo isquémico ou hemorrágico. Os AVC isquémicos, mais frequentes, dão por vezes origem a hemorragia secundária, tornando necessário considerar muitas situações de trombose no diagnóstico diferencial de hemorragia.
Os AVC isquémicos podem ser de origem arterial ou venosa, com uma relação arterial/venosa de 3/1 no período pós-neonatal, e de 2/1 no RN. Alguns factores etiológicos são comuns aos vários tipos de AVC, diferindo muitas vezes consoante o grupo etário e o tipo de associação de vários factores de risco.
Os factores etiológicos de AVC em idade pediátrica são numerosos e diferem grandemente dos verificados nos adultos. Estão relacionados com a idade e são frequentemente múltiplos (Quadro 1).
QUADRO 1 – Factores etiológicos de doença cerebrovascular na idade pediátrica
| Factores etiológicos de doença cerebrovascular na idade pediátrica | ||
Cardiopatias congénitas
Cardiopatias adquiridas
Malformações cerebrovasculares congénitas
Traumatismo
Iatrogenia
| Vasculites
Arteriopatias
Doenças vasospásticas
Doenças hematológicas
| Coagulopatias adquiridas
Coagulopatias congénitas
Doenças metabólicas
|
A verificação de AVC intra-uterino tem sido associada a múltiplos factores etiológicos, sendo que nalguns casos a evidência é apenas marginal: trauma, pré-eclampsia, diabetes materna, uso de drogas pela mãe (ex. cocaína), infecção fetal (em particular por citomegalovírus), várias doenças fetais que causam hidropisia fetal. Admite-se também que algumas trombofilias (nomeadamente relacionada com a mutação de Leiden do Factor V) desempenham também um papel na etiologia de enfartes cerebrais na vida intra-uterina.
Nos recém-nascidos a etiologia do AVC na maioria dos casos é desconhecida. Os dados da literatura apontam para uma prevalência de enfarte arterial neonatal de cerca de 1/4.000; poderá ser superior, dado que se presume que nem todos sejam sintomáticos inicialmente. É mais provável enfarte embólico (de origem placentar ou cardíaca) do que enfarte trombótico. É possível que situações de trombofilia (congénita, ou adquirida como anticorpos maternos com transmissão transplacentar – anticorpos antifosfolípidos) desempenhem papel importante. Estão ainda descritos como prováveis factores etiológicos: trauma, sépsis e asfixia.
Deve salientar-se que um enfarte cerebral neonatal é uma importante causa de convulsões neonatais (12 a 17,5% segundo várias séries).
Nalguns lactentes em que se diagnostica hemiplegia, verifica-se lesão cerebral vascular exibindo padrão compatível com ocorrência na vida fetal tardia ou pós-natal.
Nalgumas crianças (com cardiopatia estrutural conhecida ou com doença de células falciformes) a causa do AVC é óbvia. Em crianças com doenças crónicas que predispõem para AVC, uma intercorrência aguda, como desidratação, sépsis e outras, podem precipitar um AVC. No entanto, em cerca de 50% dos casos o AVC ocorre em crianças sem doença prévia conhecida.
Num estudo com documentação angiográfica cerca de 50% dos enfartes cerebrais em crianças eram devidos a uma arteriopatia (a uma anomalia primariamente vascular). Neste grupo o diagnóstico etiológico mais frequente foi dissecção arterial e síndroma moya-moya.
Estudos recentes concentraram-se de novo no papel de varicela como causador de vasculopatia cerebral: num destes verificou-se que tal infecção (no período de 12 meses antecedendo o AVC) tinha sido três vezes mais frequente que a incidência num grupo controlo.
Para além dos factores de risco adquiridos (como os anticorpos antifosfolípidos) e do risco protrombótico, estão descritas várias anomalias genéticas que podem influenciar o risco de tromboembolismo (em muitos casos arterial e venoso) associadas a factores ambientais, como trauma, imobilização, septicémia, etc..
O papel de alguns dos factores de risco tradicionais na população adulta como dislipoproteinémia ou hipertensão arterial pode ser também relevante em idade pediátrica.
O AVC pode ainda ser a manifestação inicial de uma doença sistémica como lúpus eritematoso disseminado, diabetes ou neoplasia.
A identificação de factores de risco de doença cerebrovascular é, pois, extremamente importante dado que a recorrência e o prognóstico estão fortemente relacionados com o número e o tipo de factores de risco. Por outro lado, o tratamento de um episódio agudo e a prevenção das recorrências dependem da causa subjacente.
Manifestações clínicas
Nesta alínea é realçado o papel dos factores de risco.
1. Acidente isquémico arterial (AIA)
A presença de vasculopatia constitui factor de risco de AIA e de recorrência; daí a importância de a caracterizar.
Existe um grande espectro de vasculopatias, algumas reversíveis, outras progressivas.
A chamada arteriopatia cerebral transitória monofásica da infância pode corresponder ao tipo mais comum de arteriopatia em crianças com AIA. A etiologia desta situação não é conhecida e o respectivo diagnóstico baseia-se apenas no quadro clínico e imagiológico (incluindo a aparência em angiografia).
A angiopatia pós-varicela (uma arteriopatia transitória) que ocorre semanas a meses após episódio de varicela não complicada, tem sido cada vez mais reconhecida como causa de enfarte isquémico. Com uma incidência de 1/15.000 crianças com varicela, associa-se a enfarte dos gânglios da base e estenose da carótida interna distal, artérias cerebrais anterior, média e posterior proximal.
O enfarte isquémico pós-herpes zóster oftálmico (vários dias ou semanas após a erupção cutânea) pode ocorrer por trombose no território da artéria cerebral média ipsilateral, provavelmente resultante da invasão da artéria através do nervo trigémio.
A meningite pode causar inflamação dos vasos cerebrais que atravessam o espaço subaracnoideu infectado e promover oclusão venosa ou arterial.
A vasculite cerebral associada a vasculites sistémicas ou outras doenças é uma causa relativamente rara de AVC em crianças (sendo o lúpus eritematoso disseminado a causa mais importante neste grupo).
A dissecção das artérias carótida ou vertebral pode ocorrer em associação com traumatismo craniano, cervical ou intra-oral, ou espontaneamente. A dissecção é diagnosticada em 9-20% de crianças com AIA. O défice neurológico pode surgir imediatamente após a lesão ou tardiamente. As descrições iniciais referem casos de dissecção usualmente traumática das artérias carótidas e vertebrais, mas provou-se que pode ocorrer também dissecção no território vascular intracraniano.
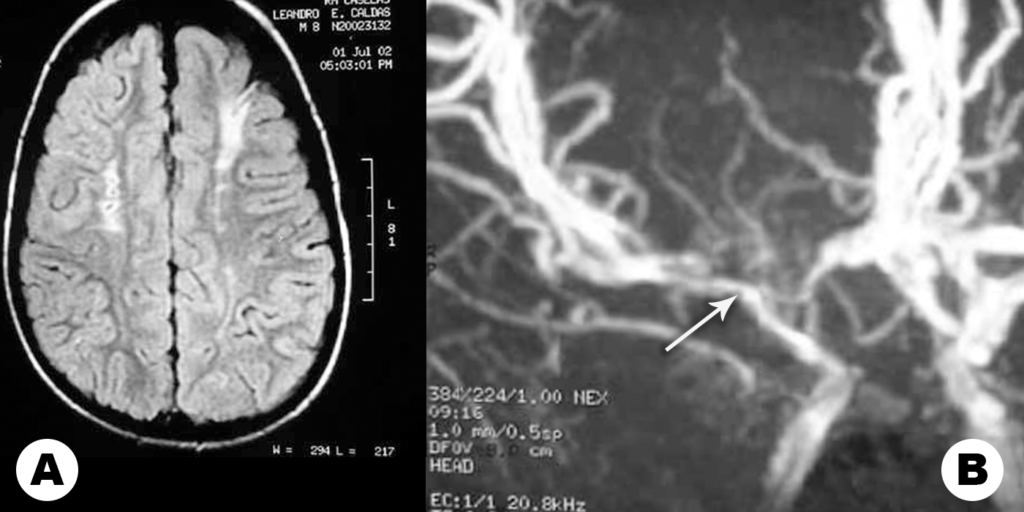
FIGURA 1. AVC e RM; A: Múltiplas lesões isquémicas assinaladas, com localização frontal, bilaterais, num doente com 7 anos, portador de drepanocitose homozigótica, em regime hipertransfusional. B: Angio-RM revelando sinais de grave estenose da artéria cerebral média à direita (seta).
A síndroma moyamoya é uma vasculopatia cerebral da infância, progressiva e grave, que consiste na oclusão gradual das artérias intracranianas, com subsequente desenvolvimento de uma rede de pequenos vasos colaterais que dá o aspecto angiográfico característico (“puff of smoke”). Pode ser idiopática (maioria dos casos) ou estar relacionada a síndromas genéticas (neurofibromatose, trissomia 21), ou ainda a lesões adquiridas das artérias cerebrais como a vasculopatia da radiação ou anemia de células falciformes.
A vasculopatia pós-irradiação apresenta-se como uma estenose progressiva dos grandes vasos, com acidentes isquémicos transitórios ou AVC vários meses a anos após irradiação de gliomas do quiasma óptico ou outros tumores da região selar ou supra-selar.
A doença de células falciformes é a causa mais frequente de AVC em crianças, em determinadas áreas geográficas (Figura 1)
Com a idade de 20 anos, em cerca de 11% dos doentes homozigóticos (HbSS) verifica-se o problema. Os enfartes isquémicos podem resultar dos episódios vasoclusivos cerebrais múltiplos, ou de uma arteriopatia progressiva característica que envolve predominantemente a artéria carótida interna distal e a artéria cerebral média proximal; pode surgir mais tarde um quadro do tipo moyamoya nos casos graves.
A incidência global das doenças protrombóticas em crianças com AVC é referida entre 10 e 50%. As anomalias protrombóticas associadas a AVC nas crianças podem ser congénitas ou adquiridas e incluem: défices de proteína C, de proteína S, de antitrombina III, de plasminogénio; presença de resistência à proteína C activada (Factor V de Leiden); mutação do gene 20210 da protrombina; anticorpo anticardiolipina, anticoagulante lúpico, e valores séricos elevados de homocisteína e de lipoproteína (a) [Lp(a)].
A presença do anticorpo anticardiolipina é a doença adquirida mais comum, enquanto a situação associada ao factor V de Leiden, a situação congénita mais comum.
Vários defeitos podem ocorrer simultaneamente, sobretudo nos défices adquiridos.
Outros factores de risco como a desidratação e infecção podem aumentar o risco de trombose.
Em 25% das crianças com AVC de tipo embólico, as cardiopatias congénitas são a causa subjacente. O AVC pode ocorrer espontaneamente ou estar associado a procedimentos cardíacos (cateterismo ou cirurgia). As cardiopatias cianóticas aumentam o risco de tromboembolismo devido à policitémia. Se existir um shunt intracardíaco direito-esquerdo, pode ocorrer uma embolia paradoxal (proveniente do território venoso).
O prolapso da válvula mitral é uma anomalia relativamente frequente e habitualmente assintomática. Não são actualmente identificáveis os doentes em risco de AVC embólico, havendo contudo a estimativa de que 1 em 6.000 casos por ano irá ter uma complicação deste tipo. Os AVC cardioembólicos de origem mitral podem afectar a circulação carotídea ou vertebrobasilar. A apresentação inicial é mais frequentemente a de um acidente isquémico transitório.
A situação de foramen ovale patente também se pode associar a AVC, de acordo com publicações recentes. Efectivamente, como resultado de esforços ou manobras de Valsalva foram demonstrados enfartes múltiplos bilaterais.
A apresentação clínica depende da idade, do tipo de AVC e do mecanismo fisiopatológico da lesão cerebral subjacente.
Um AIA pré-natal é geralmente diagnosticado quando se torna evidente hemiparésia entre os 4 e os 8 meses de idade.
No recém-nascido, um AIA tipicamente manifesta-se por letargia ou convulsões focais e hemiparésia transitória. Os sinais focais persistentes são raros.
Nos lactentes mais velhos e nas crianças em idade pré-escolar frequentemente verifica-se um início abrupto de hemiplegia. As crianças em idade escolar e adolescentes podem apresentar sinais mais subtis, como afasia, alterações visuais, cefaleia ou défices sensitivos focais, para além da hemiparésia.
Na síndroma moyamoya os doentes apresentam-se com enfarte cerebral agudo. Têm sido descritos também acidentes isquémicos transitórios, hemiplegia alternante, coreia ou outras doenças do movimento. Pode ocorrer disfunção clínica insidiosa, com deterioração intelectual, cefaleia crónica ou alterações da linguagem. A frequência dos acidentes isquémicos é maior nos primeiros 4 anos após o início dos sintomas.
Nos doentes mais velhos há um risco de hemorragia subaracnoideia.
As convulsões podem acompanhar o AVC em cerca de 50% das crianças.
2. Trombose sinovenosa
A trombose dos seios venosos (TSV) pode resultar de uma combinação de factores intravasculares e vasculares.
Os recém-nascidos são o grupo etário com maior incidência de TSV. Os factores de risco associados com AVC no período neonatal são: estados de hipercoagulabilidade maternos, hematócrito elevado, shunt intracardíaco direito-esquerdo transitório, asfixia, sépsis e desidratação.
As infecções localizadas da cabeça e pescoço, como mastoidite, meningite, sinusite e otite média existem em cerca de 23% das crianças com TSV, predominando no grupo etário pré-escolar.
Doenças sistémicas crónicas, incluindo lúpus eritematoso sistémico, síndroma nefrótica, doença inflamatória intestinal, doenças hematológicas, doenças cardíacas e outras, são factores de risco subjacentes, presentes em 60% dos casos e nas crianças mais velhas.
Os estados pró-trombóticos são factor de risco de trombose venosa ou arterial.
Nas TSV podem ocorrer enfartes do parênquima cerebral (cerca de 40% dos casos).
A TSV em recém-nascidos manifesta-se mais frequentemente com convulsões e letargia. Os lactentes com oclusão sinovenosa extensa podem apresentar dilatação das veias da cabeça, fontanela anterior procidente e diastase das suturas cranianas.
Em crianças mais velhas a apresentação mais frequente é a de um quadro clínico de “pseudotumor cerebri”, com cefaleias, papiledema e, ocasionalmente, parésia do VI° par uni ou bilateral. Estão presentes alterações visuais em 18% dos casos; hemiparésia e outros sinais focais surgem em 35-45% dos casos e relacionam-se com a presença de enfarte venoso. As convulsões podem ocorrer como primeira manifestação em 70% dos recém-nascidos e em 48% de crianças com TSV.
3. Hemorragia cerebral
As malformações vasculares (malformações e fístulas arteriovenosas) são a principal causa de hemorragia intraparenquimatosa e subaracnoideia não traumática em crianças. De salientar o predomínio da localização intraparenquimatosa sobre a subaracnoideia (relação de 2,5/1).
Os aneurismas arteriais ocorrem menos frequentemente em crianças e adolescentes que nos adultos. As malformações cavernomatosas também podem originar AVC hemorrágico na idade pediátrica.
A hemorragia cerebral pode ocorrer em situações de trombocitopénia com valores inferiores a 20.000/mmc embora raramente; quando surge, está associada a trauma.
Várias coagulopatias hereditárias ou adquiridas têm sido associadas a hemorragia intracraniana: a hemofilia A e B, outros défices congénitos de factores da coagulação (ex. factor VII, XIII), o défice da vitamina K em recém-nascidos (actualmente raro devido à administração de vitamina K após o parto), a coagulopatia secundária a doença hepática ou a coagulação intravascular disseminada. Embora o risco individual relativamente a cada uma destas doenças não seja elevado, o seu risco colectivo é considerável.
Nas crianças com doença de células falciformes a hemorragia é menos comum que o enfarte, podendo ocorrer hemorragia subaracnoideia e intraparenquimatosa, particularmente em doentes mais velhos.
De referir a possibilidade de transformação hemorrágica de um enfarte isquémico, venoso ou arterial, o que amplia o diagnóstico diferencial das hemorragias intraparenquimatosas. O enfarte hemorrágico é provavelmente mais comum após embolia do que após trombose, sendo importante considerar o risco de hemorragia em crianças com embolismo, que requerem anticoagulação.
A hemorragia no interior de um tumor intracerebral é relativamente comum. É mais frequente em tumores de alta malignidade, como os meduloblastomas ou os tumores neuroectodérmicos primitivos.
A encefalopatia hemorrágica pode constituir complicação da hipernatrémia grave. Os achados patológicos característicos são: múltiplas hemorragias pericapilares ou tromboses capilares, hemorragias subaracnoideia e subdural, e trombose dos seios venosos.
A hipertensão arterial sistémica é uma causa rara de enfarte e hemorragia cerebral em crianças, ao contrário do que acontece em adultos. Pode ser um factor de risco cumulativo em crianças com outra patologia, como doença de células falciformes ou arterite.
Diagnóstico
Exames imagiológicos
- Tomografia axial computadorizada (TAC). É geralmente o estudo inicial; de referir que a TAC poderá não revelar alterações nas primeiras 24 a 48 horas após um acidente isquémico.
- Ressonância magnética (RM). É mais sensível que a TAC na detecção precoce e em enfartes pequenos, particularmente na fossa posterior. É mais sensível para detectar conversão hemorrágica dos enfartes. Técnicas mais recentes em RM (difusão, perfusão, espectroscopia) melhoraram ainda a detecção precoce e a especificidade. Nos recém-nascidos, um enfarte isquémico poderá somente ser detectado em imagens de difusão porque a RM tradicional é menos sensível para este diagnóstico num cérebro não mielinizado. A RM com venografia permite o diagnóstico de trombose dos seios venosos.
- Angiorressonância. É um exame não invasivo que permite a avaliação das principais artérias cerebrais ao nível do polígono de Willis. No entanto, por vezes subestima o grau de estenose e a presença de oclusão, não permitindo identificar anomalias nas artérias de médio e pequeno calibre. Também tem limitações quanto à detecção de sinais específicos de vasculite e dissecção.
- Angiografia convencional. Quando é necessário um diagnóstico vascular mais específico realiza-se este exame.
- Doppler das carótidas e doppler transcraniano. É útil para detecção de vasculopatia nos grandes vasos (ex. na anemia de células falciformes)
- Ecocardiograma.
Outros exames complementares
Em função do contexto clínico haverá que proceder a determinados exames complementares no sangue, urina e ou LCR, a seleccionar:
- Hemograma com plaquetas;
- Tempo de protrombina e PTTa;
- Electroforese de hemoglobinas;
- Proteína S (total e livre), proteína C, antitrombina III;
- Factor V de Leiden (resistência à proteína C activada);
- Plasminogénio, factor de von Willebrand, factor VIII, factor XII;
- Anticoagulante lúpico, anticorpos anticardiolipina;
- Mutação 20210 do gene da protrombina;
- Homocisteína total, metileno-tetra-hidrofolato-redutase, folato, vitamina B6 e vitamina B12, amónia, aminoacidémia, lactato no plasma e LCR;
- Ácidos orgânicos na urina;
- Colesterol total, das HDL, das LDL, triglicéridos, Lipoproteína (a), Apo A, Apo B;
- Anticorpos antivaricela-zóster séricos e no líquido cefalo-raquidiano;
- Estudo toxicológico.
Tratamento
O tratamento dos AVC em crianças é dirigido primariamente para os factores de risco subjacentes e para a prevenção de episódios isquémicos cerebrais recorrentes.
Importa referir que as normas de orientação terapêutica para os AVC pediátricos, baseadas em consensos e opiniões de peritos e sociedades científicas, variam de país para país, o que reflecte a necessidade de continuação de estudos prospectivos em larga escala.
Seguidamente procede-se à sistematização de acordo com a experiência dos autores.
Antiagregantes plaquetares
(ácido acetilsalicílico – AAS)
Não existem estudos controlados com o uso de AAS ou qualquer outro antiagregante plaquetar em crianças. No entanto, o AAS tem sido usado cada vez mais na prática clínica em crianças com AVC isquémicos arteriais, como forma de prevenir um episódio recorrente.
Apesar do risco teórico de síndroma de Reye (ver Glossário Geral) em crianças submetidas a terapêutica prolongada com AAS, os dados da literatura são escassos.
A dose diária recomendada é 3 a 5 mg/Kg/dia (dose antiagregante plaquetar).
Nota: Em determinados centros utiliza-se o clopidogrel como antiagregante plaquetar.
Anticoagulantes
a) Heparina e heparina de baixo peso molecular
Embora não existam ensaios clínicos de grande escala utilizando heparina em crianças com AVC, a experiência acumulada sugere que as crianças podem ser tratadas com as mesmas linhas orientadoras dos adultos, com segurança razoável.
A anticoagulação como primeira escolha é usada em determinados centros em crianças com embolia cerebral de origem cardíaca, dissecção arterial, trombose dos seios venosos, doenças da coagulação, trombose recorrente ou elevado risco de embolismo (ex. coágulo intracardíaco).
b) Varfarina
A utilização de varfarina constitui o meio de anticoagulação prolongada mais eficaz. A experiência clínica sugere que pode ser usada em crianças e adolescentes com razoável segurança. As crianças afectadas deverão evitar actividades com risco de lesão traumática tais como desportos de contacto.
As principais indicações incluem: cardiopatia congénita ou adquirida, estados de hipercoagulabilidade, dissecção arterial e trombose dos seios venosos.
Nota: Este fármaco não é citado nas normas de alguns centros.
Fibrinolíticos
Os fibrinolíticos actualmente não estão indicados nos AVC em crianças, devido ao risco elevado de complicações hemorrágicas e à falta de estudos de eficácia/segurança.
Em adultos, os benefícios do activador do plasminogénio tecidual (r-tPA) parecem sobrepor-se bastante aos riscos se o mesmo for usado nas primeiras 3 horas após o início dos sintomas de AVC. Dado haver frequentemente atraso no diagnóstico de AVC em crianças, esta terapêutica raramente poderá estar indicada.
Transfusão
Nos casos de doença de células falciformes a prevenção de recorrência faz-se com transfusões regulares (cada 4-6 semanas). O estudo por ecodoppler transcraniano permite identificar crianças em risco que devem ser submetidas a um tratamento hipertransfusional profiláctico com o objectivo de prevenir a progressão da doença vascular cerebral em tal situação.
As complicações graves desta terapêutica (sobrecarga crónica de ferro, com toxicidade cardíaca e endócrina) têm levado a considerar alternativas terapêuticas como a perfusão de hidroxiureia (que aumenta os níveis de Hemoglobina F) e mesmo o transplante de medula óssea.
Tratamento na fase aguda/Neuroprotecção
- Manter posição da cabeça a 30º, pressão arterial e oxigenação adequadas.
- Hipotermia controlada (em centros diferenciados).
- Manter o suprimento de fluidos e o equilíbrio hidroelectrolítico.
- Manter a normalidade da glicémia.
- Manter Hb > 6,2 mmol/L.
- Tratamento agressivo da febre e das convulsões (situações que aumentam as necessidades metabólicas, podendo aumentar a área cerebral com isquémia).
Tratamento neurocirúrgico
- Drenagem nos AVC hemorrágicos.
- Descompressão cirúrgica de grandes enfartes – hemicraniectomia.
- Derivação ventriculoperitoneal.
- Procedimentos de revascularização (ex. na síndroma moyamoya), trombectomia, etc..
Prognóstico
O prognóstico difere consoante as séries. No registo canadiano os principais dados apontam para probalidade de morte ~10% nas formas isquémicas, ~30% nas formas hemorrágicas, e para défice neurológico em 50% dos casos.
A recorrência nas formas isquémicas pós-neonatais é ~20-30% (sobretudo da doença de moyamoya e estados protrombóticos) e nas formas hemorrágicas ~11%.
A sequela neurológica mais frequente é a hemiparésia, mas também ocorrem défices residuais menos óbvios (compromisso da linguagem e outros défices corticais, problemas na aprendizagem e comportamento, etc.).
A epilepsia surge em 10 a 15% das crianças afectadas com AVC. A recorrência estimada de AVC isquémico é inferior a 5% em recém-nascidos, e 20 a 30% em lactentes e crianças mais velhas.
Nas TSV os enfartes venosos e a ocorrência de convulsões na apresentação são factores preditivos de pior prognóstico.
BIBLIOGRAFIA
Aicardi J. Diseases of the Nervous Central System. London: MacKeith Press, 2009
Askalan R, Laughlin S, Mayank S, Chan A, et al. Chickenpox and stroke in childhood: a study of frequency and causation. Stroke 2001; 32: 1257-1262
Baumer JH. Childhood arterial stroke. Arch Dis Child 2004; 89: ep 50 – ep 53
Biller J. Stroke in Children and Young Adults. Philadelphia: Saunders, 2009
deVeber G, Andrew M. Canadian Pediatric Ischemic Stroke Study Group. Cerebral sinovenous thrombosis in children. NEJM 2001;345: 417-423
deVeber G, Roach AS, Riela A, Wiznitzer M. Stroke in children: recognition, treatment and future directions. Semin Pediatr Neurol 2000; 7: 301-308
Ferriero DM, Fullerton HJ, Bernard TJ, et al. Management of stroke in neonates and children: a scientific statement from the American Heart Association/American Stroke Association. Stroke 2019; 50: e51-e96. doi: 10.1161/STR.0000000000000183
Fitzsimons BT, Fitzsimons LL, Sun LR. Laney’s Story: The problem of delayed diagnosis of pediatric stroke. Pediatrics Apr 2019, 143 (4) e20183458;
DOI: 10.1542/peds.2018-3458
Ganesan V, Prengler M, Mcshane MA, Wade AM, Kirkham FJ. Investigation of risk factors in children with arterial ischemic stroke. Ann Neurol 2003; 53: 167-173
Jordan L, Hillis A. Hemorrhagic stroke in children. Pediatric Neurol 2007; 36: 73 – 80
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Laino D, Mencaroni E, Esposito S. Management of pediatric febrile seizures. Int J Environ Res Public Health 2018; 15: 2232.doi: 10.3390/ijerph15102232
Lo WD. Childhood hemorrhagic stroke: an important but unstudied problem. J Child Neurol 2011; 26: 1174 – 1185
Moro M, Málaga S, Madero L. Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Nowak-Gottl U, Gunther G, Kurnik K, et al. Arterial ischemic stroke in neonates, infants and children: an overview of underlying conditions, imaging methods and treatment modalities. Semin Thromb Hemost 2003; 29: 405-414
Roach ES (ed). Pediatric Neurology. Philadelphia: Elsevier, 2019
Rosenblum L. Management of stroke in childhood. BMJ 2005; 330: 1161-1162
Schechter T, Kirton A, Laughlin S, et al. Safety of anticoagulants in children with arterial ischemic stroke. Blood 2012; 119: 949 – 956
Simma B, Holiner I, Luetschg. Therapy in pediatric stroke. Eur J Pediatr 2013; 172: 867-875
Stam J, Bruijn S, deVeber G. Anticoagulation for cerebral sinus thrombosis. Stroke 2003; 34: 1054-1056
Stam J. Thrombosis of the cerebral veins and sinuses. NEJM 2005; 352: 1791-1798. London: John Libbey, 2002