Importância do problema
A Neurologia Pediátrica é uma especialidade devotada ao estudo das afecções do sistema nervoso central (SNC) e periférico, as quais comportam elevada complexidade explicada pelos problemas diagnósticos colocados, pelas dificuldades em estabelecer um prognóstico e pelos escassos recursos terapêuticos disponíveis.
A este propósito, importa referir que grande número de doenças neurológicas detectadas em idades tardias da vida da criança têm origem pré-natal, e que em cerca de 25% das respectivas gravidezes se verificam alterações do SNC explicando, em tais circunstâncias, elevada percentagem de mortes fetais.
Daí, a importância do diagnóstico pré-natal (DPN) incidindo especialmente sobre a patologia do SNC, devido à multiplicidade de diagnósticos neuropatológicos possíveis, dos quais poderão decorrer decisões importantes dos pontos de vista terapêutico, ético e do acompanhamento médico pós-natal.
Desde há várias décadas que a ultrassonografia é utilizada como técnica de imagem amplamente difundida, disponível e indicada por rotina em todas as gravidezes, sendo que os defeitos congénitos ou as alterações adquiridas do SNC representam um dos grupos nosológicos mais frequentemente detectados.
Independentemente do reconhecido valor da ultrassonografia fetal no diagnóstico de patologia do SNC, importa relevar que as respectivas sensibilidade e especificidade são relativamente baixas, o que tem implicações clínicas. A corroborar esta realidade, num estudo prospectivo em 2017 por Griffiths e colaboradores, concluiu-se que a precisão diagnóstica neuropatológica desta técnica é de apenas 68%.
Os avanços recentes da técnica da Ressonância Magnética (RM) tornaram possível uma melhoria da resolução da imagem obtida, oferecendo informação anatómica detalhada de estruturas cerebrais milimétricas. Assim, apesar da menor disponibilidade e do maior custo inerente, o diagnóstico fetal de patologia do SNC tem-se tornado progressivamente mais comum utilizando a RM.
Em termos quantitativos, o panorama actual quanto à precisão diagnóstica de técnicas imagiológicas aplicadas ao SNC do feto pode traduzir-se do seguinte modo: a RM fetal “demarca-se” da ultrassonografia pela sua maior precisão diagnóstica (93%), acrescentando informação adicional ao diagnóstico ultrassonográfico em 49% dos casos e alterando o prognóstico em 20%, com consequente influência nas decisões clínicas em cerca de 1 em cada 3 casos.
Abordagem clínica
O uso indiscriminado de exames complementares e a profusão tecnológica de marcadores biológicos poderão levar ao abuso na utilização daqueles em detrimento da valorização da história clínica.
Na situação específica que tem por base o DPN, o enquadramento clínico dos resultados obtidos por RM fetal deverá sempre ser realizado por uma equipa multidisciplinar constituída por obstetra, pediatra, neonatologista, neurologista pediátrico, neurorradiologista, neurocirurgião, geneticista, entre outros especialistas considerados relevantes.
Depois da recolha e análise da informação disponível, a discussão com a família poderá ser complexa, com implicações médicas, éticas, legais, culturais e filosóficas. Frequentemente a família poderá procurar aconselhamento sobre eventual interrupção da gravidez e definição clara do prognóstico e do tipo de limitações previsíveis durante o crescimento da criança.
De acordo com a lei vigente, a interrupção da gravidez em caso de defeito congénito grave do SNC, apenas poderá ocorrer antes das 24 semanas de gestação, razão pela qual é importante a realização atempada de RM fetal.
Generalidades
A sensibilidade e especificidade diagnósticas da RM fetal são influenciadas não apenas pela sua excelente resolução espacial, mas também pelo facto de ser pouco influenciada pelo morfotipo materno, posição placentária, apresentação fetal ou oligo-hidrâmnio. A possibilidade de aquisição de imagens volumétricas e consequentes reformatações multiplanares, embora realizada com menor frequência, constitui uma vantagem adicional desta técnica.
Tendo como base os dados obtidos em mais de 3 décadas de utilização, não existe prova científica de que a RM fetal tenha qualquer efeito prejudicial sobre o feto ou sobre o desenvolvimento a longo prazo da criança. Desta forma, a RM é considerada uma técnica segura e não invasiva, quando utilizada a partir das 18 semanas de gestação.
Os aspectos observados por RM reflectem alterações da organogénese, da histogénese e da mielinização. Estão claramente identificadas as datas de gestação referentes aos diferentes estádios do volume encefálico, padrão de sulcação, configuração interna e mielinização. (Figura 1)
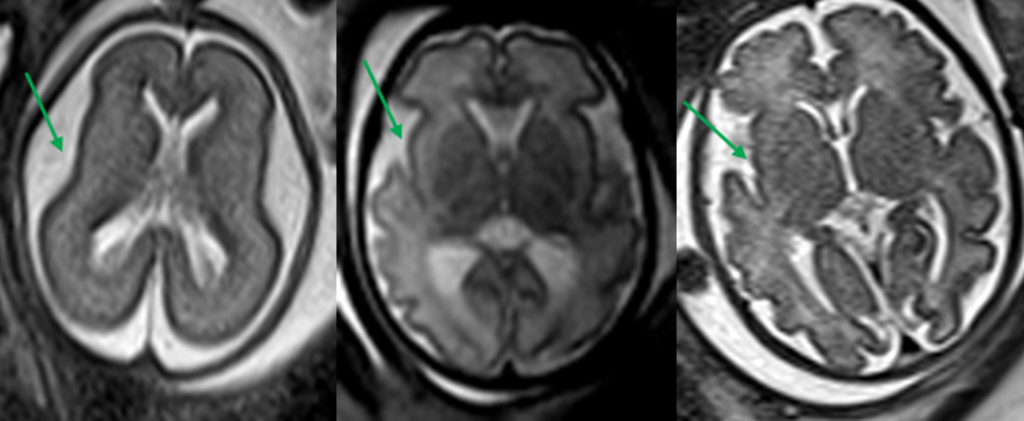
FIGURA 1. Exemplos de normal padrão de sulcação de acordo com idade gestacional (IG), representando sequencialmente, 21 semanas, 28 semanas e 35 semanas, apenas com esboço de fissura sílvica às 21 semanas e desenvolvimento progressivo de sulcos e maior opercularização
Actualmente, o diagnóstico imagiológico fetal é baseado no estudo da morfologia; todavia, está a ser estudada a utilização de técnicas avançadas de RM, como tractografia, espectroscopia e RM funcional. Admite-se que estas técnicas possam vir a dar um valioso contributo quanto ao incremento da sensibilidade e especificidade da RM fetal.
Indicações da RM
A RM fetal não está indicada como método de rastreio. A sua utilização está preconizada apenas após detecção de anomalias por ultrassonografia perante antecedentes familiares relevantes ou a suspeita de lesões potencialmente destrutivas, causadas por factores maternos, como coagulopatia, hipóxia, trauma ou infecção. As indicações mais comuns estão enunciadas no Quadro 1, sendo a ventriculomegália a mais frequente.
QUADRO 1 – Indicações comuns da realização de RM fetal
| Ventriculomegália |
| Suspeita de defeito congénito |
| Lesão destrutiva potencial |
| Anomalias congénitas fetais múltiplas |
| Antecedentes familiares de anomalias congénitas e/ou de doença genética |
| Infecção materna |
| Gravidez gemelar com transfusão fetofetal e avaliação pós-ablação de vasos placentários por técnica de laser |
Tendo em conta os objectivos deste livro, dispensando-nos de descrição pormenorizada, as alterações fetais do SNC identificadas por RM, neste capítulo são descritas de modo sucinto as mais representativas e frequentes.
Alterações fetais do SNC
Ventriculomegália
Relativamente a esta alteração – ventriculomegália -, (Figura 2) facilmente identificável por RM fetal, a respectiva causa apenas em 60% dos casos é esclarecida. É importante referir que a ventriculomegália se acompanha de outra alteração do SNC (disgenésia do corpo caloso, por ex.) em 85% dos casos, sendo a RM um instrumento valioso para a sua detecção.
O prognóstico desta situação depende da causa da dilatação ventricular, da idade gestacional em que ocorre, e da sua progressão. Todavia, ventriculomegália ligeira está associada a atraso do neurodesenvolvimento em 19 a 36% dos casos, sendo este mais prevalente se existirem concomitantemente outras anomalias do SNC associadas.
Lesões adquiridas do SNC
Lesões destrutivas, isquémicas, hemorrágicas, calcificações ou tumores podem ocorrer como consequência de doença materna ou fetal adquirida.
A RM permite a identificação da presença de produtos de degradação da hemoglobina. A presença de pequenas hemorragias da matriz germinal (Figura 3) é relativamente frequente, muitas vezes com significado clínico indeterminado. No entanto, as hemorragias da matriz germinal podem causar lesão parenquimatosa extensa com consequências sérias no neurodesenvolvimento (Figura 4). A detecção de produtos de degradação da hemoglobina ajuda a identificar a potencial causa de ventriculomegália ou porencefalia. A RM é particularmente sensível no diagnóstico de lesões isquémicas agudas e subagudas, ao contrário da ultrassononografia.
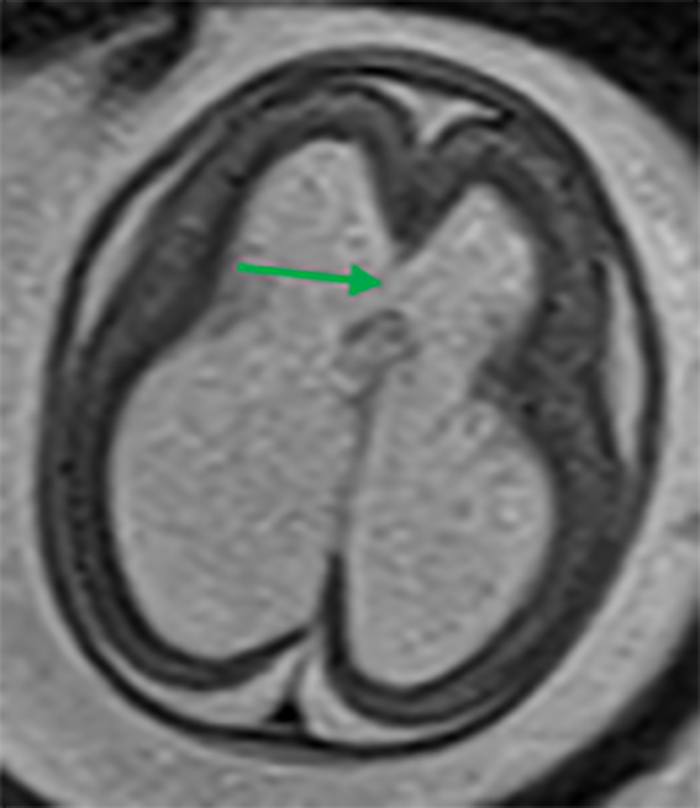
FIGURA 2. Marcada dilatação ventricular supratentorial, com evidente redução da espessura dos hemisférios cerebrais, a que se associa ruptura da porção anterior do septum pellucidum (seta), traduzindo assim processo de hidrocefalia. Idade gestacional/IG: 19 semanas
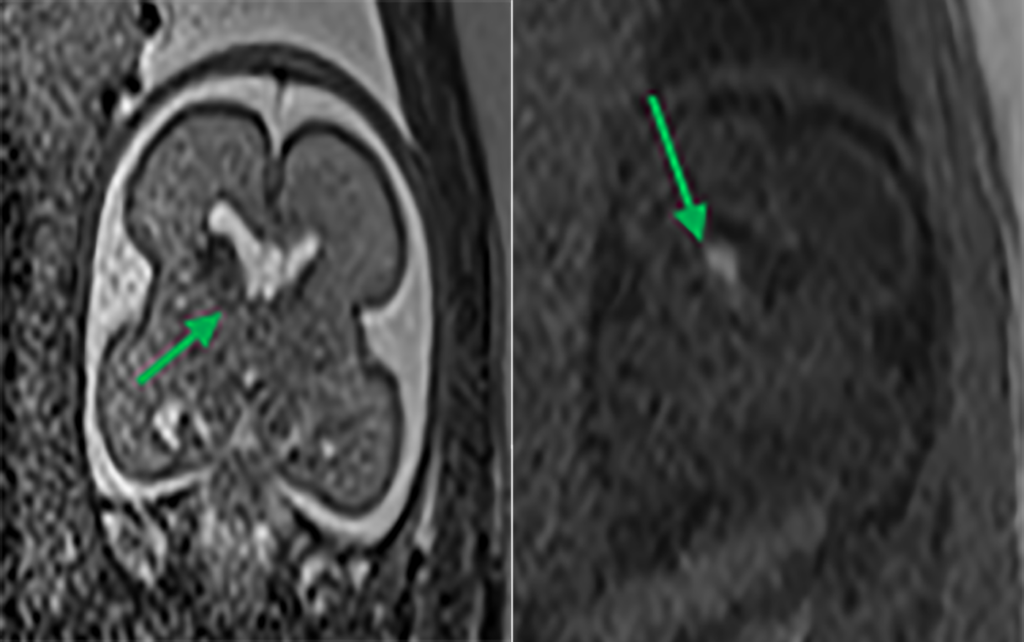
FIGURA 3. Imagens T2 e T1 demonstrando hemorragia da matriz germinal direita, grau I. IG: 24 semanas
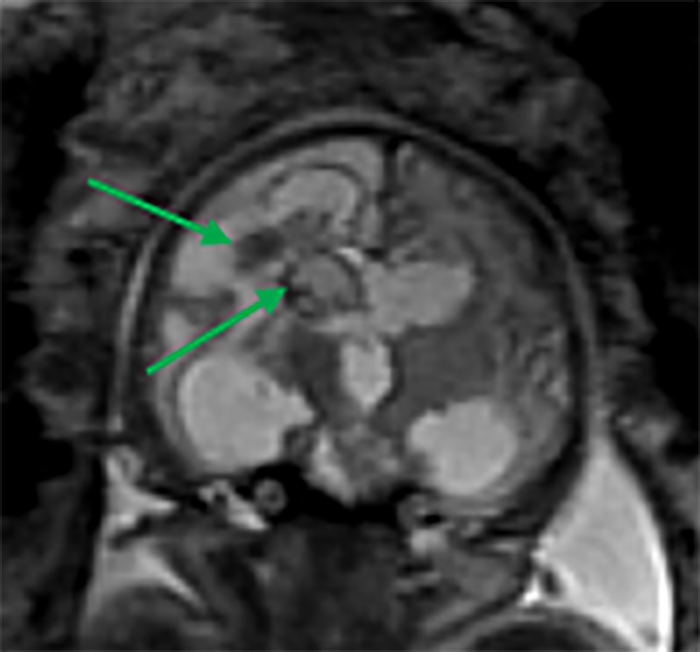
FIGURA 4. Enfarte hemorrágico periventricular frontal direito, com extensão intraventricular, edema envolvente e hidrocefalia. IG: 31 semanas
A infecção fetal por citomegalovírus (CMV) (Figura 5) é a infecção congénita mais comum, apresentando um espectro alargado de alterações neuropatológicas, dependendo do estádio de desenvolvimento em que ocorreu a agressão. Assim, a apresentação em RM fetal poderá ser microcefalia, lesão encefaloclástica, ventriculomegália, quistos, calcificações periventriculares ou anomalias do desenvolvimento cortical.
Os tumores congénitos do SNC são extremamente raros, sendo os teratomas os mais frequentes (Figura 6), representando entre 33% a 50% do total. Outros possíveis tumores congénitos incluem os astrocitomas, papilomas do plexo coroideu, meduloblastomas, tumores embrionários anteriormente designados por tumores neuroectodérmicos primitivos, entre outros, ainda mais raros. A RM fetal é particularmente útil na sua detecção e caracterização.
Os quistos aracnoideus (Figura 7) são colecções de líquido cefalorraquidiano que se desenvolvem entre os folhetos aracnóides, e que normalmente não têm significado patológico. No entanto, quando volumosos e presentes durante o desenvolvimento do SNC, podem ter impacte na formação das normais estruturas anatómicas.
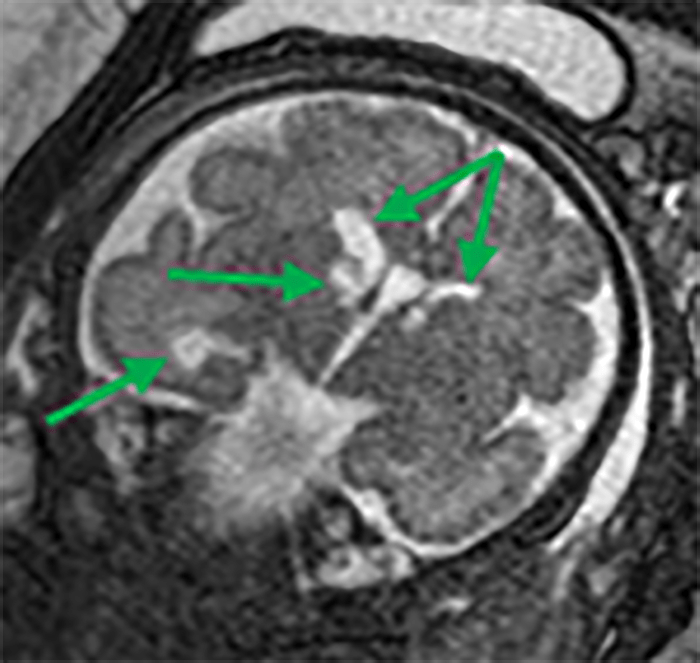
FIGURA 5. Assimetria ventricular, quistos subependimários, dismorfia e dilatação do corno temporal direito, admitindo-se alterações da substância branca e eventual alteração cortical frontal direita. Aspectos sugestivos de infecção congénita por CMV. IG: 32 semanas
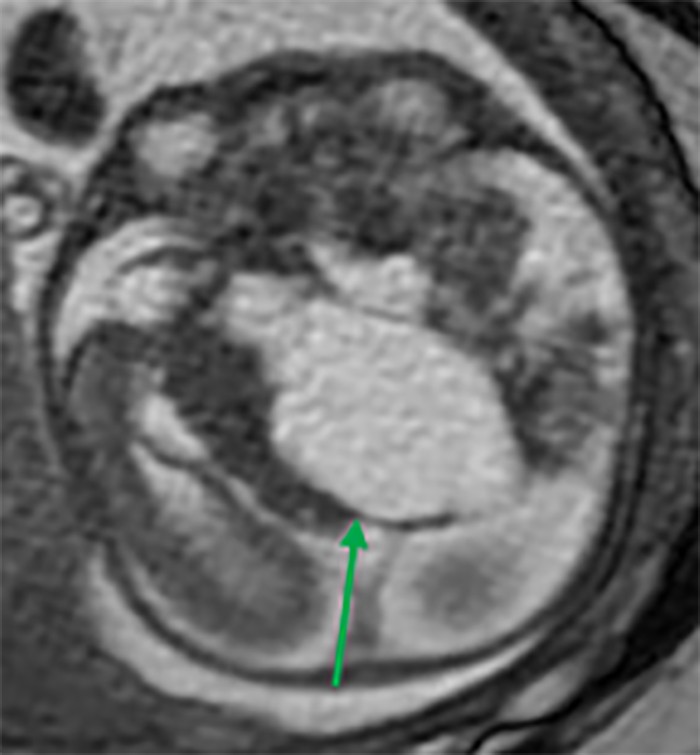
FIGURA 6. Volumosa lesão intracraniana ocupando espaço, aparentemente extra-axial, heterogénea, maioritariamente quística e com componentes sólidos periféricos, determinando significativo efeito de massa. A suspeita de teratoma confirmou-se histologicamente. IG: 21 semanas
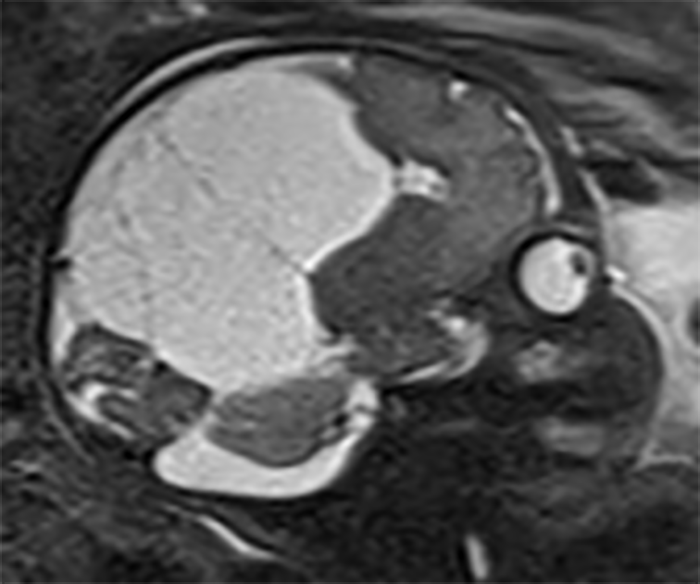
FIGURA 7. Volumoso quisto inter-hemisférico direito, septado, com características de sinal idênticas ao restante LCR. IG: 35 semanas
Disgenésias do corpo caloso
A agenésia do corpo caloso (Figura 8), frequentemente encontrada na população geral, com uma prevalência de 0,02% a 0,5%, tem um impacte muito variável no neurodesenvolvimento; por isso, torna-se difícil estabelecer o prognóstico. Contudo, estando esta anomalia frequentemente associada a outros defeitos tais como anomalia de Dandy-Walker ou disrafismos, anomalias cromossómicas e síndromas genéticas, a sua identificação poderá ser importante na marcha diagnóstica.
A hipogenésia do corpo caloso pode resultar de um desenvolvimento incompleto ou de um processo destrutivo ulterior à sua formação. Estudos retrospectivos demonstraram que 43% dos casos de agenésia do corpo caloso diagnosticados por RM fetal não tinham sido detectados por ultrassonografia.
Patologia malformativa da fossa posterior
Este termo engloba um vasto leque de defeitos congénitos, sendo os mais frequentes aqueles que se definem como um espaço aumentado de líquido cefalorraquidiano na fossa posterior, sem ou com patologia cerebelosa. Entre estas, destacam-se: – no primeiro grupo as mais comuns, mega cisterna magna (Figura 9) e quisto da bolsa de Blake, habitualmente sem significado patológico; e – no segundo grupo, a hipoplasia vermiana inferior e a anomalia de Dandy-Walker (Figura 10). Ao contrário desta última, os casos de hipoplasia vermiana inferior isolada apresentam prognóstico muito variável, sendo impossível prever as manifestações clínicas durante o desenvolvimento fetal.
Através da descrição anatómica pormenorizada dos achados imagiológicos fetais é possível identificar, quer situações que virão a ser raramente sintomáticas, quer outras com prognóstico muito reservado, associado a compromisso neuropsíquico. As anomalias cerebelosas mais graves são frequentemente parte constituinte de síndromas complexas, associadas a patologia cerebral e extracerebral.
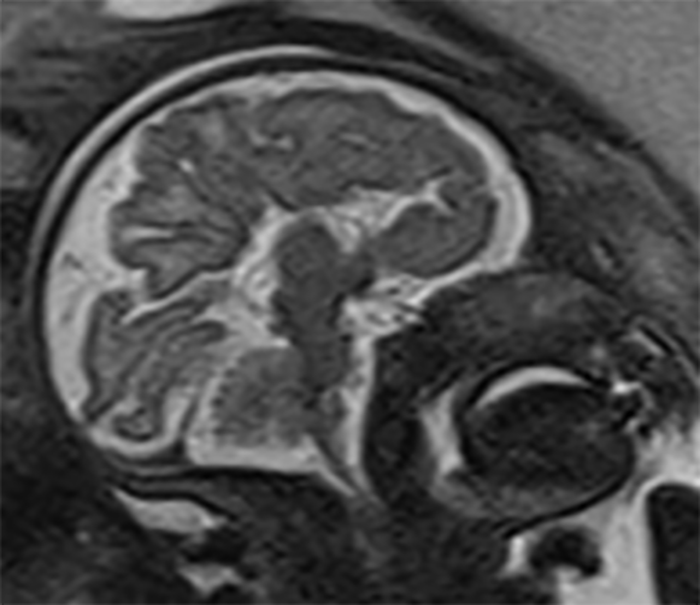
FIGURA 8. Agenésia completa do corpo caloso. IG: 33 semanas
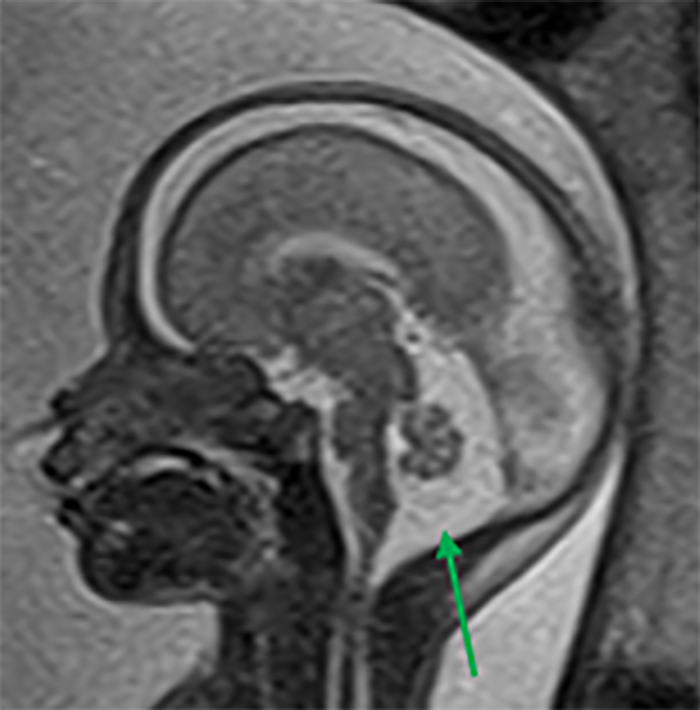
FIGURA 9. Mega cisterna magna. Vérmis e 4º ventrículo normais. IG: 23 semanas
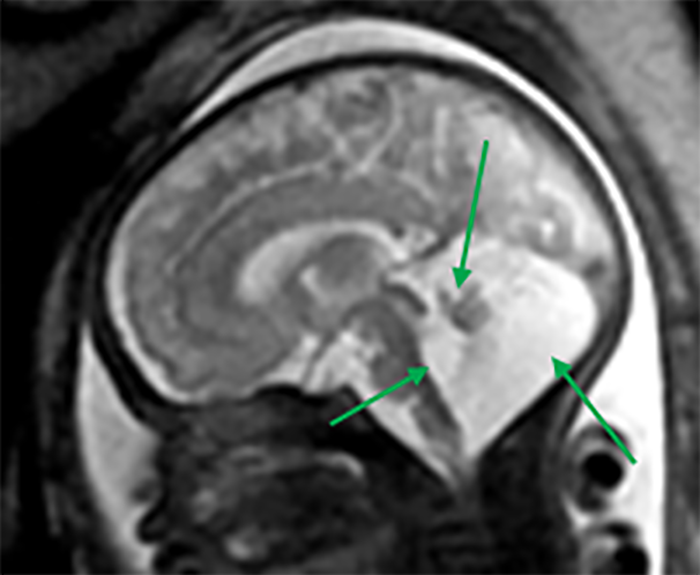
FIGURA 10. Anomalia de Dandy-Walker. Hipoplasia acentuada do vérmis, com dilatação de aspecto quístico do 4º ventrículo e alargamento da fossa posterior. IG: 34 semanas
Distúrbios do desenvolvimento cortical
Frequentemente indetectáveis por ultrassonografia, uma grande parte das anomalias do desenvolvimento cortical (proliferativas, migratórias ou pós-migratórias) podem ser diagnosticadas por RM fetal, nomeadamente microcefalia (Figura 11), lisencefalia, polimicrogiria, heterotopia ou esquizencefalia. Esta informação é particularmente útil no âmbito do aconselhamento genético para gravidezes futuras, pois a maioria dos distúrbios do desenvolvimento cortical têm uma origem genética.
Apesar de se tratar de alterações frequentemente subtis, esta técnica evidencia sensibilidade e especificidade elevadas no DPN de polimicrogiria e esquizencefalia; contudo, no que se refere a heterotopia (Figura 12), a identificação frequentemente não é viável antes do terceiro trimestre de gestação.
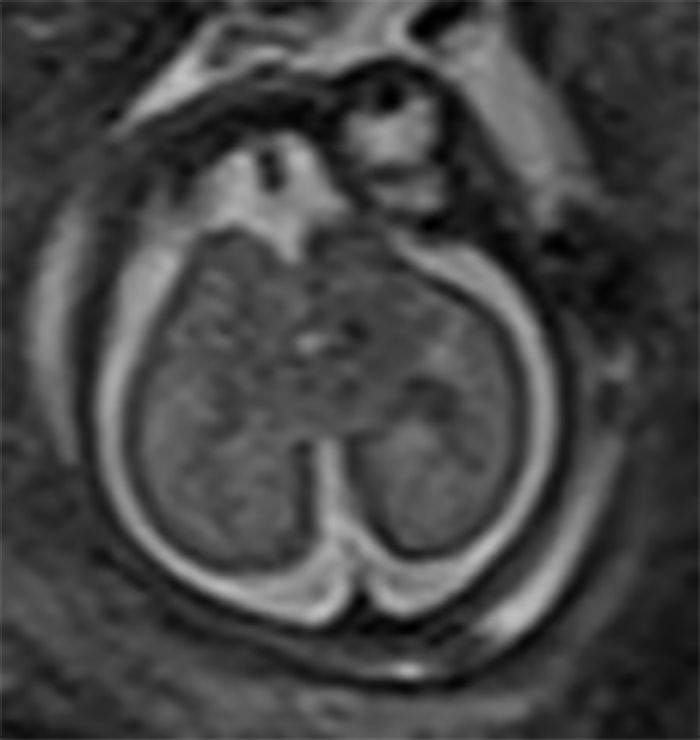
FIGURA 11. Microcefalia com concomitante atraso no padrão de sulcação e giração. IG: 23 semanas
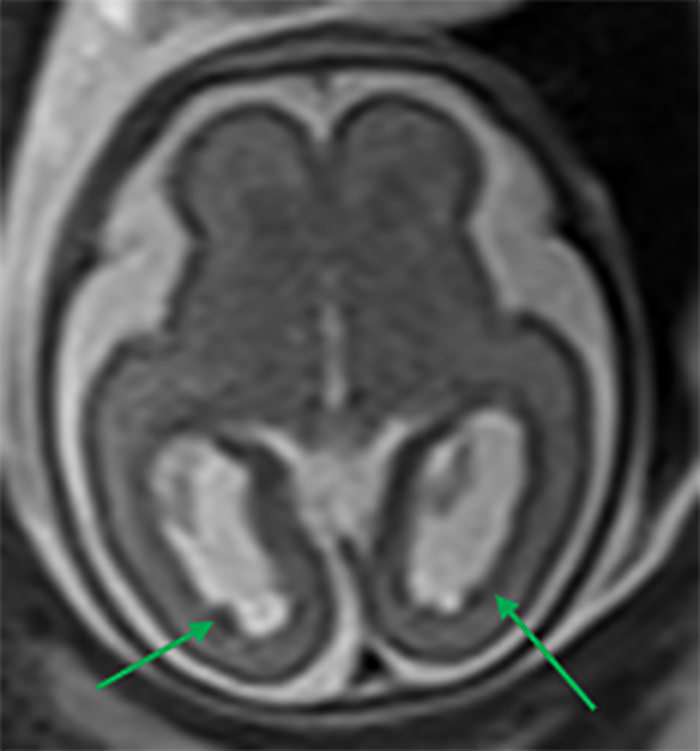
FIGURA 12. Heterotopias subependimárias ao longo do contorno ependimário dos cornos occipitais e átrios. IG: 23 semanas
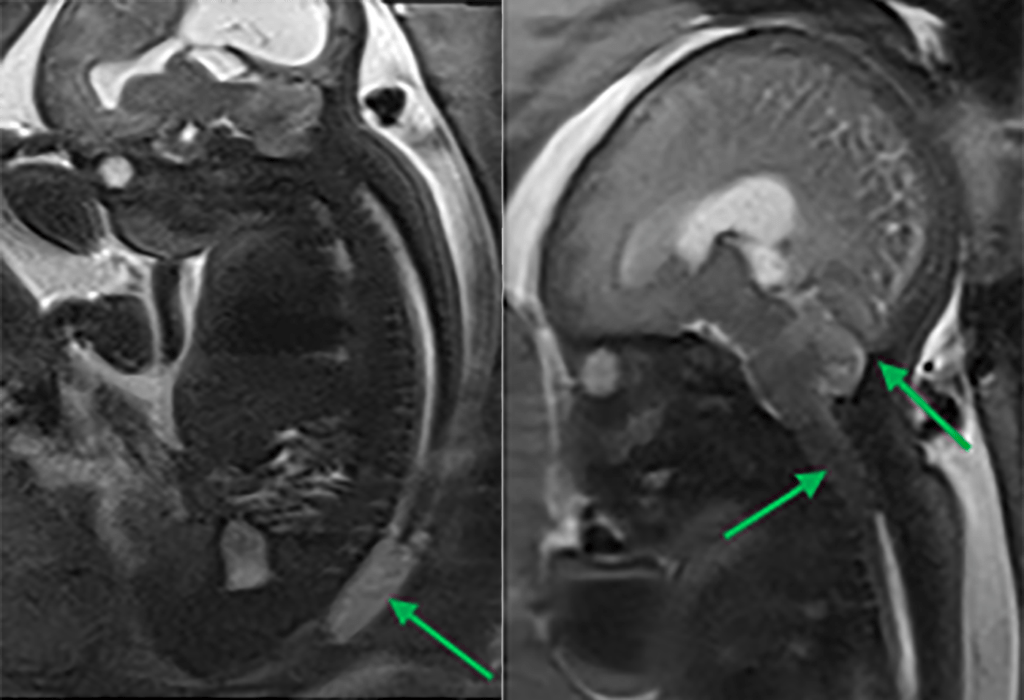
FIGURA 13. Malformação de Chiari tipo 2 associada a mielomeningocele, com representação dos aspectos típicos: fossa posterior pequena, implantação baixa da tenda do cerebelo e da torcula de Herófilo (confluência dos seios), herniação do tronco cerebral e amígdalas cerebelosas com apagamento dos espaços de LCR, e disrafismo lombar. IG: 33 semanas
Anomalias do desenvolvimento do tubo neural dorsal
Sobre as anomalias congénitas associadas ao desenvolvimento do tubo neural dorsal, abordadas em capítulo próprio, é importante referir que a RM fetal evidencia elevada sensibilidade para o seu diagnóstico, nomeadamente no que se refere à malformação de Chiari Tipo 2 associada a mielomeningocele (Figura 13); tal sensibilidade, contudo, não é tão elevada nos casos de disrafismos fechados discretos.
AGRADECIMENTOS
Os autores agradecem muito reconhecidamente à Dra. Eulália Calado a revisão do manuscrito e as sugestões apresentadas.
GLOSSÁRIO
Espectroscopia > Avaliação semiquantitativa de metabólitos (por exemplo, colina, N-acetilaspartato, lactato, lípidos, creatina, etc.) por RM de determinado volume parenquimatoso seleccionado.
Matriz germinal > Região adjacente aos ventrículos laterais do cérebro fetal onde existe proliferação neuronal com ulterior migração neuronal. Devido à sua elevada taxa metabólica, a matriz germinal é particularmente a hemorragia.
Opercularização > Formação do opérculo que ocorre com o normal desenvolvimento dos lobos frontal, parietal e temporal, que acabam por cobrir o lobo da ínsula, com a consequente formação da fissura sílvica.
RM funcional > Técnica RM que pretende discriminar áreas de maior actividade neuronal, baseando-se no fluxo sanguíneo.
Sulcação e giração > Normal desenvolvimento encefálico resulta no aumento da superfície cortical, resultando na formação dos sulcos corticais e giros/circunvoluções.
Tractografia > Imagens 3D que pretendem representar as vias neuronais, baseando-se na maior difusibilidade das moléculas de água ao longo dos axónios.
T1 e T2 > Ponderações básicas de RM obtidas a partir dos “tempos de relaxamento” nuclear, que diferem consoante o tipo de tecido ou alterações patológicas. O sinal obtido traduz-se numa escala de cinzento, revelando características consideradas normais ou patológicas.
BIBLIOGRAFIA
Atlas SW. Magnetic Resonance Imaging of the Brain and Spine. Philadelphia: Wolters Kluwer, 2017
Blondiaux E, Garel C. Fetal cerebral imaging-ultrasound vs. MRI: an update. Acta Radiol 2013; 54:1046-1054
Garcia-Flores J, Recio M, Uriel M, et al. Fetal magnetic resonance imaging and neurosonography in congenital neurological anomalies: supplementary diagnostic and postnatal prognostic value. J Matern Fetal Neonatal Med 2013; 26: 1517-1523
Girard N, Raybaud C, Gambarelli D, et al. Fetal brain MR imaging. Magn Reson Imaging Clin North Am 2001; 9: 19-56
Glenn OA, Cuneo AA, Barkovich AJ, et al. Malformations of cortical development: diagnostic accuracy of fetal MR imaging. Radiology 2012; 263: 843-855
Goldman L, Schafer AI (eds). Goldman-Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Griffiths PD, Bradburn M, Campbell MJ, et al, on behalf of the MERIDIAN collaborative group. Lancet 2017; 389: 538-46
Hubbard AM, Simon EM. Fetal imaging. Magn Reson Imaging Clin North Am 2002;10: 389-408
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Prayer D. Fetal MRI. Berlin-Heidelberg: Springer, 2011
Roach ES (ed). Pediatric Neurology. Philadelphia: Elsevier, 2019
Shekdar K, Feygin T. Fetal neuroimaging. Neuroimag Clin North Am 2011; 21: 677-703
Trop I, Levine D. Hemorrhage during pregnancy: sonography and MR imaging. Am J Roentgenol 2001;176: 607-615