Definição e importância do problema
A dermatite atópica (DA) é uma doença inflamatória crónica, recorrente, com grande variabilidade clínica, muito pruriginosa, de expressão cutânea, muito frequente na infância.
A sua prevalência tem vindo a aumentar nos últimos anos, sobretudo nos países mais desenvolvidos, estimando-se actualmente que atinja cerca de 24% em crianças com menos de 5 anos e cerca de 3,5% dos adultos, na população europeia. Este aumento de prevalência tem sido atribuído a vários factores, como a poluição, maior exposição a ácaros, aditivos alimentares, diminuição da prevalência do aleitamento materno e maior acuidade diagnóstica.
Etiopatogénese
A etiopatogénese depende de interacções complexas entre factores genéticos e factores ambientais, de natureza química, física ou microbiológica. Fundamentalmente baseia-se em três pilares: 1- predisposição genética; 2 – disfunção da barreira cutânea facilitando a entrada de alergénios, irritantes e microrganismos; e 3 – inflamação persistente da derme, com infiltrado inflamatório de tipo Th 2 inicialmente, e Th1 na forma tardia.
Existe uma associação entre a DA e outras doenças, como asma e rinite alérgica; os mecanismos patogénicos envolvidos nestas patologias são em larga medida semelhantes, sendo frequente a agregação familiar.
A importância da genética na DA está demonstrada em vários estudos, nomeadamente comparando a incidência em gémeos monozigóticos com a que se verifica em gémeos dizigóticos e outros irmãos. Foram descritas alterações genéticas em vários cromossomas (3q21, 1q21, 17q25 e 20p), com efeitos na inflamação e imunidade cutâneas condicionando designadamente, aumento da produção de IgE.
Abordando o problema da disfunção da barreira cutânea torna-se obrigatório mencionar a filagrina, que é uma proteína intracelular que se gera durante o processo de cornificação, e cujos polipéptidos contribuem para a agregação dos filamentos de queratina. Assim, a filagrina é essencial para manter uma barreira cutânea intacta e uma correcta hidratação da epiderme. Será fácil compreender que mutações no gene da filagrina predispõem a défice funcional da barreira com efeitos diversos, entre eles, aumento da perda de água transepidérmica, aumento do pH cutâneo e a maior predisposição para DA. Diversos estudos demonstraram que a pele dos pacientes com DA evidencia uma expressão diminuída da filagrina e aumento do risco de sensibilizações alérgicas e asma.
Outro aspecto da disfunção da barreira da pele relaciona-se com alterações na composição lipídica do cimento intercelular explicáveis por défice de certos ácidos gordos essenciais e de ceramidas cuja aplicação induz melhoria clínica.
Comparando a pele de indivíduos saudáveis com a de indivíduos com lesões agudas e crónicas de DA, notam-se as seguintes diferenças de padrão inflamatório:
- na pele não lesada de indivíduos atópicos e, sobretudo, nas lesões de DA aguda, verifica-se aumento de células expressando IL-4 e IL-13;
- na DA aguda não se verifica número significativo de células que expressam IFN-gama ou IL-12;
- nas lesões crónicas de DA evidencia-se menor número de células que expressam IL-4 e IL-13, mas aumento do número de células que expressam IL-5, GM-CSF, IL-12 e IFN-gama em comparação com a DA aguda, traduzindo um shift TH1.
Ainda no que respeita ao padrão inflamatório importa salientar que nos pacientes com DA se verificam os seguintes factos: – colonização constante por Staphylococcus aureus, para além doutros agentes, o que facilita a instalação de quadros de impetigo; – colonização que tem um papel relevante na manutenção de processos inflamatórios crónicos através da estimulação directa de linfócitos T pelos superantigénios que as bactérias colonizadoras produzem; – interferência de certas proteínas estafilocócicas na síntese de IgE, IL-4 e IFN-gama, podendo induzir a libertação de histamina e de leucotrienos.
Investigações recentes chamaram a atenção para o papel de péptidos antimicrobianos chamados catelicidinas (LL-37) e beta-defensinas (HBD-2) que existem na pele humana normal e cuja expressão está aumentada em doenças inflamatórias como a psoríase. A combinação de LL-37 e HBD-2 tem efeito sinérgico bactericida contra S. aureus. Nos pacientes com DA verificou-se que o teor dos referidos péptidos na pele é baixo, quer em lesões agudas quer em lesões crónicas. Estes dados poderão explicar a já referida frequente colonização da pele por tal microrganismo. (ver Parte Imunoalergologia)
Manifestações clínicas
A DA inicia-se em cerca de 75% dos doentes nos primeiros 6 meses de vida e em cerca de 90% nos primeiros cinco anos; é raro o início da doença após a idade pediátrica. Pode haver remissão espontânea em 60% dos casos com evolução recorrente nos restantes. Evolui com episódios de agudização caracterizados por prurido intenso. As localizações características variam com a idade.
A DA caracteriza-se, nas fases de agudização, pelo aparecimento de pápulas ou placas eritematodescamativas, muito pruriginosas, por vezes com edema e exsudação. À medida que evoluem para a cronicidade, as placas tornam-se mais espessas e liquenificadas, secas, de coloração eritematosa – acastanhada, com acentuação do reticulado normal da pele. Em todas as fases o prurido é um sintoma constante e assume importância pela sua intensidade, levando a coceira incoercível e perturbações do sono e da qualidade de vida.
Nas crianças até aos 2 anos de idade as lesões localizam-se sobretudo na face, na região retroauricular – onde podem produzir fissuração – e nas superfícies de extensão dos membros superiores e inferiores. Podem, porém, generalizar-se e atingir grande parte da superfície corporal.
À medida que a criança cresce, as lesões passam a estar localizadas sobretudo nas pregas de flexão dos membros, continuando a ser comum o envolvimento facial, cervical e retroauricular (Figura 1), evidenciando carácter acentuadamente exsudativo nas pálpebras, bochechas, preservando o maciço centrofacial.
De referir, por comparação, que nos adultos é também este o padrão habitual, sendo frequente o eczema palpebral, muitas vezes persistente e criando dificuldades terapêuticas.
Há várias alterações cutâneas características da DA que podem ser observadas mesmo nos períodos de remissão da doença, nomeadamente a xerose generalizada, a prega ou linha de Denni-Morgan (prega transversal nas pálpebras inferiores), a pitiríase alba (manchas hipopigmentadas residuais), a queratose pilar (micropápulas foliculares nas superfícies de extensão proximais dos membros, ásperas), o dermografismo branco, a queilite (cieiro) e a dermatose plantar juvenil.
No chamado eczema numular existem placas circulares de diversas dimensões, pruriginosas e exsudativas, por vezes com crostas. O aspecto morfológico poderá suscitar o diagnóstico diferencial com toxidermias, dermatofitias e pitiríase rosada ou doença de Gibert.
Verifica-se maior susceptibilidade a irritantes, como água, produtos de limpeza comuns, detergentes, químicos, e a alergénios de contacto. Outro aspecto importante na prática clínica é a maior susceptibilidade dos doentes com DA às infecções, traduzindo-se num maior risco de quadros infecciosos graves, bacterianos ou víricos, por exemplo a disseminação de infecção pelos vírus Herpes simplex de que resulta o chamado eczema herpeticum. (Figuras 2 e 3)
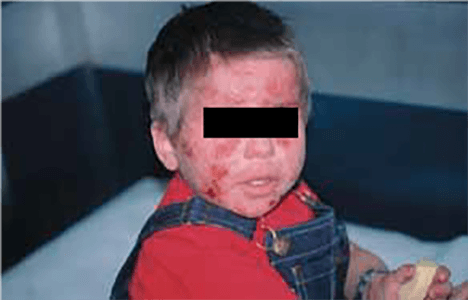
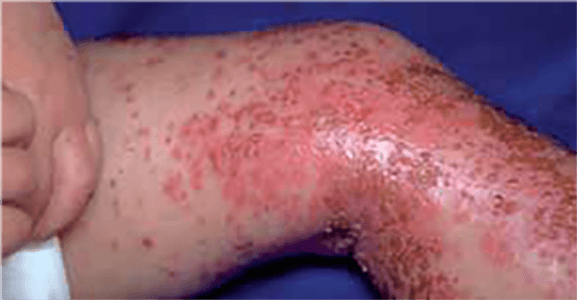
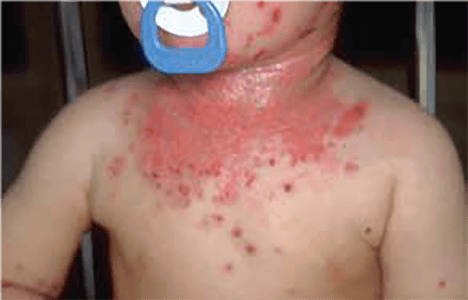
FIGURA 1. Eczema atópico grave afectando a face
FIGURAS 2 e 3. Eczema herpeticum (NIHDE)
Hidratação cutânea
Emolientes – Uma formulação emoliente adequada com efeito de poupança de esteróides deverá conter ácidos gordos essenciais, óleos, substâncias calmantes, suavizantes e antipruriginosas, na forma de emulsão O/A (consultar Glossário geral) . Deve ser de fácil aplicação, com textura agradável e não ser excessivamente gorda para que não constitua um factor de rejeição a uma aplicação diária por períodos prolongados, embora suficientemente gorda para impedir a evaporação. Devem ser utilizados diariamente, quer na prevenção/manutenção, quer nas fases de agravamento da doença.
Em períodos de maior exacerbação pode reforçar-se o efeito emoliente com banhos rápidos de imersão (10 minutos), a temperaturas tépidas, seguidos da aplicação imediata de emolientes. Nas áreas de xerose (pele anormalmente seca), a hidratação deverá ser efectuada ao longo do dia de forma repetida.
Terapêutica farmacológica
Corticosteróides – Em formulações tópicas (preferencialmente cremes), constituem a terapêutica efectiva de primeira linha. O tipo de fármaco varia consoante a apresentação clínica, a localização das lesões e o período previsível de utilização, verificando-se maior absorção em áreas de oclusão e nas pregas.
A corticoterapia tópica não deverá ser prescrita em períodos prolongados, pelo risco de efeitos secundários. Os cremes e loções deverão ser reservados para lesões agudas e as pomadas para lesões de maior cronicidade. A hidrocortisona a 1%, de menor potência, é o corticosteróide tópico de primeira escolha para a face. No restante tegumento deverão ser preferidos corticosteróides de maior potência, com reduzidos efeitos sistémicos (metil-prednisolona a 0.1%; fluticasona a 0.05%). Estes fármacos deverão ser aplicados idealmente após o banho, à noite.
A prescrição de corticóides sistémicos deverá reservar-se a ciclos muito curtos para permitir a redução da intensidade das lesões e facilitar a instituição de formas terapêuticas menos agressivas; a prednisolona (até 1mg/Kg/dia, em períodos geralmente inferiores a 1 semana) é de elevada eficácia, devendo proceder-se a uma diminuição progressiva da dose para obviar recorrências.
Antibióticos – A antibioticoterapia é frequentemente necessária na terapêutica da DA. Utiliza-se habitualmente ácido fusídico tópico ou mupirocina nas situações de impetiginização ligeira das lesões de eczema, sendo de evitar a aplicação tópica de produtos contendo penicilina ou sulfamidas, devido ao risco de sensibilização. Nos quadros de impétigo manifesto dever-se-á optar por antibiótico sistémico cujo espectro inclua S. aureus. Com efeito, a infecção cutânea é comum, particularmente com o referido agente. As combinações de corticóides e antimicrobianos para uso tópico devem ser reservadas às formas de DA infectada, circunscrita. A terapêutica anti-infecciosa sistémica é de extrema importância nas formas infectadas graves; a flucloxacilina, os macrólidos e as cefalosporinas são os antibióticos sistémicos de eleição.
Anti-histamínicos – Os anti-histamínicos sistémicos (hidroxizina, loratadina, cetirizina) são úteis para reduzir o purido, considerando-se neste contexto preferíveis as moléculas da 1ª geração, com efeitos sedativos. Não devem ser utilizados anti-histamínicos tópicos.
Inibidores tópicos da calcineurina – Actualmente dispomos de uma excelente alternativa à corticoterapia tópica: os chamados imunomoduladores tópicos – tacrolimus e pimecrolimus. Trata-se de macrólidos imunossupressores que se ligam a um receptor intracelular (imunofilina) formando um complexo que inibe a calcineurina e, em consequência, a transcrição nuclear do gene de IL2 e de vários mediadores inflamatórios, tais como interleucinas, TNF-alfa, IFN-gama, etc.. A sua actividade imunossupressora é complexa, sendo capazes nomeadamente de inibir a desgranulação de mastócitos, diminuir a expressão de receptores para interleucinas (IL-8) e de diminuir a expressão de moléculas de adesão.
De acordo com os dados disponíveis a sua aplicação tópica é bastante segura, sendo a absorção sistémica quase nula. O efeito secundário mais frequente é uma sensação transitória de ardor ou picada no local de aplicação, que não impede habitualmente a continuação do tratamento, e se desvanece à medida que este prossegue, acompanhando a melhoria cutânea. Ao contrário dos corticosteróides tópicos, os imunomoduladores tópicos não provocam atrofia da pele e não induzem taquifilaxia.
Estas novas terapêuticas têm sido muito úteis, rapidamente alcançando o estatuto de fármacos de primeira linha, quer como terapêutica de manutenção, quer como alternativa aos corticosteróides nas fases subagudas, sobretudo em áreas de maior susceptibilidade aos efeitos secundários destes.
O tacrolimus é uma pomada comercializada em duas concentrações: 0,03% e 0,1%. Está comprovada a sua eficácia e segurança em adultos e em crianças.
O pimecrolimus, na forma de creme a 1%, tem maior especificidade cutânea e melhor tolerância, havendo estudos que comprovam a sua segurança em bebés a partir dos 3 meses de idade. Tem uma afinidade para a calcineurina, cerca de 3 vezes inferior à do tacrolimus.
Imunossupressores – A ciclosporina A é uma boa alternativa que tem sido usada com sucesso e com bom perfil de segurança. Com doses iguais ou inferiores a 5mg/kg/dia obtêm-se habitualmente remissões rápidas. As taxas de recorrência são altas (cerca de 75% às 6 semanas).
Também o metotrexato, o micofenolato de mofetil e a azatioprina são imunossupressores eficazes que podem ser úteis no controlo de situações refractárias, embora o seu uso seja limitado pela potencial toxicidade.
Outros fármacos – Os inibidores dos leucotrienos foram tentados como terapêutica adjuvante mas não revelaram grande eficácia.
Os estudos com interferão gama e alfa tiveram resultados clínicos muito variáveis, globalmente pouco animadores e com efeitos secundários sistémicos importantes.
Com omalizumab tem-se conseguido resultados globalmente satisfatórios mas irregulares.
Estudos recentes avaliando o possível papel dos probióticos e simbióticos na prevenção e ou tratamento complementar nos casos de DA, concluíram que os mesmos têm efeito na prevenção da sensibilização a alergénios alimentares comuns, reduzindo a incidência de DA na primeira infância.
Fototerapia e vitamina D
A fototerapia com radiação ultra-violeta B (UVB) e a fotoquimioterapia com radiação ultra-violeta A, após fotossensibilização com psoralenos (PUVA), são também opções terapêuticas de segunda linha, muito úteis e eficazes em doentes com idade e capacidade para colaborar.
Estudos recentes demonstraram que níveis mais elevados do metabólito 25 (OH) vitamina D se correlacionam com melhoria clínica, e níveis traduzindo deficiência do metabólito, com agravamento.
Em suma, salienta-se que a DA é uma doença com evolução crónica e início precoce, que afecta muito gravemente a qualidade de vida, de forma considerada equivalente à da diabetes insulino – dependente.
Todas as atitudes terapêuticas devem ser cuidadosamente avaliadas no sentido de evitar os efeitos acessórios que a sua aplicação crónica ou prolongada pode acarretar.
São referidas a seguir algumas regras gerais importantes a seguir, nos cuidados com a pele em idade pediátrica, e aplicáveis em diversas situações anteriormente descritas.
- O banho deve ser diário, muito rápido (5 a 10 minutos), sempre com água tépida e utilizando produtos de limpeza adequados: sabões supergordos, syndets (sólidos ou líquidos), óleos de banho dispersíveis ou ainda banhos coloidais (que utilizam cereais que removem por adsorsão os detritos lipo e hidrofílicos e deixam uma camada superficial protectora).
- O produto ideal para o banho deverá respeitar o pH cutâneo, a camada lipídica superficial e o ecossistema da pele.
- Os emolientes devem ser usados preferencialmente após o banho, com a pele ainda húmida.
*Syndets: detergentes sintéticos ou “sabão sem sabão”, com pH neutro ou ligeiramente ácido, bom efeito detergente, fazendo pouca espuma. Também chamados “Pains”, podem apresentar-se em formas sólidas ou líquidas. |
BIBLIOGRAFIA
Allen SJ, Jordan S, Storey M, et al. Probiotics in the prevention of eczema: a randomised controlled trial. Arch Dis Child 2014; 99: 1014 -1019
American Academy of Dermatology Task Force. Guidelines of care for the management of atopic dermatitis: section 1. Diagnosis and assessment of atopic dermatitis. J Am Acad Dermatol 2014; 70: 338-351
Berke R, Singh A, Guralnick M. Atopic dermatitis: an overview. Am Fam Physician 2012; 86: 35 – 42
Bieber T. Atopic dermatitis. Ann Dermatol 2010; 22: 125 – 137
Brown S, Reynolds NJ. Atopic and non-atopic eczema. BMJ 2006; 332: 584-588
Eichenfield LF, Ellis CN, Mancini AJ, et al. Atopic dermatitis: epidemiology and pathogenesis update. Semin Cut Med Surg 2012; 31: 3 – 5
Elazab N, Mendy A, Gasana J, et al. Probiotic administration in early life, atopy and asthma: a meta-analysis of clinical trials. Pediatrics 2013; 132: e666-e676
Gehring U, Bolte G, Borte M, et al. Exposure to endotoxin decreases the risk of atopic eczema in infancy: a cohort study. J Allergy Clin Immunol 2001; 108:847-853
Guerra-Rodrigo F, Gomes MAM, et al. Dermatologia. Lisboa: Fundação Calouste Gulbenkian, 2010
Habif TP. Clinical Dermatology. Philadelphia: Elsevier, 2015
Hanifin et al. Guidelines of care for atopic dermatitis. J Am Acad 2004; 50: 391-404
Ibáñez MD, del Río PR, Alsina D G-S, et al. Effect of synbiotic supplementation on children with atopic dermatitis: an observational prospective study. Eur J Pediatr 2018; 177:1851–1858
Kliegman RM, Stanton BF, StGeme JW, Schor NF (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2015
LePoidevin LM, Lee DE, Shi VY. A comparison of international management guidelines for atopic dermatitis. Pediatr Dermatol 2019; 36: 36-65
Leung DY, Bieber T. Atopic dermatitis. Lancet 2003; 361: 151 – 160
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Mutgi K, Koo J. Update on the role of systemic vitamin D in atopic dermatitis. Pediatric Dermatology 2013; 30: 303- 307
Paller AS, Mancini AJ (eds). Hurwitz Clinical Pediatric Dermatology. Philadelphia: Elsevier, 2016
Pelucchi C, Chatenaud L, Turati F, et al. Probiotics supplementation during pregnanacy or infancy for the prevention of atopic dermatitis: a meta-analysis. Epidemiology 2012; 23: 402-414. doi: 10.1097/EDE.0b013e31824d5da2.
Sawni A, Singh A. Complementary, holistic, and integrative medicine: acne. Pediatr Rev 2013; 34:91-92
Shekariah T, Kalavala M, Alfaham M. Atopic dermatitis: a practical approach. Paediatr Child Health 2011; 21:112-118
Siegfried EC, Igelman S, Jaworsk JC, et al. Use of dupilimab in pediatric atopic dermatitis: Access, dosing, and implications for managing severe atopic dermatitis. Pediatr Dermatol 2019; 36: 172-176
Simon D, Lang KK. Atopic dermatitis: from new pathogenic insights toward a barrier-restoring and anti-inflammatory therapy. Curr Opin Pediatr 2011; 23: 647-652
Simon D, Lang KK. Atopic dermatitis: from new pathogenic insights toward a barrier-restoring and anti-inflamatory therapy. Curr Opin Pediatr 2011; 23: 647-652
von Kobyletzki LB, Bornehag C-G, Hasselgren M, Eczema in early childhood is strongly associated with development of asthma and rhinitis in a prospective cohort. BMC Dermatology 2012; 12:11
Waldman AR, Ahluwalia J, Udkoff J, et al. Atopic dermatitis Pediatr Rev 2018; 39: 180-193; DOI: 10.1542/pir.2016-0169
Weston WL, Lane AT, Morelli JG. Color Textbook of Pediatric Dermatology. Philadelphia: Mosby Elsevier, 2007
Wolf R, Wolf D. Abnormal epidermal barrier in the pathogenesis of atopic dermatitis. Clin Dermatol 2012; 30: 329-334
Yang EJ, Beck KM, Sekhon S, et al. The impact of pediatric atopic dermatitis on families: A review. Pediatr Dermatol 2019; 36: 66-71