Introdução
O número de cromossomas e a sua morfologia são característicos de cada espécie, podendo variar desde um cromossoma único, como ocorre em vírus e bactérias, até centenas nalgumas plantas ou animais. O estudo das características dos cromossomas e das suas anomalias constitui o objectivo da citogenética.
Recorda-se que a espécie humana tem um número diplóide de cromossomas constituído por 46 cromossomas agrupados em 23 pares. Os cromossomas dividem-se em autossomas (22 pares de cromossomas homólogos numerados de 1 a 22 por ordem decrescente de comprimento – conquanto o 22 seja maior do que o 21 – ) e heterocromossomas ou cromossomas sexuais, 1 par (cromossomas X e Y : XX no sexo feminino, e XY no sexo masculino). Os cromossomas X e Y são bastante diferentes no que respeita à sua extensão e aos genes que possuem. Na sequência do que foi referido em anterior capítulo, a indicação do número de cromossomas, dos cromossomas sexuais, é designada por cariótipo. O número total de cromossomas seguido de vírgula é a primeira indicação do cariótipo. O complemento cromossómico sexual é indicado de seguida. Exemplificando com situação de normalidade: 46, XY – no sexo masculino; 46, XX – no sexo feminino.
Uma constrição do cromossoma constituída por cromatina – o centrómero – divide-o em duas porções: o braço longo (designado por q <> queue) e o braço curto (designado por p <> petit). A anteceder a letra que simboliza o braço indica-se o número do cromossoma (por exemplo, 1q para designar o braço longo do cromossoma 1. As extremidades dos cromossomas designam-se telómeros.
De acordo com a posição do centrómero, os cromossomas podem ser classificados do seguinte modo: -metacêntricos quando o centrómero está aproximadamente no meio do cromossoma (cromossomas 1, 3, 16, 19 e 20); -submetacêntricos quando o centrómero se localiza entre o meio do cromossoma e uma das extremidades (cromossomas 2, 4-12, 17, 18 e X); -acrocêntricos se o centrómero se localiza perto da extremidade de modo que um dos braços é muito curto (cromossomas 13-15, 21, 22, e Y). Recorrendo aos parâmetros tamanho, posição do centrómero e presença ou ausência de satélites, é possível distribuir os cromossomas em sete grupos designados pelas primeiras sete letras do alfabeto, de A a G. Uma Comissão Permanente de Nomenclatura em Citogenética actualiza regularmente a terminologia e publica um relatório designado por ISCN/International System for Human Cytogenetic Nomenclature. (ver capítulo sobre Genética: importância do laboratório).
Em 1959 foi demonstrado pela primeira vez uma aplicação médica do estudo dos cromossomas: Jérome Lejeune e colaboradores descobriram a presença de um cromossoma extra nas crianças com síndroma de Down. A partir de então, foram reconhecidas outras síndromas causadas por anomalias cromossómicas.
Actualmente, estima-se que as anomalias cromossómicas sejam responsáveis por cerca de 70% dos abortos espontâneos precoces (antes das 7 semanas de gestação) e por 50 a 60% dos que ocorrem durante o primeiro trimestre da gestação. Estima-se, ainda, que se aproxime de 0,8% (~1/150) o número de recém-nascidos que apresentam uma anomalia desta natureza.
Os indivíduos com anomalia cromossómica têm, em geral, um fenótipo característico e frequentemente apresentam semelhanças com outros com a mesma anomalia; porém têm traços familiares dos seus irmãos e progenitores com quem partilham o material genético.
As características fenotípicas resultam maioritariamente do desequilíbrio genético, ou seja, da sobre ou sub expressão de genes, o que perturba o curso natural do desenvolvimento embrionário. De referir, a propósito, que a perda de material genético origina, geralmente, efeitos mais graves no desenvolvimento do afectado do que o ganho de material genético.
Em todas as cromossomopatias caracterizadas por desequilíbrio genético estão presentes dismorfias, anomalias congénitas, atraso do desenvolvimento psicomotor ou défice cognitivo de grau variável.
Nos casos de rearranjos estruturais equilibrados, ou seja, de situações em que a totalidade do material genético está presente e, por conseguinte, não existe sobre ou sub expressão de genes, em regra os cromossomas, embora estruturalmente anómalos, poderão associar-se muitas vezes (nem sempre), a fenótipos normais.
Classificação das anomalias cromossómicas
As anomalias cromossómicas podem ser numéricas ou estruturais e afectar um ou mais cromossomas, sejam autossomas, heterossomas, ou ambos. Uma determinada anomalia pode estar presente em todas as células do indivíduo designando-se anomalia cromossómica constitucional, ou representar apenas uma linha celular, dando origem a casos de mosaicismo (caso designado mosaico).
As anomalias cromossómicas constitucionais devem-se a erros meióticos durante a divisão celular que precede a formação dos gâmetas (erro pré-zigótico). Os casos de mosaicismo originam-se de erros mitóticos numa fase precoce da divisão do zigoto (erro pós-zigótico), e a proporção de células normais e anómalas varia, habitualmente de tecido para tecido. Uma outra entidade, mas de ocorrência muito rara, são os casos em que um indivíduo tem células provenientes de dois zigotos diferentes, o que se designa por quimera.
1. Anomalias numéricas
O total de cromossomas de um gâmeta (n=23) designa-se por haplóide, o dobro do número haplóide por euplóide, ou seja com 46 cromossomas.
Os múltiplos de n superiores a 2n, designam-se poliplóides: um cariótipo com 3n designa-se triplóide e, com 4n, tetraplóide. As triploidias são conhecidas no homem, embora poucos indivíduos com esta anomalia tenham nascido vivos. As tetraploidias foram encontradas apenas em abortos precoces.
A poliploidia ocorre por mecanismos ainda mal esclarecidos.
Uma variação numérica de apenas um cromossoma que afecte apenas um par de cromossomas denomina-se trissomia (2n+1) ou monossomia (2n-1).
Qualquer número de cromossomas num cariótipo que não seja um múltiplo exacto do número haplóide designa-se por aneuplóide. Estas podem ocorrer nos autossomas ou nos heterossomas.
As aneuploidias surgem maioritariamente por erros meióticos pré-zigóticos, concretamente por uma não disjunção cromossómica, na primeira ou na segunda divisão meiótica, dando origem a gâmetas numericamente anómalos e consequentemente, após a fecundação, a zigotos aneuplóides. Estes erros meióticos dão-se maioritariamente durante a meiose materna e estão muitas vezes associados a um aumento da idade materna.
Praticamente todas as trissomias completas e virtualmente todas as monossomias completas de autossomas têm um efeito tão nefasto no desenvolvimento embrionário que terminam em aborto. Numa minoria dos casos, as trissomias de autossomas não são necessariamente letais in utero (cromossomas 13, 18 e 21).
As aneuploidias são, por definição, alterações cromossómicas desequilibradas com sobre ou sub expressão de material genético, pelo que estão sempre associadas a um fenótipo clínico.
De salientar que, numa população, a frequência de anomalias clínicas devidas a alterações estruturais dos cromossomas é menor do que a frequência de anomalias devidas a alterações numéricas.
2. Anomalias estruturais
As anomalias estruturais (deleções, cromossoma em anel, duplicações, isocromossoma, inversões, translocações, inserções) resultam de uma quebra ou quebras num cromossoma e subsequente rearranjo diferente. As quebras cromossómicas podem ocorrer a nível do centrómero ou dos braços do cromossoma.
A identificação das alterações estruturais beneficiou com o recurso a estudos citogenéticos com bandeamento, em particular com o bandeamento de alta resolução.
Os rearranjos podem ser equilibrados e não-equilibrados. Nos equilibrados, não há perda ou ganho de material cromossómico em quantidade e qualidade que se reflicta em consequências patológicas; nos não-equilibrados há uma quantidade de material cromossómico anormal a que se associa, habitualmente, um fenótipo anormal.
Para que ocorra uma alteração estrutural de um cromossoma é necessário que haja pelo menos uma quebra cromossómica. As quebras dos cromossomas podem ocorrer espontaneamente ou resultar da acção de agentes químicos ou físicos, como a radiação imunizante. Normalmente, as quebras cromossómicas são reparadas por enzimas que estabelecem a continuidade do DNA. Contudo, quando a quantidade de quebras é muito grande, por exposição anómala a agressores do genoma (por exemplo as radiações), ou quando o indivíduo tem capacidade deficiente de reparação do DNA, poderá não ocorrer a restituição completa da sequência cromossómica. Nestas condições podem perder-se fragmentos cromossómicos (delecção- ver adiante), ou haver um rearranjo intra- ou intercromossómico.
Em face da relativa baixa resolução das técnicas citogenéticas a este nível, será talvez preferível utilizar o termo “aparentemente equilibrado”, já que muitas vezes, ao nível molecular e com técnicas de maior resolução, se verifica existirem desequilíbrios submicroscópicos. Acresce que indivíduos com rearranjos aparentemente equilibrados de novo associam-se a um maior número de anomalias congénitas e atraso do neurodesenvolvimento por razões que só agora começam a ser modestamente compreendidas, tais como: os efeitos de dosagem resultantes de desequilíbrios de muito pequenas dimensões, efeito de lesão directa devido à disrupção de genes no ponto de quebra, efeito resultante da incongruência da origem parental do segmento cromossómico (imprinting genómico) e efeitos de posição, onde um gene num ambiente cromossómico novo se torne disfuncional.
2.1 A delecção consiste na perda de uma região do cromossoma, o que, tal como foi referido anteriormente, resulta num desequilíbrio genómico muitas vezes patogénico por sub-expressão dos genes presentes na região que sofreu delecção. Como se poderá compreender, uma delecção resulta de um ou mais pontos de quebra cromossómicos, pelo que desses pontos de quebra resultarão dois ou mais fragmentos. O fragmento acêntrico (que não integra o centrómero) será o fragmento que se perderá na divisão celular seguinte. Desta forma, uma delecção pode ser terminal se ocorrer apenas um ponto de quebra, ou intersticial se existirem dois pontos de quebra.
As deleções terminais subteloméricas resultantes de um ponto de quebra junto aos telómeros (região terminal do cromossoma) associam-se a várias síndromas que cursam com défice cognitivo, como por exemplo a síndroma do cri-du-chat caracterizada tipicamente por choro semelhante ao “miar do gato”, para além doutra sintomatologia como atraso grave no neurodesenvolvimento, microcefalia, alterações faciais e cardiopatia. Esta síndroma, caracterizada por uma delecção terminal do braço curto do cromossoma 5 – 46,XY, del (5p), corresponde à primeira anomalia estrutural não equilibrada a ser descrita.
O cromossoma em anel é um rearranjo cromossómico que resulta de uma delecção terminal de ambas as extremidades do cromossoma e posterior união das extremidades, dando ao cromossoma uma conformação citogenética característica, em anel.
2.2 A duplicação consiste na existência de duas cópias de um segmento de um cromossoma. Se a estas duas cópias se adicionar a cópia do outro cromossoma homólogo verifica-se que uma duplicação origina uma trissomia parcial.
O efeito fenotípico da duplicação depende do material cromossómico envolvido no que se refere ao número de genes e ao número de cópias. As duplicações parciais têm consequências menos graves do que as deleções parciais.
Geralmente, a identificação de genes causadores de doença a partir de duplicações é mais difícil do que em casos de deleções, uma vez que as trissomias parciais, tipicamente, apresentam consequências fenotípicas menos evidentes do que as monossomias parciais . Por vezes, duplicações em determinados loci manifestam-se com o fenótipo “oposto” ao observado na delecção da mesma região. De salientar que as duplicações não dão origem a manifestações clínicas, pelo que todas as situações de duplicação devem ser interpretadas de forma muito cautelosa.
2.3 A inversão é um rearranjo estrutural intracromossómico relativamente frequente, com uma frequência estimada de 1/1.000 indivíduos. Pode ser encontrada como neo-mutação ou ser herdada ao longo de diversas gerações duma família.
Nesta alteração estrutural não há perda nem ganho de material cromossómico. Ocorre quando se produzem duas quebras num cromossoma seguidas de translação/ “passagem para cima ou para baixo” de 180º do fragmento cromossómico delimitado pelas quebras; por consequência, altera-se a ordem dos genes no cromossoma (ou das bandas, quando citogeneticamentre detectáveis).
As inversões podem ser paracêntricas ou pericêntricas, sendo estas últimas mais frequentes.
Nas inversões paracêntricas, as duas quebras ocorrem num mesmo braço do cromossoma. Assim, o rearranjo cromossómico não implica alteração da posição do centrómero, nem da morfologia do cromossoma, embora se altere a sequência das bandas no segmento invertido.
Nas inversões pericêntricas há uma quebra em cada braço de um cromossoma, ficando o centrómero incluído no fragmento sujeito a inversão. Assim, é habitual observar-se uma alteração morfológica bem aparente, inclusive da posição do centrómero.
2.4 A translocação constitui uma das alterações cromossómicas mais frequentes na espécie humana. Consiste na troca ou recombinação de partes de cromossomas não homólogos. Em geral, não se verifica perda de material cromossómico ou a perda de material cromossómico não afecta o fenótipo do indivíduo portador de uma forma equilibrada de translocação.
Classicamente descrevem-se três tipos de translocação: recíproca, robertsoniana e insercional ou de inserção.
Na translocação recíproca, a mais comum (frequência ~1/500 indivíduos), verifica-se a troca de dois fragmentos cromossómicos localizados em posição distal em relação a quebra ocorrida nos braços de dois cromossomas não homólogos. Qualquer cromossoma pode estar envolvido, bem como qualquer dos braços de dois cromossomas não homólogos.
Para as translocações recíprocas compatíveis com produtos de concepção viáveis, o risco de recorrência raramente é superior a 20-30%. Quando as alterações são extensas, o risco de recorrência é mais baixo devido à morte daqueles.
Os portadores de translocação recíproca podem estar em risco de ter descendência com anomalias físicas e intelectuais.
A translocação robertsoniana está entre os rearranjos cromossómicos mais comuns na população geral, com uma frequência variando entre 1/500 e 1/1.000 indivíduos.
Ocorrendo entre cromossomas acrocêntricos (13, 14, 15, 21, 22), seja entre os diversos ou entre homólogos, de salientar que a quebra se verifica no centrómero ou próxima deste nas sequências repetitivas do braço curto. Os fragmentos acêntricos correspondentes aos braços curtos perdem-se em subsequentes divisões celulares e os braços longos dos dois cromossomas fundem-se pelos topos originados pela quebra e originam uma nova forma de cromossoma.
O portador de uma translocação equilibrada tem um fenótipo normal dado que nos braços curtos apenas se localizam heterocromatina constitutiva e genes ribossomais cuja falta não se faz sentir porque os outros acrocêntricos também possuem este tipo de genes.
Nos indivíduos com translocação robertsoniana equilibrada entre cromossomas acrocêntricos homólogos (por exemplo 21;21 ou 13;13) todos os gâmetas produzidos são anormais, tendo como critério as características dos respectivos cromossomas.
A translocação insercional, ou simplesmente, inserção, na sua forma simples, requer três pontos de quebra. Os primeiros dois libertam um segmento intersticial de um cromossoma, que é depois inserido no espaço criado pelo terceiro ponto de quebra.
Na inserção simples intercromossómica, um segmento de um cromossoma é intercalado noutro cromossoma diferente.
Na inserção intracromossómica o segmento é intercalado numa parte diferente do mesmo cromossoma.
A inserção equilibrada, outra forma de translocação insercional, não se associa habitualmente a manifestações clínicas; contudo, tal como os restantes rearranjos cromossómicos que envolvem pontos de quebra já discutidos, pode associar-se a determinados fenótipos com risco elevado, da ordem de 50%, de a descendência ter anomalias.
2.5 No isocromossoma clássico, o material dos dois braços tem uma constituição igual, como uma imagem em espelho a partir do centrómero. O outro braço perde-se.
Um dos mecanismos que está na origem dos isocromossomas consiste na divisão transversal (em vez de longitudinal) do centrómero na mitose ou na meiose, separando as duas cópias dos braços curtos para um lado e as duas cópias dos braços longos para outro.
O isocromossoma dos autossomas não acrocêntricos é letal devido à extensa delecção de material que origina (todo o material de um dos braços). O isocromossoma X é compatível com a vida. O mais frequente é o isocromossoma do braço longo do cromossoma X associado a síndroma de Turner. (ver adiante)
Síndromas de causa cromossómica
Seguidamente descrevem-se algumas síndromas mais representativas da etiopatogénese cromossómica, fazendo parte da iconografia da Unidade de Recém-Nascidos (URN) do Hospital de Dona Estefânia, Lisboa.
Trissomia 21 (Síndroma de Down)
A trissomia 21 foi descrita pela primeira vez por Langdon Down em 1866, mas a sua causa foi desconhecida durante quase um século. Desde as descrições iniciais ressaltou que a idade materna destes indivíduos era avançada. Só em 1959 foi verificado que as crianças com trissomia 21 tinham 47 cromossomas, sendo o cromossoma extra um acrocêntrico, o 21. A designação de mongolismo caiu em desuso: referia-se ao facto de o fenótipo sugerir uma origem oriental pela obliquidade em V das fendas palpebrais. A trissomia 21 é geralmente diagnosticada ao nascer ou pouco depois, pela dismorfia facial característica e outras alterações fenotípicas.
As crianças são geralmente hipotónicas, o que tem relevância nos primeiros meses de vida. Em cerca de 40% a 60% dos casos existe cardiopatia congénita, (frequentemente defeitos completos do septo aurículo-ventricular). Existem também associadas outras anomalias do tubo digestivo e da área neuro-sensorial. Todas as crianças têm deficiência mental, habitualmente de grau moderado. Os indivíduos afectados têm uma sobrevivência cada vez mais longa.
A trissomia 21 (na proporção de 1/1.700 nados-vivos) ocorre na forma livre, por translocação ou em mosaico. A forma mais frequente é a forma livre (95% dos casos) em que todas as células apresentam 47 cromossomas. A causa principal é a não disjunção, relacionada com o aumento da idade materna. Em 4% dos casos, a trissomia 21 resulta de uma translocação que pode ocorrer de novo ou relacionar-se com uma translocação num dos progenitores, mais frequentemente dos cromossomas 14 e 21. O risco de recorrência depende dos cromossomas envolvidos e do progenitor com translocação. Cerca de 1% dos casos são mosaicos que, na maioria dos casos, correspondem a fenótipos menos marcados. A associação e a prevalência das características variam (Figura 1 e Quadro 1).
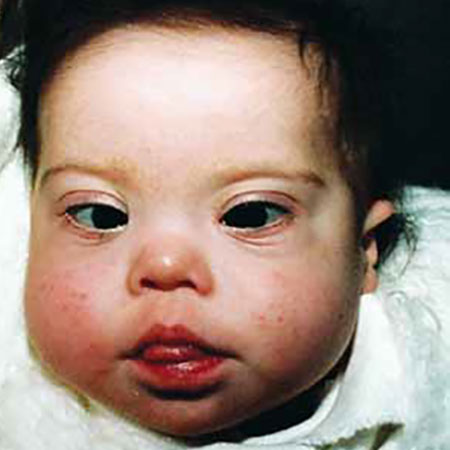
FIGURA 1. Caso de trissomia 21 (fácies)
QUADRO 1 – Síndroma de Down. Algumas características
| Características faciais |
· Face redonda/Dismorfia craniofacial · Pregas do epicanto e inclinação em V das fendas palpebrais · Manchas na íris, catarata, estrabismo · Profusão da língua · Orelhas pequenas |
| Outras anomalias |
· Occiput achatado · Sulcos anormais na palma das mãos e planta dos pés (dermatóglifos) · Hipotonia, obesidade, hiperlaxidão ligamentar · Cardiopatia congénita (40% dos casos) · Atrésia duodenal |
| Problemas de manifestação tardia |
· Dificuldades de aprendizagem · Baixa estatura · Infecções respiratórias correntes · Défice auditivo relacionável com otite serosa · Risco elevado de leucemia · Risco de instabilidade atlanto-axial (rara) · Hipotiroidismo · Doença de Alzheimer |
Trissomia 18 (Síndroma de Edwards)
A trissomia 18, descrita pela primeira vez por Edwards em 1960, tem uma frequência de 1 em cada 8.000 recém-nascidos. A esperança de vida destas crianças é em média de 2 meses, apesar de alguns casos sobreviverem vários anos. Cerca de 80% dos indivíduos são do sexo feminino. A etiologia da trissomia 18 mais frequente é a não disjunção, correspondendo cerca de 10% a mosaicos.
As crianças com trissomia 18 têm atraso de desenvolvimento grave, dismorfia facial característica (nomeadamente fronte proeminente, hipoplasia da mandíbula e pavilhões auriculares de baixa implantação e malformados). O esterno é curto. As mãos fecham-se de um modo característico, com o segundo e o quinto dedo sobrepondo-se ao primeiro e ao quarto. Os pés são arqueados com calcanhares proeminentes. São frequentes defeitos cardíacos (Quadro 2 e Figuras 2 e 3).
Outras anomalias do cromossoma 18
Foram identificadas outras anomalias, como deleções parciais do braço curto e longo, trissomia do braço longo, e cromossoma 18 em anel. Os fenótipos são característicos de cada anomalia.
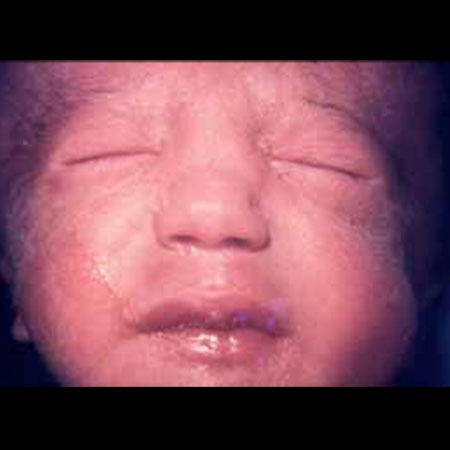
FIGURA 2. Síndroma de Edwards. Inclinação antimongolóide (em A) das fendas palpebrais
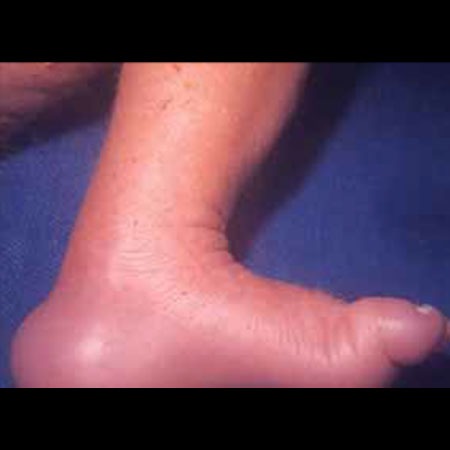
FIGURA 3. Síndroma de Edwards. Aspecto de calcanhar saliente, “em martelo”
QUADRO 2 – Síndroma de Edwards
· Maxilar inferior hipoplásico · Orelhas de implantação baixa · Sobreposição dos dedos das mãos (polegar sobre a palma, sobreposição do médio com o anelar) · Calcanhar saliente (em forma de “martelo”) · Defeitos congénitos cardíacos e renais |
Trissomia 13 (Síndroma de Patau)
A trissomia 13 foi pela primeira vez descrita por Patau em 1960. A frequência estimada é de 1 em cada 12.000 recém-nascidos, sendo as anomalias associadas invariavelmente identificadas em diagnóstico pré-natal. O mecanismo mais frequente é a não disjunção meiótica materna numa percentagem semelhante à trissomia 18. As anomalias mais frequentes são: holoprosencefalia, fenda labial e palatina (60-80% dos casos), microftalmia, polidactilia, defeitos cardíacos e renais. Cerca de 50% de RN afectados morre no período neonatal. (Figura 4)
Síndroma de Klinefelter (47, XXY)
Esta síndroma, descrita em 1942 por Klinefelter, tem uma frequência estimada de cerca de 1:1.000 crianças do sexo masculino. Fenotipicamente caracteriza-se por imaturidade no desenvolvimento sexual, testículos pequenos, alterações ou ausência de espermatogénese e ginecomastia; alguns pacientes são altos e de tipo eunuco. O défice cognitivo tem sido uma das características apontadas a esta e outras síndromas causadas por aneuploidias dos cromossomas sexuais; no entanto, os estudos mais recentes têm vindo a desmistificar este conceito, demonstrando que, apesar de o quociente de inteligência médio dos portadores destas cromossomopatias ficar ligeiramente abaixo da média do QI dos seus progenitores, o mesmo não atinge valores que possam considerar-se patológicos. Cerca de 15% dos casos corresponde a mosaicos, com duas ou mais linhas celulares, nomeadamente 46,XY/47,XXY.
Existem outras variantes, tais como síndroma 48,XXYY, 48,XXXY e 49,XXXXY, habitualmente associadas a fenótipos ligeiramente mais marcados.
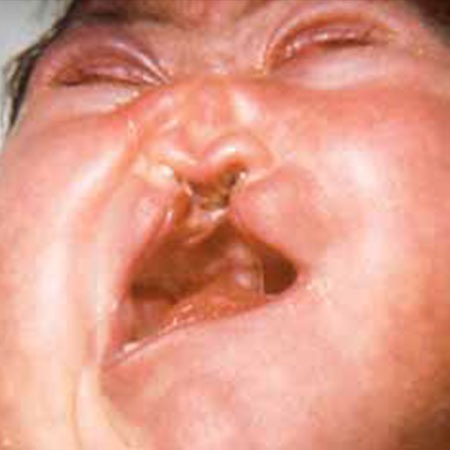
FIGURA 4. Síndroma de Patau em RN com holoprosencefalia
Síndroma de Turner (45,X)
A síndroma de Turner foi descrita em 1938 por Turner. Cerca de três quartos desta cromossomopatia são de causa paterna, resultado de um erro da meiose durante a gametogénese paterna. As raparigas afectadas têm um grau variável de baixa estatura, pescoço largo, baixa implantação da linha do cabelo e atraso/insuficiência pubertária. Tal como na síndroma de Klinefelter, as dificuldades de aprendizagem têm sido desvalorizadas pelos últimos estudos: muitos autores defendem que não deveriam fazer parte da caracterização desta situação. Na maioria dos casos há infertilidade e amenorreia. Cerca de 40% correspondem a mosaicos. Esta anomalia encontra-se frequentemente associada a hidropisia fetal e abortos espontâneos (Quadro 3). A cardiopatia é também uma das características possíveis e quando presente um indicador de mau prognóstico.
QUADRO 3 – Síndroma de Turner
· Linfedema das mãos e pés no recém-nascido · Baixa estatura · Prega do pescoço (pterygium colli) · Cúbito valgo · Mamilos muito afastados da linha média · Defeitos cardíacos congénitos (particularmente coarctação da aorta) · Disgenésia ovárica com consequente infertilidade · Desenvolvimento cognitive normal |
Síndroma de Williams
Resulta de uma delecção do gene da elastina em 7q11, na maior parte dos casos de novo. Os indivíduos têm um fenótipo que varia ao longo da vida com características bastante específicas tais como: dismorfia facial (arcadas supraciliares proeminentes, ponte nasal plana e boca grande); íris estrelada; cardiopatia (estenose aórtica supravalvular e estenoses periféricas da artéria pulmonar); défice cognitivo; perfil comportamental com loquacidade verbal e grande sociabilidade; e voz rouca.
Síndroma de Prader-Willi
É causada em cerca de 70% dos casos por uma delecção em 15q11-13 no cromossoma de origem paterna; dos restantes casos, uma parte tem origem em dissomia uniparental materna. O fenótipo é relativamente característico, com hipotonia e dificuldades na alimentação desde o nascimento, dismorfia facial, atraso do neurodesenvolvimento ligeiro a moderado, baixa estatura e compulsão para a comida, que se pode traduzir em obesidade.
Síndroma de Angelman
Resulta de uma delecção em 15q11-13 em 60% dos casos, no cromossoma de origem materna, e geralmente de novo. Os casos restantes são causados por dissomia uniparental paterna e por outros mecanismos moleculares não deleccionais (20% dos casos). Esta patologia caracteriza-se por um atraso cognitivo grave, défice importante da linguagem e microcefalia. As etapas de desenvolvimento estão afectadas precocemente, estando descritas alterações neurológicas características.
Síndroma de Smith-Magenis
Resulta de uma microdelecção na região 17p11.2. Os indivíduos têm défice cognitivo, fenótipo comportamental que se caracteriza por auto-agressividade e perturbação no padrão do sono. É frequente a baixa estatura e a obesidade.
Alterações cromossómicas somáticas no cancro
Em 1960, Peter Nowell e David Hungerford associaram pela primeira vez, uma anomalia cromossómica com o aparecimento de cancro, utilizando uma técnica de citogenética em tecido tumoral.
Especificamente, foi descrito o cromossoma Philadelphia em doentes com leucemia mieloide crónica. Este cromossoma resulta de uma translocação específica entre os cromossomas 9 e 22.
As técnicas de biologia molecular permitiram saber que no ponto de quebra, no cromossoma 9, ocorrendo a fusão dos genes BCR e ABL, que passam a codificar uma proteína anómala que interfere com regulação normal do ciclo celular, surge crescimento celular descontrolado.
Posteriormente, foram identificadas centenas de alterações cromossómicas associadas a genes específicos que provocam instabilidade no genoma. Estas anomalias são altamente variáveis em diferentes cancros, bem como os fenótipos resultantes. O seu estudo tem valor para confirmar o diagnóstico e para prognóstico.
Algumas translocações foram associadas a diferentes tipos de cancro, como são o caso da t(2;5) (p23;q35) no linfoma anaplásico de células grandes, e a t(8;14) no linfoma de Burkitt (gene c-myc).
Uma das hipóteses apontadas para explicar esta associação sugere que as primeiras alterações patogénicas nas células tumorais resultam de rearranjos equilibrados, que conferem à célula características proliferativas. Os rearranjos interrompem genes específicos envolvidos na regulação celular, como proto-oncogenes ou genes supressores de tumores, formando genes híbridos ou interferindo com os mecanismos de reparação de ADN. Com a progressão da neoplasia, surgem as mais variadas alterações cromossómicas, estruturais ou numéricas, tornando-se cada vez mais desequilibradas com a progressão da doença.
O estudo das formas hereditárias de cancro tem contribuído para a compreensão dos mecanismos associados à génese tumoral, identificando-se vários genes relacionados com o desenvolvimento de cancro familiar. As tecnologias de microarrays e CGH têm permitido obter conhecimentos importantes nesta área.
BIBLIOGRAFIA
Braude P. Preimplantation diagnosis for genetic susceptibility N Engl J Med 2006; 355: 541-543
Burton PR, Tobin MD, Hopper JL. Key concepts in Genetic Epidemiology. Lancet 2005; 366: 941-950
Carss KJ, Hillman SC, Parthiban V, et al. lan DJ, Maher ER, Kilby MD, Hurles ME. Exome sequencing improves genetic diagnosis of structural fetal abnormalities revealed by ultrasound. Hum Mol Genet 2014; 23: 3269-3277
Christensen K, Murray JC. What genome – wide association studies can do for Medicine. N Engl J Med 2007; 356: 1094-1097
DiMaio S M, Fox J E, Mahoney M J. Prenatal Diagnosis Cases & Clinical Challenges. London: Willey-Blackwell, 2010
Dukhovny S, Norton ME .What are the goals of prenatal genetic testing? Semin Perinatol 2018; 42: 270-274
Ensenamer E, Reinke SS, Ackerman MJ, Tester DJ, Whiteman DAH, Tefferi A. Primer on medical genomics. Part VIII: Essentials of Medical Genetics for the Practicing Physician. Mayo Clin Proc 2003; 78:846-857
Goldman L, Schafer AI (eds). Goldman-Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Gosden RG, Feinberg AP. Genetics and Epigenetics – Nature´s Pen-and-pencil set. N Engl J Med 2007; 356: 731-736
Harper S, Hauser MA, DelloRusso C, Duan D et al. Molecular flexibility of dystrophy: implications for gene therapy of Duchenne muscular dystrophy. Nature Med 2002; 8: 253-261
Kliegman RM, Stanton BF, StGeme JW, Schor NF, (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier Saunders, 2015
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Neuhaus CP, Zacharias RL. Compassionate use of gene therapies in pediatrics: An ethical analysis. Semin Perinatol 2018; 42: 508-514
Rudolph CD, Rudolph AM, Lister GE, First LR, Gershon AA (eds). Rudolph´s Pediatrics. New York: McGraw-Hill, 2011
Shachan, T Read AP. Human Molecular Genetics. New York: John Wiley & Sons. 1999
Shastry BS. Schizophrenia: a genetic perspective (review). Int J Mol Med 2002; 9: 207-212
World Health Organization. Genomics and world health- the advisory committee on health research. Geneve: The World Health Organization, 2002
Wou K, Chung WK, Wapner RJ. Laboratory considerations for prenatal genetic testing. Semin Perinatol 2018; 42: 307-313
Zletogora J. Parents of children with autosomal recessive disorders are not always carriers of the respective mutant allels. Hum Genet 2004; 114: 521-526