*Revisão de Aguinaldo Cabral
1. DOENÇAS DO METABOLISMO DAS PURINAS E PIRIMIDINAS
Introdução
A propósito do tema-base deste capítulo, e para uma melhor compreensão do mesmo, importa recordar certas noções essenciais relacionadas.
As purinas (adenina e guanina ou guanidina) e as pirimidinas (tiamina, citosina e uracilo) são bases azotadas, componentes essenciais dos nucleótidos.
Os nucleótidos são compostos constituídos por um açúcar (ribose ou desoxirribose) ligado ao ácido fosfórico sob a forma de éster e combinado com uma base púrica ou com uma base pirimídica. Os referidos nucleótidos são constituintes essenciais de todas as células vivas, sob a forma de ácidos nucleicos ou de fosfatos destes ácidos. Certos nucleótidos actuam como transportadores de energia em diversas reacções enzimáticas.
A propósito de ácidos nucleicos, citam-se o ácido ribonucleico (ARN ou RNA) e o ácido desoxirribonucleico (ADN ou DNA).
O RNA é um ácido nucleico cujo açúcar é a ribose, o qual é um constituinte do citoplasma e núcleo das células.
O DNA tem como açúcar uma ribose que perdeu oxigénio (daí a designação do prefixo desoxi). Os DNA são igualmente constituintes dos núcleos celulares, os quais incorporam cromossomas contendo genes. Em suma, os genes, partículas elementares dos cromossomas, são constituídos essencialmente por DNA.
Metabolismo das purinas e pirimidinas
Abordar sucintamente o metabolismo das purinas e pirimidinas implica uma descrição breve da síntese dos ácidos nucleicos; esta faz-se a partir da ribose-5-fosfato que, sob a acção da fosfo-ribosil-pirofosfato sintetase (PRPS) origina a P-5-ribose-pirofosfato (PRPP) de que derivam dois tipos de compostos: precisamente, as purinas (ou bases purínicas) e as pirimidinas (ou bases pirimídicas).
A biossíntese das purinas decorre duma via complexa implicando diversas enzimas e mecanismos de retrocontrolo, resultando em inosina monofosfato (IMP), que é convertida em adenosina monofosfato e guanosina monofosfato (AMP, GMP). As purinas são catabolisadas via transformação hipoxantina → xantina → ácido úrico.
A biossíntese das pirimidinas faz-se por junção à PRPP de ácido orótico proveniente do aspartato e do carbamil fosfato. Forma-se assim o ácido orótico e o ácido uridílico, precursores das bases pirimídicas dos ácidos nucleicos, o que implica – tal como na via das purinas – a intervenção de diversas enzimas e mecanismos de retrocontrolo que podem estar ausentes, deficitários ou disfuncionantes (por ex. hiperactividade).
As doenças hereditárias do metabolismo das purinas e pirimidinas, traduzem as perturbações em diversos passos das vias metabólicas, com implicações clínicas.
Manifestações clínicas gerais
No seu conjunto, a clínica poderá integrar:
- manifestações renais: infecções recorrentes do tracto urinário, nefrolitíase, insuficiência renal;
- manifestações neuropsíquicas: atraso psicomotor, epilepsia, espasticidade, distonia, ataxia, coreoatetose, autismo, automutilação, surdez, cegueira congénita, dismorfias, etc.;
- artrite e gota;
- baixa estatura;
- cãimbras e fraqueza musculares, hipotonia;
- imunodeficiência e infecções recorrentes, etc..
Diagnóstico
Para o diagnóstico torna-se fundamental valorizar um conjunto de parâmetros, a saber:
- determinação do nível de ácido úrico no soro e na urina de 24 horas;
- determinação da relação ácido úrico/ creatinina na urina da manhã;
- detecção de cristais urinários;
- estudo das purinas e pirimidinas na urina de 24 horas, evitando nas 24 horas precedentes e durante a colheita, a ingestão de xantinas (veiculadas pelo chá, café, cacau, licores, etc.);
- determinação do ácido orótico na urina.
Nosologia
As doenças resultantes de alteração do metabolismo das purinas e pirimidinas integram um conjunto muito heterogéneo, com formas de apresentação diversa. (Quadro 1)
QUADRO 1 – Doenças das purinas e pirimidinas.
PURINAS
|
PIRIMIDINAS
|
Principais doenças do metabolismo das purinas
Seleccionam-se, como exemplos mais representativos, as seguintes:
Deficiência de adenosina deamidase (ADA)
Sucintamente, esta afecção integra um quadro de imunodeficiência combinada grave, múltiplas infecções recorrentes, diarreia, hipocrescimento, sinais neurológicos progressivos, hipogamaglobulinémia, linfopénia e elevação da adenosina e deoxiadenosina. O tratamento consiste em transplante da medula óssea, salientando-se que é possível a terapêutica de reposição enzimática.
A terapêutica génica é controversa.
Nefropatia hiperuricémica familiar juvenil
Trata-se dum quadro possivelmente relacionado com defeito de transporte renal. Manifestando-se a partir da puberdade, é caracterizado por gota, insuficiência renal precoce e antecedentes familiares de idêntica patologia.
Comprova-se, por exame laboratorial, hiperuricémia, excreção renal diminuída de ácido úrico, e relação elevada ácido úrico/ creatinina.
Síndroma de Lesch-Nyhan
Esta síndroma, de transmissão ligada ao cromossoma X, decorre de regeneração deficiente de IMP a partir de hipoxantina, e de GMP, a partir de guanina, com implicação da enzima HPRT (hipoxantina/ guanina fosfo-ribosil transferase). As manifestações clínicas, que podem manifestar-se a partir dos 3-4 meses, integram atraso motor, hipotonia muscular, distonia, coreoatetose, espasticidade com hiperreflexia, epilepsia, automutilação compulsiva, gota, cálculos de ácido úrico e insuficiência renal.
Nos primeiros meses é notada a presença de cristais cor de laranja nas fraldas.
Estão descritas formas de mais discreta expressão clínica, quer articular, quer neurológica. (Figura 1)
Existe hiperuricémia, aumento da relação ácido úrico/ creatinina na urina da manhã e aumento da hipoxantina. O tratamento, sem efeito na sintomatologia neurológica, inclui regime alimentar com restrição de purinas e administração de alopurinol.
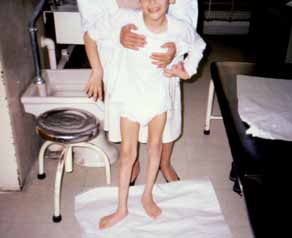
FIGURA 1 – Síndroma de Lesch-Nyhan: criança com distonia; são visíveis as marcas de automutilação na mão esquerda. (Cortesia do Dr. Aguinaldo Cabral)
Outras doenças do metabolismo das purinas
Salientam-se, entre outras:
- a hiperactividade da fosfo-ribosil pirofosfato sintetase (PRPS), ligada ao X, cursando com hiperuricémia, hiper ou hipoxantinémia e quadro de gota, associando-se nefrolitíase e surdez neurossensorial; e
- a xantinúria por défice da xantina-oxidase ou xantina-desidrogenase cursando com nefrolitíase e artromiopatia, hematúria, hipouricémia, hiperxantinémia e hiper-hipoxantinémia.
Ambas requerem dieta restrita em purina e alopurinol.
Principais doenças do metabolismo das pirimidinas
Citam-se, entre outras, duas entidades:
Acidúria orótica hereditária
Esta afecção, resultante do défice de uridina-monofosfato sintetase, pode manifestar-se já no RN e lactente com um quadro de hipocrescimento, atraso no neurodesenvolvimento e anemia megaloblástica refractária ao tratamento. O achado laboratorial mais notório é a elevação maciça de ácido orótico na urina. O tratamento consiste na administração de uridina (25 a 150 mg/kg/dia) em função do resultado do doseamento urinário de ácido orótico.
Deficiência de timidina fosforilase (TP)
A principal característica clínica desta doença, em geral com início de manifestações entre os 5 e 15 anos, é a chamada encefalopatia mitocondrial (mio-neuro-gastrintestinal – sigla MNGIE) acompanhada de diarreia intermitente alternando com períodos de pseudobstrução, neuromiopatia com RRF, oftalmoplegia externa crónica progressiva (CPEO), neuropatia periférica e caquexia. Como achado laboratorial ressalta-se a elevação do teor de timidina na urina.
2. DOENÇAS DO METABOLISMO DO HEME: AS PORFÍRIAS
Introdução
A síntese da hemoglobina, em cuja fórmula química entra o heme (constituído por núcleo tetrapirrólico e ferro), é um fenómeno muito complexo. Classicamente, podem ser esquematizados os seguintes passos na respectiva via metabólica: combinação dos ácidos succínico e glicínico resultando o ácido α-amino- β-ceto-adípico que imediatamente se transforma por descarboxilação em ácido δ-amino-levulínico; da polimerização deste último forma-se porfobilinogénio, passo fundamental da sucessiva formação de porfirinas (uroporfirina III, coproporfirina III e protoporfirina III). Finalmente introduz-se o ferro no interior do núcleo da protoporfirina, produzindo-se o heme.
No âmbito da abordagem sucinta do metabolismo do heme, é importante recordar, para melhor compreensão dos problemas clínicos a ele ligados, que a biossíntese daquele se processa a partir da glicina e succinil-CoA, principalmente na medula óssea (~80%) e no fígado, com o concurso de oito enzimas. O heme é metabolizado em bilirrubina, com ulterior excreção biliar.
As porfírias são doenças monogénicas, frequentemente de transmissão autossómica dominante (AD) caracterizadas pela acumulação e excreção excessivas de porfirinas e de seus precursores. Cada uma das porfírias é consequência do defeito de uma enzima da via de síntese do heme. Os défices de actividade enzimática rersultam de mutações dos genes correspondentes a cada enzima.
Descrevem-se dois grupos de porfírias tendo em conta os tecidos em que o defeito metabólico primariamente se expressa:
- Hepáticas
- Eritropoiéticas
A definição geral de porfíria exige que, além da eliminação de porfirina ou dos seus precursores, exista um quadro clínico imputável à acção tóxica das porfirinas (síndroma cutânea, abdominal, neurológica ou psíquica). A única excepção é a intoxicação por chumbo, actualmente inexistente, citada apenas por razões histórias e pedagógicas. |
Manifestações clínicas gerais
Sob o ponto de vista clínico consideram-se duas formas:
- aguda neurovisceral; e
- cutânea.
As manifestações clínicas das anomalias do metabolismo do heme integram fundamentalmente sintomas abdominais, neurológicos e dermatológicos, os quais estão relacionados com níveis elevados de porfirinas e seus precursores no sangue, sua acumulação nos tecidos, e ulterior excreção pela urina e fezes.
Nas porfírias eritropoiéticas a fotodermatose das partes expostas à luz é característica.
Nas formas agudas constuem características: dor abdominal crónica, náuseas, vómitos, obstipação e sintomas psiquiátricos.
Nas formas não agudas predominam as manifestações dermatológicas.
Diagnóstico
Para o diagnóstico torna-se fundamental valorizar um conjunto de parâmetros, a saber:
- detecção de porfobilinogénio na urina (provas de Hoesch, de Watson-Schwartz), havendo suspeita de porfíria hepática aguda;
- detecção de coproporfirina e protoporfirina nas fezes;
- detecção de coproporfirina e porfirinas (uro, hepta-, hexa-, penta-) na urina;
- detecção de precursores da porfirina (ácido delta-aminolevulínico e porfobilinogénio) na urina nos casos de suspeita de porfíria hepática e doença de Gunther;
- detecção da actividade enzimática eritrocitária em situações específicas (sobretudo na protoporfíria): por ex. deidratase do ácido delta-aminolevulínico, sintetase do uroporfirinobilinogénio III, etc..
Nosologia
O Quadro 2, adaptado de Saudubray, sintetiza a classificação das porfírias relacionando as diversas entidades clínicas com os respectivos defeitos enzimáticos.
QUADRO 2 – Porfírias e defeitos enzimáticos.
| Doença/ Porfíria | Enzima | Classificação | |||
| Hepática | Eritropoiética | Aguda | Cutânea | ||
| De-hidratase ácida 5-aminolevulínica | De-hidratase ácida 5-aminolevulínica | ?X | X | ||
| Aguda intermitente | Desaminase porfobilinogénio | X | X | ||
| Congénita eritropoiética | Co-sintetase uroporfirinogénio III | X | X | ||
| Tardia cutânea | Descarboxilase uroporfirinogénio | X | X | ||
| Hepatoeritropoiética | Descarboxilase uroporfirinogénio | X | X | X | |
| Coproporfíria hereditária | Oxidase coproporfirinogénio | X | X | X | |
| Variável | Oxidase protoporfirinogénio | X | X | X | |
| Protoporfíria ertitropoiética | Ferroquelatase | X | X | ||
Alguns exemplos de porfírias
Foram seleccionadas as seguintes entidades:
Porfíria eritropoiética congénita (doença de Gunther)
Esta afecção, manifestando-se desde idades muito precoces (período neonatal), com transmissão autossómica recessiva (AR), é muito rara. Só é patente nos homozigotas.
A etiopatogénese relaciona-se com defeito enzimático correspondente à co-sintetase uroporfirinogénio III (10q25.2-q26.3). Na ausência de metabolizção, os porfirinogénios são oxidados, dando origem a hiperprodução de uro- e coproporfirina I, compostos fotoactivos responsáveis pela fotossensibilidade.
As manifestações clínicas caracterizam-se por fotossensibilidade grave, levando a fotodermatose, por vezes mutilante (nariz, lábios, orelhas e mãos) associada a crises hemolíticas explicadas por acção dos raios solares sobre os eritrócitos circulando nos capilares subcutâneos.
Os dentes e escleróticas podem ter coloração avermelhada e fluorescerem com a luz de Wood. Outras manifestações oculares incluem blefarite, ectropion cicatricial, conjuntivite e opacificação da córnea, podendo levar a cegueira.
A urina pode ter coloração rosada devido à eliminação de porfirinas.
O tratamento inclui evitar a radiação solar, usando roupa e óculos com protecção UV, e chapéu de abas largas. A administração de beta-caroteno tem utilidade limitada. A hemólise poderá estabelecer a indicação de transfusão sanguínea. Alguns autores aconselham a administração de alfa-tocoferol (vitamina E) e de vitamina C como captadores e inibidores de radicais livres, tentando prevenir a fototoxicidade cutânea induzida pelas porfirinas acumuladas na pele e eritrócitos.
Porfíria hepática intermitente aguda
É a porfíria mais comum. Mais frequente no sexo feminino, manifesta-se na adolescência e idade adulta mediante a acção de desencadeantes como fármacos indutores enzimáticos, fome, estresse, álcool, barbitúricos, hormonas contraceptivas, menstruação, etc..
Trata-se de doença de transmissão autossómica dominante (AD); a mesma resulta de défice da enzima porfobilinogénio desaminase (11q23) avaliada nos eritrócitos.
Os precursores das porfirinas acumulam-se e são responsáveis pelas seguintes manifestações clínicas: vómitos, cólicas abdominais, quadro simile abdómen agudo, polineuropatia periférica, taquicardia, hipotensão, tremores, e sudorese aumentada; e ainda, dores generalizadas (cabeça, pescoço, tórax), fraqueza muscular, disúria, convulsões por hiponatrémia e manifestações do foro psiquiátrico.
As crises graves e prolongadas podem ser fatais por paralisia bulbar. Existe risco aumentado de hepatocarcinoma, depressão e suicídio.
De acordo com os exames laboratoriais importa salientar:
- os precursores porfobilinogénio [PBG] e ácido 5-aminolevulínico evidenciam subida da sua concentração na urina;
- nas fezes a concentração de porfirinas é normal ou está ligeiramente aumentada; este dado é importante para o diagnóstico diferencial com outras porfírias.
O tratamento tem como objectivo essencial inibir a síntese de heme e a produção de precursores de porfirinas, adoptando-se a seguinte actuação:
- nas crises agudas, para além da evicção de desencadeantes, está indicada analgesia (clorpromazina, opiáceos), anti-emese (promazina) e glicose a 10% IV (4-6 g/kg/dia) e hematina (3-4 mg/kg/dia) em administração IV lenta de curta duração, durante 4 dias;
- se não for possível esta actuação, é necessário providenciar elevado suprimento de hidratos de carbono (300-500 g/dia). Nas crises agudas a hospitalização é frequente.
O tratamento das convulsões é problemático: podem ser administrados brometos, gabapentina e vigabatrim.
Protoporfíria eritropoiética-hepática
Esta doença, de transmissão AD, tem como base etiopatogénica défice de descarboxilase uroporfirinogénio. Como manifestações clínicas, essencialmente registam-se fotossensibilidade, fotodermatose (urticária solar de repetição) e, nalguns pacientes, doença hepática que poderá culminar em insuficiência hepática.
Para além dos marcadores atrás referidos a propósito do diagnóstico laboratorial das porfírias em geral, cabe referir o teor elevado de protoporfirina livre nos eritrócitos, plasma e fezes.
O tratamento inclui fotoprotecção, administração de beta-carotenos, cisteína, colestiramina e ácidos biliares nas complicações hepáticas. O transplante hepático é controverso e o transplante de medula óssea poderá trazer benefícios.
BIBLIOGRAFIA
Balasubramaniam S, Duley JA, Christodoulou J. Inborn errors of purine metabolism: clinical update and therapies. J Inherit Metab Dis 2014;37:669-686
Balwani M, Desnick RJ. The porphyrias: advances in diagnosis and treatment. Blood 2012;120:4496-4504
Dabrowski E, Smathers SA, Ralstrom CS, et al. Botulinum toxin as a novel treatment for self-mutilation in Lesch-Nyhan syndrome. Dev Med Child Neurol 2005;47:636- 639
Fernandes J, Saudubray JM, van den Berghe G, Walter JH (ed). Inborn Metabolic Diseases – Diagnosis and Treatment. Heidelberg: Springer-Verlag, 2006;175-188
Guerra-Rodrigo F, Marques-Gomes M, Mayer da Silva A, Filipe PI. Dermatologia. Lisboa: Fundação Calouste Gulbenkian Editora, 2010
Kauppinen R. Porphyrias. Lancet 2005;365:241-252
Kelley RE, Andersson HC. Disorders of purines and pyrimidines. Handb Clin Neurol 2014;120:827-838
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Lyon G, Kolodny EH, Pastores GM (eds). Neurology of Hereditary Metabolic Diseases of Children. New York: McGraw-Hill, 2006
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Puy H, Gouya L, Deybach JC. Porphyrias. Lancet 2010; 375: 924-937
Sass JO, Hoffmann M, Skladal D, et al. Propionic acidemia revisited: a workshop report. Clin Pediatr (Phila) 2004;43:837-843
Saudubray JM, Garcia – Cazorla A. Inborn errors of metabolism overview: pathophysiology, manifestations, evaluation and management. Pediatr Clin N Am 2018;65:179-208
Scriver CR, Beaudet AL, Sly WS, et al (eds). The Metabolic and Molecular Basis of Inherited Disease. New York: McGraw-Hill, 2001
Valle D, Beaudet Al, Vogelstein B, et al (eds). The Metabolic and Molecular Basis of Inherited Disease. New York: McGraw-Hill, 2014