Definições e importância do problema
Define-se problema respiratório no RN (ou, no sentido genérico, síndroma de dificuldade respiratória/ SDR) como a verificação de dois ou mais dos seguintes sinais:
- Frequência respiratória >60/minuto;
- Cianose respirando ar;
- Adejo nasal;
- Retracções costais ou xifoideia;
- Gemido expiratório. (Figura 1)
Outro critério para definir síndroma de dificuldade respiratória baseia-se na valorização do chamado índice de Silverman-Andersen. (Quadro 1)
Não havendo dificuldade respiratória, o índice de Silverman-Andersen será 0 (zero), isto é, 0/10. Numa perspectiva de avaliação prática inicial, convencionou-se considerar a existência de dificuldade respiratória nas situações em que o referido índice é igual ou superior a 4 na primeira hora de vida, e igual ou superior a 3 a partir da segunda hora de vida.
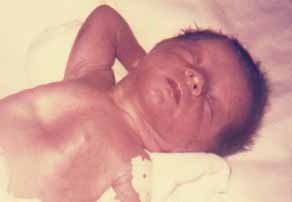
FIGURA 1. RN com dificuldade respiratória, sendo notórias a retracção xifoideia e a cianose.
QUADRO 1 – Índice de Silverman–Andersen.
| resp = respiração; abd = adominal | |||||
| Pontuação | Expansão torácica | Retracção intercostal | Retracção xifoideia | Adejo nasal | Gemido expiratório |
| 0 | Boa, síncrona com expansão abdominal | 0 | 0 | 0 | 0 |
| 1 | Amplitude irregular sem sincronismo com resp. abd. | Ligeira ou ausente | Ligeira | Ligeiro | Audível com estetoscópio |
| 2 | Expansão torácica com retracção abd. | Acentuada | Acentuada | Acentuada | Audível sem estetoscópio |
Na literatura científica é clássico considerar o termo de síndroma de dificuldade respiratória como sinónimo de “síndroma de dificuldade respiratória típico da prematuridade ou doença da membrana hialina” (imaturidade pulmonar por défice de surfactante).
Notas importantes: 1- A presença de estridor pode sugerir colapso da via aérea superior por laringo ou traqueomalácia; e, se for acentuado, obstrução mecânica alta. 2 – A auscultação de sibilâncias ou de expiração prolongada pode estar relacionada com estenose traqueobrônquica. |
Genericamene, aplica-se a designação de insuficiência respiratória às situações de dificuldade respiratória em que são valorizados critérios biológicos, tais como determinação de pH e gases no sangue. Salienta-se, no entanto, como excepção a este conceito, a verificação de apneia prolongada: este critério clínico, isoladamente, legitima a definição de insuficiência respiratória. Adiante, a propósito dos critérios para ventilação na UCIN, será dada ênfase a este conceito fisiopatológico.
Os problemas respiratórios manifestam-se em cerca de 3 a 5% dos RN de acordo com estatísticas englobando nados-vivos seguidos em maternidade. Considerando a globalidade dos RN pré-termo, tais problemas surgem em cerca de 1/3 dos mesmos.
Este tipo de patologia constitui uma causa importante de morbilidade e de mortalidade neonatais, nomeadamente no RN pré-termo. Tal pode ser explicado pelas seguintes circunstâncias:
- Complexidade dos mecanismos de adaptação pulmonar à vida extrauterina;
- Defeitos do desenvolvimento pulmonar condicionando anomalias congénitas;
- Imaturidade anatómica e funcional do sistema respiratório no RN pré-termo;
- Susceptibilidade do RN às infecções.
Particularidades da fisiologia da respiração no RN
Resistência pulmonar ao fluxo de gases
As particularidades anatomofisiológicas mais importantes com influência no fluxo de ar são descritas na caixa a seguir.
|
Compliance pulmonar
Esta designação (com terminologia de língua inglesa rotineiramente utilizada na gíria médica) define a característica de distensibilidade (complacência) alveolar, traduzida pela relação entre variação de Volume (V)/variação de Pressão (P), em mL/cm H2O; ou seja, o fenómeno da possibilidade de o alvéolo se distender, aumentando o seu volume (V) como resposta a um determinado aumento de pressão (P), durante a inspiração.
No recém-nascido a compliance é cerca de 2 mL/cm H2O aos 3 minutos de vida, 4 aos 60 minutos de vida e 5-14 pela idade de 7 dias, enquanto no adulto é da ordem dos 170 mL/cm H2O. (Figura 2)
Não será, portanto, difícil compreender a necessidade de um esforço muscular bastante superior para encher de ar os alvéolos no período neonatal pela menor compliance ou distensibilidade pulmonar, então verificada.
A força oposta (o inverso da) à distensibilidade é a resistência elástica do tórax ou elastância; tal resistência – elástica no RN – resulta quase exclusivamente da tensão superficial (TS) ou forças de tensão ao nível da superfície de contacto ar-líquido nos alvéolos (sendo que no adulto a comparticipação de tais forças é apenas 50%).
FIGURA 2. Curva volume/ pressão no recém-nascido (inspiração e expiração).
A TS depende da ausência ou presença de surfactante: mais surfactante à menor TS à maior aumento do volume alveolar. A pressão intra-alveolar (P) necessária para se opor à tendência de os alvéolos colapsarem é dada pela fórmula de La Place,
P = 2 x TS
R
em que R = raio do alvéolo; quanto maior o R (alvéolo mais expandido), menor pressão (P) necesária para o “abrir ou o expandir” mais. (ver adiante surfactante)
Volumes pulmonares no período neonatal
Na Figura 3 podemos comparar, de modo estático, os volumes pulmonares num RN normal e num RN em que a função respiratória está alterada.
Para compreender a fisiopatologia e a resposta a eventuais intervenções terapêuticas, incluindo a ventilação artificial não invasiva, importa igualmente recordar aspectos básicos (dinâmicos) da mecânica pulmonar, tendo como modelo a Figura 3-A (Fases do ciclo respiratório).
A frequência respiratória corresponde ao número de excursões respiratórias/ciclos respiratórios por minuto. Durante uma inspiração normal, o sistema respiratório gera pressão negativa intratorácica com consquente entrada de ar nos pulmões (volume corrente).
Reportando-nos ao esquema da Figura 3-A, importa referir que, numa inspiração provocada artificialmente por insuflação de ventilador artificial, é gerada uma pressão positiva inspiratória (PIP), também designada por pressão inspiratória máxima de “pico”. Tempo inspiratório ou Ti corresponde à curva ascendente de convexidade superior prolongando-se com o plateau.
O volume de ar introduzido nos pulmões (durante certo tempo, o tempo inspiratório/TI – traduzido por curva ascendente) é mantido na via aérea durante certa pausa para a difusão de gases nos alvéolos (para simplificar, a duração do plateau/horizontalidade da linha após concluída a inspiração, não foi especificada no esquema).
A esta pressão obtida na via aérea durante esta pausa, chama-se pressão plateau, a qual depende da PIP e da distensibilidade pulmonar (compliance).
FIGURA 3. Volumes pulmonares num RN normal e num RN com SDR.
Figura 3-A Fases do ciclo respiratório
Durante a expiração normal, o pulmão é esvaziado de forma passiva em função da retracção elástica pulmonar (Tempo expiratório/Te <> curva descendente de concavidade superior que não toca na linha de base, mantendo-se ligeiramente distanciada e superior a esta por se gerar uma pressão final positiva expiratória (PEEP), superior à que corresponde à linha basal.
Efectivamente, em situação fisiológica, de normalidade, no final da expiração (quer da expiração normal, quer da expiração forçada – ver atrás CRF e VR – ), os alvéolos não se colapsam, ficando medianamente distendidos, precisamente por se gerar, no final, a referida PEEP fisiológica, garantindo a normalidade das trocas gasosas e evitando, pois, a atelectasia.
Existe tecnologia permitindo gerar, aumentar e regular de modo controlado a PEEP artificialmente: amplificando a designada PEEP fisiológica, a partir do volume residual, pode contribuir-se, de modo minimamente invasivo, para a melhoria das trocas gasosas.
Trocas gasosas ao nível dos pulmões
Relação ventilação-perfusão
Em condições óptimas de trocas gasosas ao nível da membrana alvéolo-capilar, a relação entre a ventilação alveolar (VA) e o débito sanguíneo capilar (Q) deve ser igual a 1.
Na Figura 4 podemos esquematicamente examinar as situações em que tal relação está alterada.
- Hipoventilação alveolar
Está esquematizada na hipótese C: VA/Q <1: é o que acontece nas situações de obstrução brônquica ou de depressão respiratória impedindo que o ar alveolar seja suficientemente renovado, estando intacta a pefusão sanguínea capilar. Há, consequentemente, ao mesmo tempo, diminuição da PO2 e elevação da PCO2.
FIGURA 4. Anomalias da relação ventilação-perfusão em A, B, C e D. Alvéolo normalmente irrigado e ventilado em E.
- Shunts
Nestas circunstâncias, verifica-se uma mistura de sangue venoso com sangue arterial, o que traz como consequência uma diminuição da PaO2.
Na hipótese A: o sangue perfunde alvéolos não ventilados (v. g. atelectasias, membranas hialinas). O sangue não oxigenado vai eventualmente misturar-se, a jusante, com o sangue oxigenado, proveniente de capilares vizinhos eferentes de alvéolos onde se processou a oxigenação (shunt capilar).
Na hipótese B: neste caso, não se verifica passagem de sangue através dos capilares pulmonares, por exemplo, em caso de foramen ovale ou de canal arterial (shunt anatómico).
Os shunts anatómicos capilares são característicos da circulação de tipo fetal, embora possam ser restabelecidos em certas circunstâncias de vida extrauterina, mesmo que não exista malformação cardiovascular; é o que se passa em situações de acidose e hipoxémia.
O diagnóstico destes shunts baseia-se na prova da “hiperóxia” e que consiste na administração de O2 a 100% durante 20 minutos e concomitante medição de PaO2. A situação será tanto mais grave quanto maior a percentagem de O2 no ar inspirado para obter PaO2 normal.*
*Citada por razões históricas dado o desenvolvimento de novas tecnologias para atingir o mesmo objectivo. |
A Figura 5 mostra a relação entre a pressão alveolar de O2 (PAO2) e a pressão arterial de O2 (PaO2) em função do grau de mistura de sangue arterial (mais oxigenado) com sangue venoso (menos oxigenado) em situações de curto-circuito (shunt) direito-esquerdo; ou seja, para idêntica pressão alveolar de O2, a pressão arterial de O2 é tanto maior quanto menor a percentagem de mistura de sangue não oxigenado (por ex. com pressão alveolar de O2 de 200 mHg obtém o PaO2 de 200 mmHg se não houver mistura (0%); se houver mistura de 20% de sangue não oxigenado com a mesma pressão de O2 obtém-se Pa de 100 mmHg (menor).
- Espaço morto
Corresponde à hipótese assinalada em D: VA/Q >1; os alvéolos são normalmente ventilados, mas não são irrigados. Existe aumento da PCO2 sem diminuição da PO2.
Afinidade da hemoglobina para o oxigénio
A existência de hemoglobina fetal F no RN modifica a afinidade desta para o O2.
Como se pode depreender da Figura 6, a curva de dissociação da hemoglobina desloca-se para a esquerda, dada a afinidade aumentada da hemoglobina para o oxigénio em tais circunstâncias; tal afinidade resulta dum défice de 2,3-diphosphoglicerato (2,3-DPG), défice tanto maior quanto menor for a idade gestacional.
Verifica-se, pelo contrário, deslocação para a direita quando diminui o pH, aumenta a PCO2, ou aumenta a temperatura.
Como resultado duma muito maior captação de O2 pela HbF a quantidade de O2 a distribuir pelos tecidos é muito menor, o que implica (para que se verifique uma oxigenação tecidual eficiente), uma taxa de Hb circulante no RN superior à doutro grupo etário.
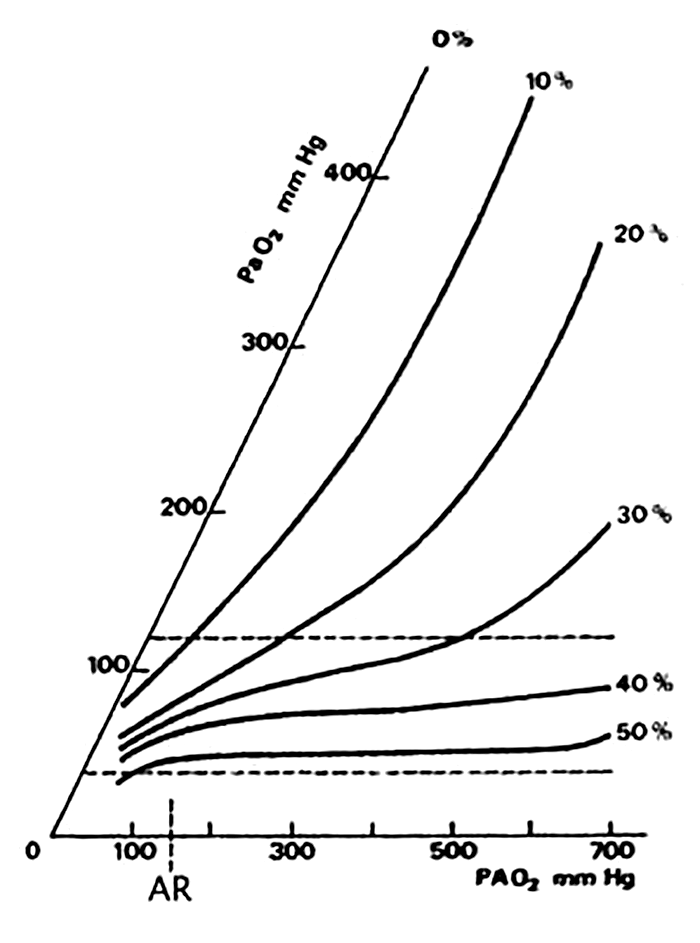
FIGURA 5. Evolução da PaO2 em função. 1) da PAO2 (pressão de O2 no ar alveolar); 2) da importância da mistura sangue venoso – sangue arterial (Shunt dto – esq.).
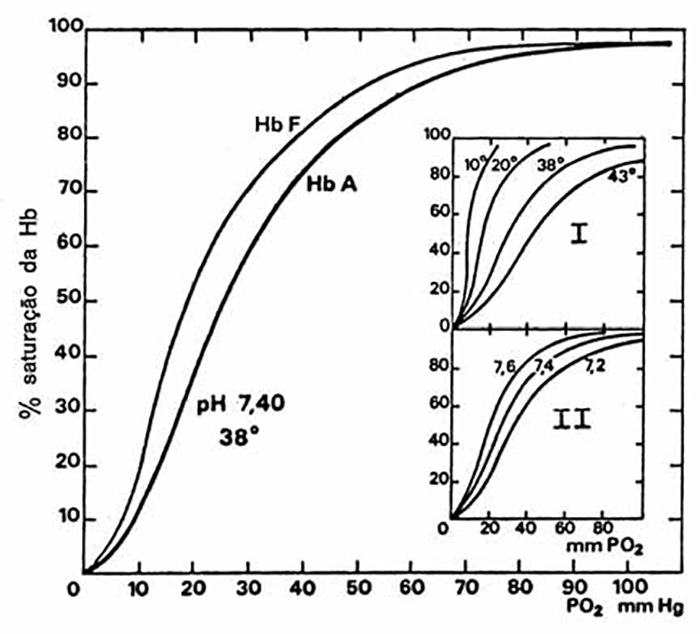
FIGURA 6. Curva de dissociação de HbO2.
Noções complementares em síntese
|
Etiopatogénese e classificação
Para além dum sistema repiratório intacto, para o início e manutenção da respiração normal, torna-se essencial a contribuição dum certo número de condições básicas descritas no capítulo sobre adaptação fetal à vida extrauterina.
Assim, tendo em conta os fenómenos da adaptação cardiorrespiratória fetal à vida extrauterina, e examinados os factores com influência no início e manutenção da função respiratória, será mais fácil compreender a classificação das SDR com base na etiopatogénese (Quadro 2); nesta perspectiva, são consideradas duas grandes causas: as de localização no sistema respiratório, e as de localização extra-sistema respiratório.
Como em toda e qualquer situação clínica, para o diagnóstico diferencial dos quadros clínicos de SDR, torna-se fundamental a realização de história clínica e de exames complementares em função dos dados colhidos e observados. Em termos de anamnese, por exemplo: a verificação de prematuridade aponta para SDR do tipo I; a verificação de líquido amniótico meconial aponta para síndroma de inalação amniótico-meconial; antecedentes de amnionite, ruptura prolongada de membranas e/ou de febre intraparto sugerem pneumonia, integrada ou não num quadro de infecção sistémica, etc..
QUADRO 2 – Classificação das síndromas de dificuldade respiratória (SDR) no RN.
Causa no sistema respiratório 1 – SDR tipo I (doença da membrana hialina) |
Causa extra-sistema respiratório 1 – SDR por anomalias cardiovasculares |
Actuação inicial
Para além de um conjunto de procedimentos prioritários, importa um exame físico rigoroso e exames complementares fundamentados:
- O RN deverá ser colocado em incubadora, em condições de assépsia e de termoneutralidade;
- Deverá promover-se a monitorização das frequência cardíaca e respiratória, da oxigenação, da pressão arterial e da temperatura;
- Deverá garantir-se o equilíbrio hidroelectrolítico e ácido-base;
- Deverá prevenir-se e detectar-se eventual infecção.
Estes objectivos conseguem-se através de vigilância ou monitorização clínica, biofísica, bioquímica e imagiológica em unidade de cuidados especiais ou em unidade de cuidados intensivos.
No âmbito dos exames complementares de imagem assumem particular importância, em primeiro lugar a radiografia do tórax e, em certos casos, a ecografia torácica.
O Quadro 3 proporciona dados imagiológicos torácicos importantes para a orientação diagnóstica.
QUADRO 3 – Tórax e sinais radiológicos.
| Imagem observada | Orientação diagnóstica |
Pulmão Denso Granitado difuso com ou sem broncograma “Miliar” de nódulos grosseiros assimétrica |
Doença da membrana hialina |
Pulmão Húmido Diminuição homogénea da transparência |
Perturbações da reabsorção do líquido alveolar/edema pulmonar |
Pulmão Arejado Hipertransparência acentuada dum campo pulmonar
|
Pneumotórax; Malformações |
Diafragma Cúpula abaixada |
Enfisema; Pneumotórax |
Mediastino Hipertransparência em torno da silhueta cardíaca
|
Pneumomediastino |
A ecografia torácica é de grande utilidade em situações compatíveis clinicamente com derrame pleural ou pericárdico, para avaliação da dinâmica do diafragma havendo suspeita de paralisias, e ainda, para avaliação do grau de recrutamento alveolar (de arejamento ou colapso).
Na perspectiva de detecção de insuficiência respiratória e de eventual repercussão multiorgânica – que poderão determinar a transferência do RN para UCIN – estão indicados determinados procedimentos:
- Oximetria de pulso para determinação da saturação em O2 (SpO2)
Na oximetria de pulso utiliza-se um foto-sensor cutâneo (oxímetro de pulso, de preferência com dois aparelhos: na mão direita e noutra extremidade) para determinar de modo contínuo a percentagem de saturação de Hb em oxigénio (SpO2) disponível para transporte do mesmo. Idealmente, a SpO2 no RN de termo deve ser ≥95% nas primeiras 7-12 horas pós-parto).
A SpO2 (que nos dá na prática clínica diária a monitorização cutânea contínua da oxigenação) é afectada pela curva de dissociação da oxi-hemoglobina. (ver atrás, Figura 6)
O método tem limitações, citando-se alguns exemplos: saturações de 88-93% correspondem a PaO2 entre 50 e 80 mmHg. Valores extremos, elevados ou baixos, têm fraca correlação com a PaO2 (exemplo: saturação de 98 ou 99% pode corresponder a PaO2 variando entre 95 e >200 mmHg).
Como vantagens citam-se: fácil de utilizar; não requer calibração manual; os valores determinados são pouco influenciados pela temperatura e perfusão da pele (ao contrário do que acontece com o monitor de pressão transcutânea de O2).
Com os referidos monitores (oxímetros) é possível proceder, também, à monitorização das frequências cardíaca, respiratória e da pressão arterial.
- Determinação inicial do pH e gases no sangue
- PaO2
Com a determinação da pressão arterial de O2 há possibilidade de regular a concentração de oxigénio necessária para manter os valores fisiológicos de 70-80 mmHg.
De notar que um valor inferior pode ser responsável por hipóxia celular com consequente acidose metabólica, e um valor exageradamente elevado pode ser tóxico para os vasos retinianos com possibilidade de sequelas no RN pré-termo, nomeadamente retinopatia, podendo originar cegueira. - PCO2
A determinação da pressão de CO2 permite apreciar o valor da ventilação alveolar. Os valores normais oscilam entre 35 e 45 mmHg.
Um aumento da pressão de CO2 (hipercápnia) pode ser sinal de obstrução, atelectasia, perturbação do mecanismo central da respiração, ou de patologia neuromuscular.
Uma hipocápnia, pelo contrário, pode constituir a tradução do fenómeno de compensação respiratória duma acidose metabólica e, também, eventualmente de perturbações do mecanismo central da respiração - pH
O valor normal deste parâmetro está compreendido entre 7,35 e 7,40. De notar também que uma acidose grave pode ter consequências deletérias: vasoconstrição dos capilares pulmonares e sequelas ao nível do S.N.C.
No RN pré-termo é actualmente considerada lícita a estratégia de hipercapnia permissiva: tolerar PCO2 mais elevadas (45-55 mmHg), tentando reduzir o tempo de suporte ventilatório ao RN. Neste contexto, valores de pH ≥7,22 nos primeiros cinco dias de vida do RN pré-termo com SDR, e de ≥7,20 nos dias seguintes, são amplamente aceites de acordo com as normas europeias de abordagem do SDR. - BE (“Excesso de base”)
Este parâmetro permite calcular a quantidade de iões básicos necessária para neutralizar uma perturbação de origem metabólica no espaço extracelular (no RN = ± 0,5 peso do corpo em kg). Num estado normal de equilíbrio, o BE = 0. Portanto, uma acidose metabólica corresponde a um BE negativo cujo valor se correlaciona com o número de mEq de bicarbonato necessário para a correção da acidose.
- PaO2
- Capnografia não invasiva
Método não disponível em todas as unidades neonatais, poderá ser útil na detecção de apneia, quer de tipo central, quer obstrutiva.
- Outros exames e índices de avaliação
- Salientando-se que nas situações de patologia respiratória poderá verificar-se compromisso multiorgânico, cabe referir que após concretização de procedimentos prioritários, e uma vez verificada a estabilização clínica hemodinâmica, poderão estar indicados determinados exames complementares tais como hemograma com plaquetas, hematócrito, grupo sanguíneo, PCR, glicémia, ionograma, estudo da coagulação, exames microbiológicos, hemocultura, exame sumário da urina, urocultura, etc..
- Na valorização do grau de insuficiência respiratória são classicamente usados os seguintes índices:
- não invasivos: SpO2/FiO2;
- invasivos:
- PaO2/FiO2;
- índice de oxigenação (PMA x FiO2/PaO2); e
- diferença alvéolo-arterial de oxigénio (A-a DO2= PAO2-PaO2).
| [PMA: pressão média na via aérea; PaO2: pressão parcial arterial de O2 pós-ductal; A-a DO2: diferença alvéolo-arterial de oxigénio; PAO2: pressão alveolar de O2]. Estes índices serão igualmente abordados adiante, no capítulo sobre “ventilação mecânica”. |
Cuidados básicos ao RN com problemas respiratórios
Em obediência aos princípios da actuação atrás sintetizados, os cuidados básicos ao RN com SDR (em unidades de cuidados intermédios ou em UCIN) deverão contemplar determinados critérios, abordados nesta alínea.
Balanço hidroelectrolítico
Torna-se fundamental proceder aos registos do peso diário assim como do suprimento de fluidos e electrólitos, do débito urinário (pós-algaliação ou colocação de saco colector), das perdas pelas fezes e das perdas insensíveis. Com efeito, a manutenção do balanço hidroelectrolítico dentro da normalidade é condição indispensável para garantir ventilação-perfusão normais e trocas gasosas eficazes.
Humidade e temperatura ambientais
O ambiente termo-neutro (a garantia do consumo mínimo de oxigénio) implica humidade relativa ~ou >50%. Por outro lado, uma humidificação dentro dos limites recomendados contribui para diminuir a perda de líquidos através da pele e, consequentemente, a perda de calor corporal. Situações que implicam entubação traqueal necessitam de humidade relativa >60%.
Nos RN de peso <1.000 gramas poderá haver necessidade de humidade relativa ~80-90% e manutenção de temperatura cutânea abdominal de 36,9ºC (nestes casos, com sensor aplicado na pele do abdómen, ligado a sistema automático de aquecimento servocontrolado).
Nos RN de peso entre 1.000-1.499 gramas, com tal sistema automático, deverá providenciar-se temperatura cutânea abdominal de 36,7ºC; se 1.500-1.999 gramas: 36,5ºC.
Recorda-se que a hipotermia (temperatura axilar <36,5ºC: ligeira- 36-36,4ºC; moderada- 32-35,9ºC; grave- <32ºC), originando vasoconstrição pulmonar, poderá levar a situação de hipoperfusão e hipertensão pulmonares, agravando o quadro respiratório. O Quadro 2 do capítulo sobre “prematuridade” especifica a temperatura ambiente recomendável para RN de diversos subgrupos de peso. Exceptua-se a situação de hipotermia induzida como estratégia neuroprotectora nos casos de encefalopatia hipóxico-isquémica, com indicação para a mesma.
Cuidados da pele
A integridade da pele é importante para manutenção do balanço hídrico e da temperatura corporal; por outro lado, a perda da integridade da mesma comporta igualmente risco de infecções sistémicas. Na prática clínica deverá evitar-se sempre que possível o uso de adesivos e outras práticas que contribuam para a lesão da pele, chamando-se a atenção para a necessidade de protecção daquela sobre proeminências ósseas, sobretudo no RN de prematuridade extrema (<1.000 gramas).
Posição do RN
A colocação de doentes com dificuldade respiratória em posição correcta é muito importante para garantir a melhoria da função respiratória e a eficácia dos restantes cuidados. A este propósito cabe salientar o seguinte:
- Estando o RN submetido a ventilação mecânica, mudanças de posição do corpo, não planeadas ou mal efectuadas, podem alterar a posição do TET (ver adiante);
- A posição em decúbito dorsal prolongada, leva a atelectasias segmentares posteriores;
- A colocação do RN em posição de decúbito lateral durante ventilação mecânica pode ajudar no que diz respeito a melhoria de áreas de atelectasia ou de enfisema intersticial;
- A posição em decúbito ventral tem sido referida como bastante vantajosa por melhorar a ventilação, permitindo a total expansão pulmonar e facilitando a drenagem de secreções (RN monitorizado).
Nota importante: esta posição está proscrita em RN saudáveis em berço convencional, para dormir. |
Manutenção da permeabilidade das vias aéreas
Determinadas medidas com o objectivo de manter a permeabilidade das vias aéreas (facilitando a oxigenação do sangue e permitindo a remoção do CO2) incluem:
- Aspiração suave de secreções, drenagem postural, vibração torácica e percussão suave, sobretudo em situações de atelectasia ou de pneumonia;
- A aspiração das vias aéreas, realizada por pessoal de enfermagem especializado, deverá ser reduzida ao mínimo, nomeadamente no RN pré-termo extremo; com efeito, aspirações excessivas, sem indicação clínica para tal, poderão conduzir a lesões traumáticas e, por vezes, a efeitos secundários graves como por ex. pneumotórax.
Após a descrição dos cuidados básicos, importa descrever de modo sucinto os cuidados especiais que, fundamentalmente, correspondem à assistência respiratória.
Assistência respiratória ao RN
Independentemente da etiologia e gravidade do problema respiratório neonatal, no conceito lato de assistência respiratória (ou suporte respiratório) incluem-se:
Métodos não invasivos
- A administração de suplemento de oxigénio (oxigenoterapia), em proporções variadas utilizando diversas técnicas e procedimentos adiante descritos, em função dos parâmetros clínicos e biológicos de cada caso;
- Suporte respiratório com pressão positiva/CPAP nasal.
Métodos invasivos
- Ventilação mecânica invasiva convencional implicando entubação traqueal e ventiladores sofisticados e incluindo a administração de gases inalados (tais como mistura oxigénio-hélio/heliox ou óxido nítrico/iNO);
- Ventilação de alta frequência oscilatória (VAFO);
- ECMO (oxigenação por membrana extracorporal).
De salientar que, com os progressos da ciência e tecnologia, a tendência actual é a utilização de métodos e estratégias cada vez menos invasivos.
A assistência respiratória ao RN deve ser progressiva e, idealmente, o menos invasiva possível, com base na etiologia do processo. Os processos em que predomina a diminuição da distensibilidade/compliance pulmonar, aumento do trabalho respiratório e perda do volume residual funcional beneficiarão se for incrementada a pressão na via aérea. Nos casos em que predomina o aumento da resistência da via aérea, haverá benefício se se aumentar o fluxo do gás. |
Neste capítulo faz-se referência à assistência respiratória por métodos não invasivos.
Modalidades de oxigenoterapia
A oxigenoterapia pode ser aplicada, quer nas situações em que se verifica respiração espontânea, quer em RN submetidos a ventilação artificial, segundo várias modalidades.
Nos casos de RN respirando espontaneamente, com SDR ligeira, evidenciando adequada ventilação-minuto, e sinais de hipoxémia ligeira (SpO2 <89%) poderá haver necessidade de providenciar apenas suplemento de O2 [variando a FiO2, e pressupondo que o dispositivo/fonte de O2 possua um misturador para regular a referida FiO2], no sentido de obter valores da SpO2 entre 90 e 95%.
Importa realçar contudo que a assistência respiratória poderá ser levada a cabo com ar ambiente, o qual contém proporção de 21% de O2 (por ex., já na sala de partos no contexto de reanimação neonatal). |
Portanto, o suplemento de oxigénio deve ser aquecido à temperatura do RN, e humidificado, podendo ser administrado segundo diversas modalidades.
Cânulas nasais com baixo fluxo de gás
Trata-se do método clássico de administração de oxigénio consistindo na aplicação de cânula nasal dupla/pronga (ou em alternativa, sonda única empregando sonda vulgar de calibre 8 FG introduzida numa das narinas até cerca de 3 cm).
Com esta modalidade deve utilizar-se um debitómetro de precisão permitindo débitos <1 L/minuto (por ex. 0,25 – 0,50 – 0,75 L/min, etc.). Determinando a concentração de oxigénio na hipofaringe (FhO2) com este método, é possível estabelecer a seguinte relação, respectivamente entre débito e FhO2:
0,25 L/min<>30%; 0,50 L/min<>45%; 0,75 L/min<>60%; 1 L/min<>65%
Nota importante: no RN pré-termo (<28 semanas) em que a camada da pele é extremamente delgada, pode verificar-se absorção transcutânea de oxigénio se o mesmo RN não estiver vestido (e se eventualmente o ambiente da incubadora proporcionar elevada concentração de FiO2); assim, poderá verificar-se incremento de PaO2 ~9 mmHg (~1,2 kPa) se a FiO2 do habitáculo for ~95%. |
Cânulas nasais com alto fluxo de gás
Actualmente, nos pacientes com respiração espontânea, verifica-se a tendência de utilização de uma modalidade de cânulas nasais para inalação de alto fluxo.
Trata-se dum método de assistência respiratória não invasiva permitindo administrar gás aquecido (34-37ºC) e humidificado (95-100%) a um fluxo constante; este fluxo constante é mais elevado que o fluxo inspiratório do paciente e do que o utilizado em cânulas nasais convencionais atrás citadas. O O2 com percentagem de ar misturado e regulável é o gás mais utilizado.
Tendo como referência os fluxos atrás descritos para as cânulas nasais convencionais, cabe salientar que a definição de alto fluxo ainda não é consensual; na prática corrente, considera-se aceitável considerar alto fluxo: – no RN pré-termo ou de termo à 1 L/min; – em lactentes à 2 L/min; – em crianças maiores à 6 L/min; – em adultos à até 60 L/min. Constitui prática corrente iniciar o procedimento com o fluxo ~2 L/kg/min. (Figuras 7 e 8)
O sistema de inalação de alto fluxo (ou alto débito) tem diversas vantagens, destacando-se as seguintes:
- O efeito de “lavagem” do espaço morto da nasofaringe; – o preenchimento de todo o espaço aéreo da nasofaringe com gás “limpo”, removendo o ar expirado ao ponto de o paciente inspirar novo gás oxigenado no ciclo seguinte;
- Eliminação de CO2 promovendo maior rendimento da oxigenação;
- Promoção do recrutamento alveolar gerando-se uma pressão de distensão alveolar contínua;
- Com a aplicação do sistema de alto fluxo contínuo poderá gerar-se, inavertidamente, pressão positiva contínua, isto é, efeito CPAP. (ver adiante)
Como indicações principais citam-se:
- Na fase pós-extubação traqueal;
- Pós-ventilação com CPAP;
- Como tratamento de SDR em RN pré-termo com idades gestacionais ~32-34 semanas ponderando outros aspectos da situação clínica na globalidade.
Pressão positiva contínua na via aérea
Nos RN com respiração espontânea pode administrar-se suplemento de O2 em fluxo contínuo empregando:
- dispositivo com a funcionalidade e tecnologia exclusivamente para CPAP;
ou - ventilador convencional que, para além da modalidade PIP associada a fluxo contínuo possui simultaneamente funcionalidade para pressão de distensão contínua.
- Ao conceito genérico de pressão positiva contínua/ pressão de distensão alveolar contínua, isto é, de maior expansão alveolar no fim da expiração (em comparação com os casos em condições fisiológicas naturais, de normalidade), dá-se o nome de CPAP (Continuous Positive Airway Pressure). Trata-se, pois, de aplicação de apoio respiratório, artificial, com fluxo contínuo do gás ao mesmo tempo que o paciente respira espontaneamente.
- Este conceito de maior expansão alveolar no fim da expiração, superior à verificada fisiologicamente no fim de cada expiração, sobrepõe-se ao de PEEP (Positive End Expiratory Pressure-pressão positiva), aplicável a pacientes que, não respirando espontaneamente, têm aplicado dispositivo/aparelho que promove simultaneamente pressão positiva intermitente (PIP ou PPI).
- À pressão de distensão contínua que se obtém quando é utilizda simultaneamente PIP (modalidade mista), dá-se o nome de PEEP. (por ex., diz-se: – o doente X, com respiração espontânea está em CPAP de 5 cm H2O; e – relativamente ao doente Y, ventilado simultaneamente com pressão positiva intermitente (por ex. PIP de 30 cm H2O) e com a mesma pressão de distensão contínua, diz-se: está com PIP de 30 cmH2O e PEEP de 5 cm H2O (e não, PIP de… e CPAP de…).
Na impossibilidade de dispor de ventilador com diversas funcionalidades ou de aparelhagem sofisticada exclusivamente para pressão positiva contínua (CPAP), pode utilizar-se um dispositivo simples em que a pressão positiva é gerada criando uma resistência ao fluxo gasoso.
O esquema básico que integra a Figura 9 pretende elucidar sobre os componentes de tal dispositivo aplicado à via aérea do RN com respiração espontânea.
Importa então considerar determinados aspectos do funcionamento, excluindo pormenores técnicos sobre calibres das tubagens e pressões obtidas em função dos fluxos de gás. As setas indicam o trajecto do gás (inalado ou exalado); um sistema valvular permite que o gás inalado e exalado circule repectivamente em tubagens diferentes. (ver caixa)
|
FIGURA 7. Esquema de administração de oxigenoterapia com FiO2 variável (alto ou baixo débito/fluxo) por cânulas nasais (prongas). (A, B, C, D, E, F)
A) Misturador Ar+O2; B) Sistema de aquecimento/leitura digital da temperatura e humidificação do gás; C) Tubagem, acompanhada por fios exteriores ligados a sensores e com aplicação de duas cânulas nasais em V ou em T; D) Sensor de oxímetro de pulso aplicado no pulso direito (pré-ductal); E) Oxímetro de pulso com indicação digital de saturação em O2 /SpO2 ; F) Formato variável das prongas nasais (em V ou em T).
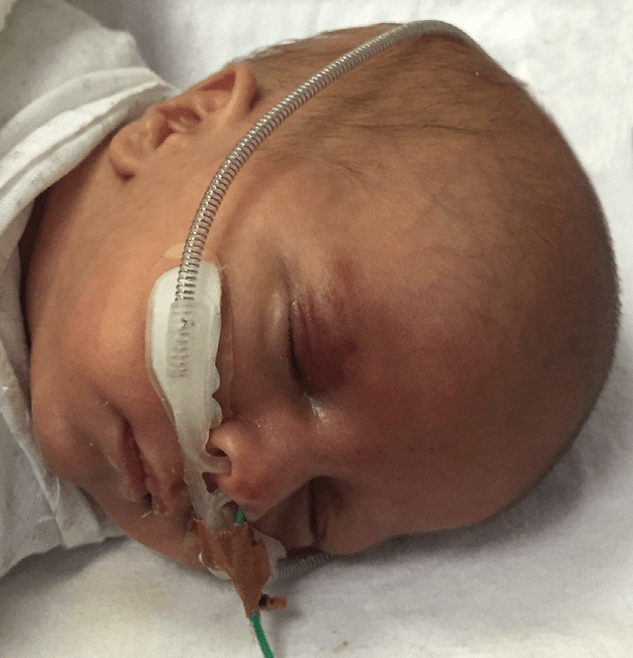
FIGURA 8. RN submetido a oxigenoterapia com aplicação de pronga nasal em dois T. É visível sonda gástrica de cor verde para evitar distensão gasosa referida adiante, a propósito do sistema CPAP.
FIGURA 9. ESQUEMA BÁSICO DO SISTEMA DE PRESSÂO POSITIVA CONTÍNUA NA VIA AÉREA
(1)- Misturador O2+ar, regulável; (2)- Sistema de aquecimento e humidificação do gás; (3)-Paciente respirando espontaneamente, com pronga nasal aplicada; esta deriva da tubagem – ramo inspiratório (A); no paciente, as setas nos dois sentidos representam inspiração/expiração; (B)- Ramo expiratório da tubagem, veiculando gás exalado pelo paciente, ligada a tubo mergulhado em (4)- Recipiente com água: a exalação provoca “bolhas” em número e intensidade proporcional ao valor do débito do gás inalado; (5)- Tubo derivando do ramo expiratório submerso noutro recipiente com água; o comprimento em cm da parte submersa corresponde ao valor da pressão positiva que é gerada no fim da expiração “em cm de H2O”.
FIGURA 10. Oxigenoterapia em campânula.
A Figura 9 representa em esquema os componentes básicos do sistema de CPAP referido (chamado sistema subaquático ou “de bolhas”), excluindo referência a sistemas valvulares e a calibres dos vários tubos).
A distensão gástrica pode ser um efeito secundário da CPAP nasal; contudo, esta técnica não contraindica a alimentação por via entérica. Para prevenir tal efeito deve aplicar-se sonda orogástrica nos RN submetidos a CPAP nasal.
Outras modalidades (clássicas)
Como alternativa às cânulas nasais e prongas nasais, alguns centros utilizam diversas modalidades de “máscaras” faciais obrigando ao cumprimento das regras quanto a débitos a utilizar em função das dimensões e das diversas marcas do mercado.
Por fim, e por razões históricas, importa citar modalidades menos utililizadas actualmente (não totalmente obsoletas), podendo servir como recurso (consultar anterior edição desta obra):
Campânula Incubadora |
Monitorização em UCIN
Recorda-se, a propósito, que as UCIN são unidades assistenciais com equipamento sofisticado integrando equipas fixas de enfermeiros e de pediatras-neonatologistas com formação especializada em intensivismo neonatal, e agregando a si outros especialistas que dominam certas técnicas, como cirurgiões neonatais, gastrenterologistas, cardiologistas, pneumo-broncologistas, etc. O conceito de assistência de tipo intensivo implica a disponibilidade de equipas próprias em permanência, 24 horas por dia, 7 dias por semana, 365 dias por ano.
Para a vigilância e terapia intensivas torna-se necessário proceder a técnicas invasivas como cateterismo arterial e venoso. Pelas condições indispensáveis de ambiente em assépsia rigorosa é possível a realização de intervenções cirúrgicas em áreas reservadas e isoladas da UCIN, como laqueação do canal arterial no RN pré-termo e correcção cirúrgica de hérnia diafragmática de Bochdalek.
Do equipamento sofisticado fazem parte, nomeadamente, incubadoras “abertas” e fechadas (clássicas) com mecanismo de regulação de temperatura automática (servocontrolada), monitores electrónicos e ventiladores, aparelhos de fototerapia, etc..
De facto, os problemas respiratórios neonatais tipificam perfeitamente o paradigma do internamento em UCIN, designadamente pelas repercussões multissistémicas da disfunção respiratória. Salienta-se – pelo que foi dito – que a necessidade de ventilação mecânica não constitui a única indicação de internamento na mesma.
Assim, é oportuno discriminar os critérios clássicos utilizados para transferência de RN para UCIN ou Unidade de Cuidados Especiais (com ou sem problemas respiratórios):
- RN pré-termo de peso inferior a 1.500 gramas;
- A verificação de necessidade de assistência ventilatória em função dos dados colhidos pelo exame clínico, dos resultados da determinação de pH e gases no sangue (gasometria);
- Problemas hemodinâmicos tais como choque de etiologia diversa (designadamente infecciosa), hipertensão arterial, hipotensão e hipoperfusão, defeitos cardíacos e insuficiência cardíaca, etc.;
- Problemas hematológicos (diátese hemorrágica grave, CID, etc.);
- Problemas neurológicos com repercussão multissistémica (status epilepticus, doenças neuromusculares, etc.);
- Problemas metabólicos, alterações do equilíbrio hidroelectrolítico e ácido-base;
- Infecções sistémicas;
- Alterações da termo-regulação;
- Patologia dita cirúrgica major implicando vigilância pré- e pós-operatória.
Nesta perspectiva, são descritas sucintamente as modalidades mais correntes de monitorização do RN realizada em UCIN.
Monitorização não invasiva
- O tópico sobre “admissão na UCIN” da alínea sobre “cuidados ao RN pré-termo” tipifica de modo sucinto os diversos tipos de aparelhos para monitorização básica: de frequência cardíaca e respiratória (implicando aplicação de eléctrodos sobre a pele, com possibilidade de obtenção de traçados de registo digital), de temperatura cutânea e de ambiente, de pressão arterial por método doppler tipo Dinamap e de oximetria de ambiente (para determinação da FiO2).
- Para além do oxímetro de pulso já referido e utilizado também em UCIN, cabe referir ainda os monitores para determinação da pressão transcutânea de O2 e de CO2. Com o aparecimento do oxímetro de pulso, o monitor transcutâneo de oxigénio (Ptc O2) – com eléctrodo aplicado sobre a pele, produzindo determinada temperatura indispensável para vasodilatação da pele, passou a ser menos utilizado.
- A monitorização da Ptc CO2 é extremamente importante na prática clínica uma vez que permite determinar de modo contínuo tal parâmetro, com grande aproximação ao valor da pressão arterial de CO2 (PaCO2).
Existem, no entanto, algumas limitações relacionadas com o funcionamento dos dois últimos monitores: 1) necessidade de recalibração diária; 2) necessidade de recolocação em diferentes zonas da pele após cada 4 a 6 horas (ou de 2 em 2 horas nos RN mais imaturos) face à irritação da pele (eritema ou queimadura superficial causada pela temperatura exigida para a eficácia do funcionamento do eléctrodo; 3) resultados difíceis de interpretar em situações clínicas acompanhadas de má perfusão cutânea, em que a sua utilização é pouco eficaz.
- A monitorização do CO2 expirado por aplicação do respetivo sensor junto à conexão do TET (capnografia) é um meio prático e fiável de avaliação da evolução do CO2 permitindo a leitura da curva de registo da mesma uma deteção precoce de alterações tendentes à retenção ou à depuração exagerada de CO2 em doentes sob suporte ventilatório mecânico convencional.
- A avaliação ecocardiográfica é muito importante pelos achados obtidos, nomeadamente em termos de status cardíaco (por ex. grau de preenchimento das cavidades cardíacas), de resistências pulmonares e periféricas, e de shunt intrapulmonar.
Monitorização invasiva
- A gasometria arterial (determinação do pH e gases no sangue arterial) constitui a avaliação mais padronizada e aceite do status respiratório. Requer punção arterial (por ex. da artéria radial ou temporal direitas, pré-ductais) ou a manutenção de uma linha arterial contínua.
Na prática corrente, estando o RN internado em UCIN, no período neonatal precoce obtém-se sangue arterial da artéria umbilical uma vez que em praticamente todos os RN com SDR é colocado um cateter arterial umbilical, viabilizando uma linha de monitorização arterial contínua, permitindo monitorização dos referidos parâmetros. Em geral procede-se a colheitas de sangue arterial periodicamente em função da clínica com seringa aplicada a sistema de torneira com três ou mais vias segundo técnica que ultrapassa os objectivos do livro; outra alternativa é a determinação contínua com monitor electrónico que incorpora sensor em contacto com o sangue arterial, o que implica o emprego de cateteres especiais.
- A pressão arterial por método directo (hoje menos vulgarizada dado o desenvolvimento de métodos não invasivos) também pode ser realizada através do cateter arterial especial com equipamento ligado a monitor-transdutor.
- A gasometria venosa não tem valor quanto à determinação da pressão de O2, sem qualquer correlação com a PaO2. O pH é ligeiramente mais baixo e a pressão de CO2 (venosa, não arterial) é ligeiramente mais elevada.
- A gasometria capilar obtida através de colheita de sangue capilar (arterializado) – em geral obtido por punção na região calcaneana – proporciona informação útil; as limitações são semelhantes às da punção venosa.
- A pressão venosa central (PVC) pode ser monitorizada pelo cateter venoso umbilical com extremidade atingindo a aurícula direita. No RN valores da ordem de 4-8 cm H2O, são geralmente aceites como normais. No entanto, actualmente alguns dados indirectos relativamente à pré-carga e pós-carga podem ser obtidos de modo não invasivo através da ecografia com doppler.
Nota importante: tal como foi referido a propósito dos exames iniciais, na UCIN o RN com SDR necessita de avaliação seriada, devendo os exames a realizar – os já citados e outros, implicando colheitas de sangue – ser programados com vista a reduzir ao mínimo as expoliações e o número de punções, dados os riscos inerentes. |
Indicações da ventilação mecânica*
Habitualmente, nos pacientes que não estão em respiração espontânea, são estabelecidos dois tipos de critérios (clínicos e biológicos) para início de ventilação mecânica implicando, em princípio, entubação traqueal e internamento em UCIN:
Clínicos
- Índice de Silverman >7 sem melhoria na sequência de período anterior de assistência respiratória, designadamente na modalidade de pressão de distensão contínua por via nasal aplicada a RN em respiração espontânea (CPAP nasal/ nCPAP, isto é, sistema de fluxo contínuo de mistura de ar/O2, gerando pressão positiva no fim da expiração, e garantindo menor esvaziamento e maior distensão alveolares do que em situação normal);
- Apneia recorrente: dois ou mais episódios/hora com necessidade de ventilação manual para reversão e/ou ausência de resposta ao tratamento com xantinas;
- Doenças do foro neurológico e neuromuscular, congénitas ou adquiridas, implicando ausência de movimentos respiratórios ou movimentos respiratórios irregulares ou de fraca amplitude;
- Doenças sistémicas diversas, idem;
- RN submetidos a tratamento com fármacos interferindo no automatismo e dinâmica respiratórios.
*As noções básicas de assistência respiratória por métodos invasivos são abordadas em capítulo próprio adiante. |
Resultados da determinação de pH e gases no sangue (gasometria)
- PaO2 <50 mm Hg (6,7 kPa) ou SpO2 <88% com FiO2 >60% (se ≤32 semanas de gestação) [ou com FiO2 >80%(se >32 semanas)]
- PaCO2 >60 mmHg (8,0 kPa): associada a pH <7,20 se idade gestacional >32 semanas;
- PaCO2 >50 mmHg (6,7 kPa) associada a pH <7,25 se idade gestacional ≤32 semanas;
- Acidose metabólica grave (pH <7,20) na ausência de resposta a alcalinizantes (bicarbonato de sódio, por ex.) e/ou a expansores de volume.
Nota importante: |
No RN pré-termo, após ventilação não invasiva, não existem critérios universalmente aceites para ventilação mecânica; contudo, segundo a comprovação científica actual, é amplamente aceite a necessidade de suporte ventilatório invasivo se, após se ter tentado rendibilizar o suporte não invasivo, persistirem as seguintes condições:
- Dificuldade respiratória importante (tiragem, gemido expiratório, polipneia);
- Hipercapnia (Ph <7.22 com PCO2 ≥65 mmHg);
- Apneia recorrente (>2/hora) nas 6 horas prévias;
- Apneia major ou bradicardia necessitando de ressuscitação empregando ventilação com pressão positiva.
BIBLIOGRAFIA
Bancalari E, Poland RA (eds). The Newborn Lung: Neonatology Questions and Controversies. Philadelphia: Elsevier Saunders, 2012
Bhayat S, Shetty S. Less-invasive surfactant administration (LISA). Paediatrics Child Health 2020; 30: 144-148
Ekhaguere O, Patel S, Kirpalani H. Nasal intermittent mandatory ventilation versus nasal continuous positive airway pressure before and after invasive ventilatory support. Clin Perinatol 2019; 46: 517 -536
Guimarães JC, Tuna ML, Loio P, et al. Manual Prático de Ventilação Neonatal. Lisboa: Hospital de S. Francisco Xavier/Uriage, 2016
Hodgson KA, Manley BJ, Davis PG. Is nasal high flow inferior to continuous positive airway pressure for neonates? Clin Perinatol 2019; 537-552
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Lee Jr M, Nagler J. High flow nasal cannula therapy beyond the perinatal period. Curr Opin Pediatr 2017; 29: 291-296
Lee M-J, Choi EK, Park KH, et al. Effectiveness of nCPAP for moderate preterm infants compared to BiPAP: a randomized, controlled non-inferiority trial. Pediatr Int 2020; 62: 59-64. doi: 10.1111/ped.14061
Lista G, Castoldi F, Fontana P, et al. Nasal continuous positive airway pressure (CPAP) versus bi-level nasal CPAP in preterm babies with respiratory distress syndrome: a randomised control trial. Arch Dis Child Fetal Neonatal Ed Pract 2010; 95: F85-89
Manley BJ. Nasal high flow therapy for preterm infants. Review of neonatal trial data. Clin Perinatol 2016; 43: 673-691
Manley BJ, Arnold GRB,Wright IMR, et al. Nasal high-flow therapy for newborn infants in special care nurseries. NEJM 2019; 380: 2031-2040
Manley BJ, Roberts CT, Frøisland DH, et al. Use of nasal high-flow therapy as primary respiratory support for preterm infants. J Pediatr 2018; 195: 65-70
McCollum ED, Mvalo T, Eckerle M, et al. Bubble continuous positive airway pressure for children with high-risk conditions and severe pneumonia in Malawi: an open label randomised controlled trial. Lancet Respir Med 2019; 7: 964-974
McVea S, McGowan M, Rao B. How to use saturation monitoring in newborns.
Arch Dis Child Edu & Pract 2019; 104: 35-42
Montan S, Arul-Kumaran S. Neonatal respiratory distress syndrome. Lancet 2006; 367: 1878-1879
Nona J, et al. Sociedade Portuguesa de Neonatologia. Consenso nacional sobre ventilação não invasiva. Grupo de Consensos em Neonatologia. Lisboa: SPP/ed, 2014
Ochiai M, Kurata H, Inoue H, et al. Transcutaneous blood gas monitoring among neonatal intensive care units in Japan. Pediatr Int 2020; 62: 169–174 doi: 10.1111/ped.14107
Oda A, Parikka V, Lehtonen L, et al. Nasal high-flow therapy decreased electrical activity of the diaphragm in preterm infants during the weaning phase. Acta Paediatrica 2019; 108: 253-257
Park RS, Peyton JM, Kovatsis PG. Neonatal airway management. Clin Perinatol 2020; 47: 745-764
Poets C F, Franz AR. Automated FiO2 control: nice to have, or an essential addition to neonatal intensive care? Arch Dis Child Fetal Neonatal Ed 2017; 102: F5-F6
Poets CF. Noninvasive monitoring and assessment of oxygenation in infants. Clin Perinatol 2019; 46: 417-434
Polin R, Yoder MC. Work Book in Practical Neonatology. Philadelphia: Elsevier, 2016
Setty SG, Batra M, Hedstrom AB. The Silverman Andersen respiratory severity score can be simplified and still predicts increased neonatal respiratory support. Acta Paediatrica 2020; 109: 1273-1275. DOI: 10.1111/apa.15142
Stein Y, Dietz RM. Nasal high‐flow therapy for newborn infants in special care nurseries. NEJM 2019; 380: 2031-2040
Sweet DG, Carnielli V, Greisen G, et al. European consensus guidelines on the managment of neonatal respiratory distress syndrome in preterm infants – 2013 Update. Neonatology 2013; 103: 353-368
Tarnow-Mordi W, Kirby A. Current recommendations and practice of oxygen therapy in preterm infants. Clin Perinatol 2019; 46: 621-631
Travers CP, Carlo WA. New methods for noninvasive oxygen administration. Clin Perinatol 2019; 46: 449-458
Warren JB, Anderson JDM. Newborn respiratory disorders. Pediatr Rev 2010; 31: 487-496
Yu VYH (ed). Pulmonary Problems in the Perinatal Period and their Sequelae. London: Baillière Tindall, 2004