Importância do problema e aspectos epidemiológicos
A ocorrência de diabetes mellitus (DM) durante a gravidez, nas suas diversas formas – diabetes pré-gestacional (DPG) tipos 1 e 2 e diabetes gestacional (DG) – pode condicionar distúrbios de índole diversa no feto e no recém-nascido, em dependência directa do controlo glicémico das grávidas, e com repercussões a médio e a longo prazo.
Anteriormente, a DPG era predominantemente do tipo 1, insulinodependente. Nos últimos anos, em especial nos países industrializados, 1/3 de todas as DPG são do tipo 2 frequente e erradamente interpretadas como gestacionais, ainda que detectadas no 1º trimestre de gravidez.
A prevalência e a incidência da DPG variam consideravelmente dependendo de factores étnicos e raciais e de fenómenos migrantes. Com o incremento relativo da diabetes tipo 2, o diagnóstico está de certo modo condicionado pelo rastreio em função de critérios de saúde pública para populações de risco.
Na generalidade, considerando embora as assimetrias populacionais, calcula-se que cerca de 1,1% são DPG. A incidência de DG, talvez até mais do que a DPG, depende, entre outros factores, da existência ou não de rastreios universais e sistemáticos durante a gravidez, da data do aparecimento e da metodologia do diagnóstico. Em geral, estima-se que entre 3%-7% de gravidezes são complicadas por DG.
Na experiência dos autores, num período de 2 anos, numa população não seleccionada de 5207 grávidas, a incidência de DG foi de 6,4%, atingindo 14,9% nas mulheres com antecedentes obstétricos de DG. Dois terços (66%) das mulheres com DG tinham uma história familiar de DM tipo 2, e 20% tinham obesidade pré-concepcional (IMC > 30%), versus 4% na população de controlo.
A idade média na data do parto foi de 32 anos, comparativamente aos 30 anos para uma população de controlo de mulheres com filhos grandes para a idade gestacional (GIG) não-diabéticas. Cerca de um terço (31,3%) das mulheres com DG necessitaram de insulinoterapia, nomeadamente nos casos com história familiar de diabetes, obesidade pré-concepcional e com DG em gravidezes prévias (33,4%, 45,8% e 36,2% respectivamente).
Reconhecendo a importância deste enorme problema de Saúde Pública, já em 1989 a Organização Mundial de Saúde (OMS) e a Federação Internacional de Diabetes (FID) propuseram, na Declaração de St. Vincent, o objectivo, a concretizar em 5 anos, de os resultados de uma gestação complicada de diabetes deverem aproximar-se dos da grávida não diabética. No entanto, e apesar de em centros de referência se ter observado uma redução significativa no número de abortamentos, de nados-mortos, de anomalias congénitas e de mortes no período neonatal relacionados com a diabetes na gravidez, a situação persiste.
Com efeito, mesmo nos países de desenvolvimento socioeconómico mais privilegiado, a incidência de abortamentos pode atingir 17%, a taxa de nados-mortos chega a ser 5 vezes superior, a de anomalias congénitas 4 a 10 vezes maior; a mortalidade perinatal atinge valores 5 vezes superior, a mortalidade neonatal até 15 vezes mais; relativamente à taxa de mortalidade infantil, esta poderá triplicar em relação à das gestações sem diabetes. De destacar que, com a possível excepção de maior incidência de defeitos congénitos nas DPG, todos estes maus resultados são também observados na DG.
Tendo em conta as assimetrias relacionadas com a assistência dispensada à grávida, importa reconhecer a etiopatogénese da embriofetopatia diabética e identificar os aspectos passíveis de intervenção, por forma a que os objectivos preconizados pela Declaração de St. Vincent não sejam apenas uma manifestação de intenções não concretizadas, passados mais de 25 anos.
ETIOPATOGÉNESE
A patogénese e todo o espectro da embriofetopatia diabética resultam fundamentalmente do excesso de glicose transferido da mãe para o feto, induzindo à hiperglicemia fetal – responsável primário pelas anomalias congénitas – e à consequente hipertrofia dos ilhéus pancreáticos e hiperplasia das células-β, de acordo com o diagrama representado na Figura 1.
O resultante hiperinsulinismo fetal crónico, integrando uma cascata de alterações metabólicas, é responsável pelo quadro clínico da embriofetopatia diabética, de consequências imediatas no período neonatal, podendo predispor à síndroma metabólica do adulto.
A desregulação do metabolismo glucídico materno justifica, neste modelo teórico, todo o início e manutenção da cascata da embriofetopatia diabética. No entanto, é possível que outros substratos metabólicos, para além da glicose materna, atravessem a barreira placentar contribuindo para alterações do meio fetal; as respectivas consequências dependem, não só do metabólito em si, mas dos estádios críticos do desenvolvimento em que tais alterações ocorram.
Esta hipótese é corroborada:
- Por modelos experimentais subscrevendo o contributo de outros substratos, nomeadamente corpos cetónicos e produtos da peroxidação lipídica na patogénese das anomalias congénitas e;
- Pela verificação em animais de laboratório de que a suplementação de determinados factores, em especial ácido araquidónico e mioinositol, “depuradores” de radicais livres de oxigénio e antioxidantes, reduz a taxa de defeitos congénitos em filhos de diabéticas. A utilidade de tais medidas e a sua aplicação na prática clínica constituem questões em aberto.
FIGURA 1. A embriofetopatia: aspetos da embriopatogénese.
Manifestações clínicas, interpretação fisiopatológica e actuação prática
Diabetes pré-gestacional (DPG)
As potenciais e múltiplas complicações evidenciam-se in utero: abortamento, morte fetal, anomalia congénita, restrição do crescimento fetal/intrauterino (RCIU) e macrossomia. O hiperinsulinismo fetal crónico, com o resultante aumento do metabolismo e consumo de oxigénio, levando à hipoxémia, para além da taxa aumentada de mortes fetais e prematuridade, constitui mais outro factor para a asfixia neonatal, frequentemente observada nos RN de mães diabética.
Embora a maioria destas complicações se relacione com o mau controlo metabólico da grávida, outras, no entanto, ocorrem mesmo em casos de diabetes bem controladas, pondo em causa metodologias e definições, intervenções e seu cumprimento e, provavelmente, outros substratos, que não apenas a glicose. Com toda esta constelação de problemas e complicações não é surpreendente que o recém-nascido de mãe diabética (RNMD) constitua uma população sujeita a taxas de internamento superiores às da população em geral.
Anomalias congénitas
Ao longo das últimas décadas tem sido postulado que, para além dos hidratos de carbono (glucose, galactose e manose) outros substractos metabólicos estariam igualmente envolvidos na etiopatogénese das malformações congénitas, desde que presentes em níveis elevados durante períodos críticos do desenvolvimento. Entre os possíveis metabólitos implicados salientam-se os corpos cetónicos em excesso, a deficiência de zinco, ácido araquidónico e mioinositol e alterações da peroxidação lipídica com produção de radicais oxigenados livres. (Figura 2)
Apesar de terem sido descritas inúmeras anomalias congénitas afectando diversos órgãos e sistemas na DPG, tanto do tipo 1 como do tipo 2, a associação é mais frequente para algumas anomalias, nomeadamente do pavilhão auricular e do foro óculo-aurículo-vertebral. Síndromas de regressão caudal são também mais frequentes, em particular a agenesia do sacro (risco 200-600 vezes superior ao da população controlo), defeitos do tubo neural e defeitos vários do SNC (desde anencefalia – risco 3 vezes maior, holoprosencefalia – risco 40-400 vezes mais elevado).
Considerando as cardiopatias, ocorrem com maior frequência defeitos do septo auricular e ventricular, transposição dos grandes vasos e persistência do canal arterial (4 a 6 vezes mais frequente). A nível nefro-urológico, anomalias como agenesia renal e duplicação ureteral têm igualmente prevalência aumentada na gravidez acompanhada de diabetes. Importa referir que a generalidade destas anomalias surge na diabetes com mau controlo metabólico durante a gravidez, com cuidados pré-concepcionais sofríveis ou nulos, em aparente correlação directa com os níveis de HbA1C, sendo a incidência de defeitos semelhante à da população de controlo nas grávidas com HbA1C < 6,9% desde que mantidos, pelo menos, durante 6-12 meses pré-concepção. Contudo, e apesar de um bom controlo metabólico (cuidados pré-concepcionais e valores adequados de HbA1C), a taxa corrigida de anomalias relacionadas com a DPG é superior à da restante população. Será pertinente questionar se os métodos utilizados para definir um “bom controlo metabólico” serão os mais adequados ou não, sendo a hiperglicemia o único agente teratogénico, qual o contributo que, isoladamente ou como adjuvante, os outros substratos possam ter na patogénese da embriofetopatia diabética. A detecção de anomalias congénitas deverá iniciar-se no primeiro trimestre por ecografia transabdominal e transvaginal, e repetida no segundo trimestre. No período pós-natal, os exame subsidiários a realizar deverão estar de acordo com os achados clínicos.
Macrossomia
Da mesma forma que para as anomalias congénitas, outros agentes teratogénicos metabólicos se propõem, que não apenas os açúcares; com efeito, a macrossomia parece resultar também de fenómenos multifactoriais interdependentes, entre eles corpos cetónicos, ácidos gordos livres, aminoácidos selectivos, e possivelmente IGF-1 e -2 a nível periférico. Os anticorpos insulínicos maternos e as hormonas contrarreguladoras da insulina são outros contributos suspeitos na etiopatogénese. A frequência da macrossomia varia entre 17%-50% nos RN de mães com DPG, consoante as séries. Contudo, importa diferenciar dois conceitos: RN grande para a idade gestacional (GIG) e macrossómicos. De facto, apesar de partilharem aspectos comuns, os verdadeiros macrossómicos evidenciam algumas particularidades decorrentes de uma distribuição anormal da sua gordura corporal, nomeadamente a nível da cintura escapulo-umeral. A questão não é meramente académica e assume, desde logo, importância prática para o obstetra, em termos de diagnóstico pré-natal e quanto à via do parto. Para o neonatologista a distinção é também importante porque apesar de ambos, GIG e macrossómicos, apresentarem uma tendência superior para hipoglicémia, policitémia, hipocalcémia e hiperbilirrubinémia; os verdadeiros macrossómicos têm ainda um risco acrescido de asfixia intraparto, de tocotraumatismo, em especial de paralisia do plexo braquial, e de cardiomiopatia. Para definir e identificar macrossomia, em vez da habitual referência a um determinado e arbitrário peso, ou à relação entre o peso de nascimento (PN) e a idade gestacional, outros parâmetros têm sido propostos, nomeadamente, razão perímetro braquial/cefálico, perímetro da coxa/cefálico, peso/perímetro cefálico, espessura de pregas cutâneas, etc., de discutível aplicação prática. Em recém-nascidos de termo, segundo a experiência dos autores, é preferível utilizar o índice ponderal (IP=peso/comprimento3 x 100) para distinguir o verdadeiro macrossómico de um GIG, por ser de maior exequibilidade na prática clínica diária. Este ponto é importante, designadamente pelas implicações quanto ao prognóstico a longo prazo.
FIGURA 2. Etiopatogénese das anomalias congénitas
Hipoglicémia
No período neonatal a hipoglicémia é um problema comum e multifactorial, devido ao hiperinsulinismo mantido e à ausência de respostas hormonais de contrarregulação conduzindo à diminuição da gluconeogénese hepática, da lipólise e a um aumento da captação periférica de glicose. Contudo, o termo hipoglicémia carece de uniformidade de critério quanto à definição. Desde logo, ao estabelecer-se um valor de glicose abaixo do qual se considera existir hipoglicémia, é fundamental referir em que produto biológico a determinação foi efetuada: sangue venoso, sangue capilar ou plasma, dado que a concentração de glicose no sangue total é cerca de 10% a 15% inferior à do plasma. Atendendo ao valor geralmente elevado do hematócrito dos RNMD, o valor a ter em conta deverá ser o plasmático e não o sérico: a determinação em sangue total é afectada pelo hematócrito (valores de glicémia sucessivamente decrescentes no sangue arterial-capilar-venoso). Porém, outras questões se colocam: que ”baixo nível de glicose” se deve considerar nocivo? Será que para o mesmo valor de hipoglicémia a repercussão a nível cerebral será diferente consoante a presença ou não de sintomatologia? Será que o RN poderá utilizar outros substractos em alternativa à glicose, nomeadamente lactato, piruvato, corpos cetónicos, etc., para o seu metabolismo cerebral? Ainda que o RN no pós-parto imediato possa utilizar lactato como substracto energético, o hiperinsulinismo mantido, inibindo a lipólise, indisponibiliza a utilização de corpos cetónicos; assim, será prudente manter a glicémia em níveis ≥ 2,6 mmol/L (~ 48 mg/dL), quaisquer que sejam as idades gestacional e pós-natal do RN. Na prática (Figura 3), importa promover a alimentação entérica precoce e, caso ela não seja exequível ou contraindicada, administrar glicose por via endovenosa (ev) ao débito de 5-6 mg/kg/min, a ajustar de acordo com as necessidades, frequentemente até ritmos de 8-10 mg/kg/min e, raramente, de 12 mg/kg/min.
FIGURA 3. Actuação perante hipoglicémia.
Perante hipoglicémia sintomática, em particular de neuroglicopénia, deve providenciar-se a administração de glicose em bólus ev na dose de 0,25-0,5 g/kg, seguida de perfusão ao ritmo necessário à manutenção da euglicémia. Deve ser iniciada a alimentação entérica com leite materno ou com fórmula logo que possível, com redução gradual da perfusão venosa por forma a evitar a ocorrência de hipoglicémia reactiva. Raramente, em emergências ou com hipoglicémias refractárias, será necessário a administração de glucagon (200-300 µg/kg) para fomentar a gluconeogénese e promover a oxidação hepática de ácidos gordos.
Hipocalcémia
A homeostasia do cálcio é conseguida através de um equilíbrio entre a sua absorção intestinal e a sua excreção renal, num processo hormonodependente. A paratormona (PTH) mobiliza o ião a partir do tecido ósseo, aumenta a sua reabsorção tubular renal e estimula a produção de 1,25-di-hidroxivitamina D. Esta, por sua vez, aumenta a absorção intestinal de cálcio e fosfato e facilita a sua mobilização óssea induzida pela paratormona. Além disso, a hipocalcémia constitui um estímulo para a libertação de paratormona.
No sangue, o cálcio circula sob duas formas: ligado a proteínas séricas (especialmente à albumina) e a iões (por ex. citrato), e sob a forma livre ou ionizada, esta última a forma fisiologicamente relevante, representando 40%-50% do cálcio total. O equilíbrio entre a deposição e a mobilização do cálcio no osso determina, em grande parte, a concentração de cálcio ionizado no sangue. Durante a gestação, o cálcio é transferido da circulação materna para a circulação fetal através de um gradiente de transporte activo transplacentar regulado pelo péptido relacionado com a paratormona (PTHrP) (parathyroid hormone-related peptide).
A paratormona e a vitamina D maternas praticamente não atravessam a placenta. Desta forma, a concentração plasmática fetal de cálcio é mantida num nível superior ao da mãe (particularmente no terceiro trimestre, quando a concentração de cálcio total no RN é de cerca de 10-11mg/dL e a do cálcio ionizado de 6 mg/dL), encontrando-se as glândulas paratiroideias fetais num estado de baixa actividade. Com o nascimento, ocorre uma suspensão súbita da transferência materno-fetal de cálcio, com subsequente diminuição da sua concentração plasmática para níveis de 8-9 mg/dL de cálcio total e de 4,4-5,4 mg/dL da forma ionizada, evidente pelas 24 horas de vida. Em resposta, ocorre uma estimulação das glândulas paratiroideias e, pela segunda semana de vida, os níveis séricos do ião atingem o nível considerado normal para crianças e adultos. A definição de hipocalcémia, em função do peso, considera cálcio total < 8 mg/dL e/ou ionizado < 4,4 mg/dL (RN ≥ 1500 g); e cálcio total < 7 mg/dL e/ou ionizado < 4,0 mg/dL (RN < 1500 g). Salienta-se que a calcémia total está dependente dos níveis séricos de albumina e do pH, sendo que, por cada variação de 1 g/dL da albuminémia, há variação no mesmo sentido de 0,8 mg/dL de cálcio total, e que a acidose eleva os níveis do cálcio ionizado, ao contrário da alcalose. Em cerca de 50% dos RN de mãe diabética ocorre hipocalcémia, tipicamente entre as 24 e as 72 horas após o parto, e em geral acompanhada de hiperfosfatémia e/ou de hipomagnesiémia, possivelmente por atraso adaptativo das glândulas paratiróides ao ambiente extrauterino. Decorridas as primeiras 72 horas de vida, as paratiróides apresentam maior actividade, pelo que nos RNMD a hipocalcémia é geralmente precoce e transitória.
A hipocalcémia correlaciona-se com a gravidade e duração da diabetes materna, sendo sobretudo prevalente em RN com doença pulmonar e/ou asfixia periparto.
A hipocalcémia neonatal nos RNMD, embora frequente, é na maioria dos casos assintomática e autolimitada, pelo que não se justifica a determinação do cálcio sérico de modo rotineiro.
A hipocalcémia sintomática, manifestada por tremor e irritabilidade, convulsões, hipersudorese, letargia, apneia, taquipneia e alterações electrocardiográficas na fase de repolarização, com prolongamento do intervalo QTc (intervalo QT corrigido para a frequência cardíaca), superior a 0,4 segundos, obriga à determinação da calcémia e à sua correção com 1-2 mL/kg/dose de gluconato de cálcio a 10% (◊ 9-18 mg/kg de cálcio elementar), – administração endovenosa lenta em 5 a 10 minutos – com monitorização electrocardiográfica pelo risco de bloqueio cardíaco, bradicárdia refractária e hipotensão.
Se necessário, deve manter-se a correcção com dose de 2-7 mL/kg/dia (máximo: 200 mg/kg em 10 minutos). A hipocalcémia é susceptível de correcção em 3 a 4 dias e, até à normalização dos valores, o cálcio sérico deve ser determinado com intervalos regulares, habitualmente de 12-12 horas. Sublinha-se que uma hipocalcémia persistente pode dever-se à coexistência de hipomagnesiémia, a qual deve ser corrigida. A correcção da hiperfosfatémia, quando presente, deve preceder a correcção da hipocalcémia, pois se o produto [Ca2+] x [PO4- ] for > 80, poderá ocorrer calcificação dos tecidos moles.
Policitémia
Policitémia define-se por hematócrito > 65% no sangue venoso em RN com ou sem sintomas. A sua incidência varia entre 0,4%-12% em RN saudáveis e deve-se ao facto de os eritrócitos fetais terem um maior volume globular médio e serem menos deformáveis que os eritrócitos mais maduros, conduzindo a hiperviscosidade sanguínea. No caso dos RNMD, mais de 30% são afectados. A sua etiopatogénese relaciona-se directamente com o hiperinsulinismo fetal crónico levando sequencialmente a um aumento do metabolismo e consumo de oxigénio, hipoxémia fetal, por sua vez determinando produção acrescida de eritropoietina e policitémia.
As consequências da policitémia são múltiplas: morte fetal, SDR, insuficiência cardíaca, hipertensão pulmonar, sinais neurológicos (tremor, irritabilidade, convulsões, apneia), trombose, gangrena e acidente vascular cerebral. O tratamento padrão, abordado com mais pormenor noutro capítulo, consiste na substituição parcelar do sangue do doente por sangue com valor de eritrócitos mais baixo e viscosidade normal, o que se consegue com diversas estratégias. A Figura 4 mostra aspecto geral do fenótipo de RNMD, ressaltando as características de macrossomia e plétora, e paralisia do plexo braquial, situação traumática a abordar noutro capítulo, adiante.
Icterícia
A imaturidade hepática presente no período neonatal é responsável pela chamada icterícia fisiológica que surge em 60%-70% dos RN (valores de bilirrubinémia em geral < 13 mg/dL); no entanto, esta icterícia só se torna importante (bilirrubinémia total ≥ 13 mg/dL) em cerca de 5% dos casos de RN termo saudáveis versus 30% dos casos de RNMD. À deficiência transitória da enzima glucuroniltransferase, com aumento consequente da circulação êntero-hepática, somam-se outros fatores, que justificam a mais elevada incidência em RNMD: prematuridade, policitémia, aumento da hemólise e macrossomia.
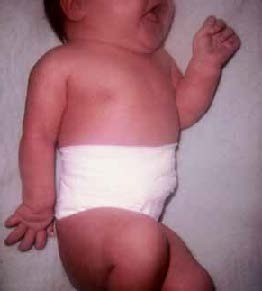
FIGURA 4. Fenótipo de RNMD com paralisia do plexo braquial* (URN-HDE)
*Trata-se duma fotografia histórica referente a época em que eram mais frequentes as paralisias braquiais e se usava faixa abdominal, hoje obsoleta.
Tem sido sugerido que a bilirrubina, em concentrações fisiológicas, exerce um efeito protector sobre os eritrócitos neonatais contra o estresse oxidativo. Porém, em concentrações patológicas prevalecem os efeitos citotóxicos e a hiperbilirrubinémia deve ser controlada. A avaliação clínica é pouco fidedigna e corre o risco de subestimar níveis significantes de icterícia neonatal. Os bilirrubinómetros transcutâneos mais recentes são preferíveis devido à sua capacidade de corrigir os valores de bilirrubina excluídos os efeitos da melanina e da hemoglobina e correlacionando-se favoravelmente com os valores estimados pelo laboratório (diferenças de 2-3 mg/dL com bilirrubinas < 15 mg/dL – 250 µmol/L).
Síndroma de dificuldade respiratória
Múltiplos factores, por vezes associados, contribuem para o aparecimento da síndroma de dificuldade respiratória (SDR) no RNMD. O parto pré-termo, outras condições associadas à própria diabetes, em especial a policitémia e hiperviscosidade concomitantes, a hipóxia e hipertensão pulmonar, a insuficiência cardíaca ocasional, e a alta taxa de cesarianas electivas condicionando atraso da reabsorção e eliminação do líquido pulmonar fetal (síndroma de taquipneia transitória ou “pulmão húmido”), são alguns do referidos factores.
A própria doença da membrana hialina (DMH), causada pela diminuição e/ou inibição da produção de surfactante face ao hiperinsulinismo fetal é mais frequente em RNMD, em qualquer idade gestacional.
Em gravidezes normais, com a administração antenatal de corticóides, tem-se verificado diminuição do risco de DMH. No entanto, pelo seu efeito hiperglicémico fetal e materno, o seu uso na diabética grávida não é consensual, obrigando a sua eventual administração a um controlo glicémico rigoroso, aplicando vários esquemas insulínicos, aparentemente com bons resultados. Particulamente importante, a diabetes bem controlada na gravidez não deve ser uma razão para um parto de pré-termo, efectivamente, com bons cuidados pré-natais, a gestação pode levar-se até termo, frequentemente após as 38 semanas sendo então o risco de SDR significativamente reduzido.
Cardiomiopatia hipertrófica
Em cerca de 30%-50% de diabetes tipo 1, de 25%-33% em tipo 2 e baixo risco na diabetes gestacional verifica-se cardiomiopatia reversível, com hipertrofia do septo interventricular e de uma ou ambas as paredes ventriculares, originando uma cardiopatia obstrutiva. O mecanismo deste tipo de patologia não está completamente esclarecido, embora se tenha comprovado a comparticipação da abundância em receptores para a insulina no miocárdio; como consequência, existe afinidade aumentada do miocárdio para a insulina levando a maior síntese de proteínas, glicogénio e gordura, e respectiva hipertrofia e hiperplasia.
Na fase pós-natal, com consequente diminuição da insulinémia, o número de receptores diminui, atenuando-se paralelamente a hipertrofia miocárdica. Ainda que cerca de 90%-95% dos casos sejam assintomáticos, nos restantes observa-se sinais de cardiopatia obstrutiva com baixo débito e/ou falência cardíaca.
O ecocardiograma pode confirmar o diagnóstico de cardiomiopatia obstrutiva enquanto os marcadores bioquímicos de disfunção miocárdica, nomeadamente CKMB, troponina I e pro-BNP necessitam de validação. Se for necessária terapêutica os β-bloqueadores (propranolol) poderão temporariamente diminuir a obstrução; de referir que a digoxina está contraindicada por redução do débito, aumento da própria obstrução e eventualmente exacerbando a falência cardíaca. Os sintomas resolvem-se habitualmente nas primeiras 2-4 semanas e as alterações ecocardiográficas nos primeiros 2-12 meses.
Síndroma do cólon esquerdo hipoplásico
A etiopatogénese, particularmente complexa e provavelmente multifactorial, deve-se com grande probabilidade aos episódios de hipoglicémia fetal induzidos por mau controlo diabético. As consequências desta hipoglicémia serão a libertação de glucagon e a concomitante diminuição da actividade simpática a nível da porção intestinal pré-esplénica, ambas contribuindo para a redução da motilidade do jejuno e do cólon esquerdo.
O resultado será um cólon de dimensões reduzidas e uma obstrução funcional. Este fenómeno de hipomobilidade poderá ser agravado pelo uso materno de drogas psicotrópicas com efeitos anticolinérgicos e a administração de magnésio durante a gravidez.
A apresentação clínica é a de uma obstrução intestinal orgânica ou funcional, e o diagnóstico será feito por ecografia ou radiografia simples do abdómen, por vezes com enema contrastado, que revelará as imagens características de dilatação colónica proximal, adelgaçamento em cone ao nível do ângulo esplénico com distensão pós-estenótica do cólon descendente e do sigmóide.
A terapêutica é conservadora: aspiração gástrica contínua, fluidoterapia endovenosa e, na ausência de perfuração intestinal, o próprio enema contrastado para além de confirmação diagnóstica poderá também ter efeitos terapêuticos. A cirurgia deve reservar-se para os casos de perfuração ou obstrução refractária recorrente sem resposta à terapêutica médica.
Diabetes gestacional (DG)
Grávida
Com o decorrer da gravidez, sobretudo a partir da segunda metade, o aumento do metabolismo materno exige maiores necessidades de insulina. Caso o limiar de metabolização da glicose seja ultrapassado, surge hiperglicémia. Todas as manifestações clínicas perinatais anteriormente descritas a propósito da DPG, são aplicáveis à DG, com a possível excepção das anomalias congénitas fetais, na situação presente, com menor prevalência do que na DPG. Contudo, determinados estudos apontem para uma alta taxa de defeitos congénitos na DG, provavelmente por corresponderem a casos de DPG, somente diagnosticados durante a gravidez. De facto, na última década nos países industrializados a DG tipo 2, constitui já 1/3 de todas as DPG.
Na população com diabetes gestacional, segundo a experiência dos autores, não se registaram mortes maternas, fetais ou perinatais; as intercorrências da gravidez, designadamente hipertensão gravídica, pré-eclâmpsia, oligo-hidrâmnio e RCIU, surgiram com menor incidência em relação a outras séries, sublinhando-se o bom controlo metabólico levado a cabo. Contudo, registou-se uma taxa de cesarianas de 43,9% versus 36,4% na população de controlo – mães com filhos GIG, não diabéticas.
Recém-nascido
A idade média na data do nascimento foi de 38 semanas, com um peso médio de 3,121 g (± 424 g) e um comprimento médio de 48,55 cm (± 1,77 cm). Os principais problemas clínicos são discriminados no Quadro 1, que estabelece a comparação entre RNMD e RN grandes para a idade gestacional (GIG) de mães não diabéticas. De salientar que, ao considerarmos a relação peso de nascimento/idade gestacional superior ao percentil 90 nos RNMD, esta percentagem foi extremamente baixa (2,9%); porém, ao aplicarmos o índice ponderal (IP > P90), essa percentagem sobe para 16,1%, o que se torna ainda mais evidente com o avançar da idade gestacional (22% e 25% às 39 e 40 semanas gestacionais, respetivamente). Tal facto sugere uma população de lactentes pequenos e obesos, em contraste com a de RN GIG de grávidas não diabéticas. Como tal, propomos que se utilize o IP como melhor indicador de macrossomia e não apenas a relação PN/IG.
Nesta coorte de RNMD registámos 10,3% de RN LIG (leves para a idade gestacional), em flagrante contraste com o diagnóstico obstétrico de restrição de crescimento fetal/intrauterino (RCIU) de apenas 0,9%, questionando a capacidade da avaliação obstétrica deste parâmetro há uma dezena de anos. A elevada taxa de cesarianas observada (43,9% versus 36,4% na população de controlo) não pode ser atribuída à macrossomia per se, pondo em causa induções electivas e fracassadas, agravando os problemas respiratórios destes neonatos com síndroma de adaptação pulmonar após cesarianas em RN de termo (síndroma de taquipneia transitória ou “pulmão húmido”).
Em suma, não se tendo registado quaisquer mortes maternas ou neonatais, resultados que suplantam muitas das séries publicadas, a morbilidade neonatal da DG, superior à da população em geral, continua a representar um importante problema de Saúde Pública.
QUADRO 1 – Morbilidade neonatal em RNMD e em GIG de mães não diabéticas.
Abreviaturas: RNMD: Recém-nascido de mãe diabética; GIG: RN Grande para a idade gestacional. | |||||
| RNMD | GIG | X2 | |||
| (n=211) | (%) | (n=157) | (%) | (p) | |
| Fractura da clavícula | 4 | 2 | 9 | 5,4 | 0,79 |
| Paralisia do plexo braquial | 1 | 0,5 | 2 | 1,2 | 0,47 |
| Anomalias congénitas | 9 | 4,3 | 9 | 4,7 | 0,582 |
| Prematuridade | 21 | 10,2 | 11 | 6,6 | 0,959 |
| Hipoglicémia | 6 | 3,1 | 4 | 2,4 | 0,663 |
| SDR | 8 | 4,1 | 4 | 2,4 | 0,342 |
| Icterícia | 63 | 31,6 | 28 | 16,8 | < 0,001 |
| Policitémia | 7 | 3,6 | 9 | 5,4 | 0,437 |
| Hipocalcémia | 9 | 4,7 | 2 | 1,2 | 0,054 |
Prognóstico
Se no 1º trimestre de gravidez as principais consequências da DPG se traduzem em anomalias congénitas e abortamentos, no final do 2º trimestre, período em que se verifica um aumento da diferenciação e maturação cortical cerebrais, um ambiente intrauterino desfavorável pode resultar em compromisso de vários tipos: cognitivo, psíquico e sensorial.
Factos provados cientificamente sugerem que estas crianças filhas de diabéticas apresentam défice psicomotor e psicossocial ligeiros a moderados, ainda que incidentes pós-natais possam igualmente contribuir para este prognóstico menos favorável.
Durante o 3º trimestre, devido à proliferação de adipócitos, células musculares e células-β dos ilhéus, as alterações metabólicas ocorridas poderão ter repercussões a longo prazo na idade adulta, nomeadamente quanto à incidência de obesidade, intolerância à glicose e diabetes não insulinodependente, de acordo com a hipótese de Barker: origem fetal de doenças com manifestações a partir da 4ª e 5ª décadas de vida. Este aspecto faz parte de um capítulo do livro (Volume 1- Parte IX).
Particularmente importante, do ponto de vista pediátrico, é determinar se a síndroma metabólica do adulto começa a manifestar-se precocemente e quais as características de apresentação. Nesta perspectiva, alargámos o leque de crianças filhas de mãe com DG para 335 e tomámos como população de controlo 295 crianças dos mesmos estratos sócio-económicos e da mesma área de distribuição geográfica.
Os resultados encontrados estão documentados nos quadros 2 e 3. Ainda que o IP, pelo menos para RN de termo ou próximo de termo, seja mais adequado para definir a composição corporal, neste estudo utilizámos o IMC na data do nascimento como parâmetro de comparação com as curvas de IMC no seguimento até à entrada para a escola (idade média 72 meses).
Pela análise do quadro 2, verificamos que a idade gestacional média dos filhos de mãe diabética insulinodepente (FMD ID) é significativamente inferior à dos filhos de mãe diabética não insulinodepente (FMD NID) e que à da população de controlo, em ambos os sexos. O IMC ao nascimento dos três grupos analisados é semelhante entre si; porém, há que ter em conta a diferença de idades gestacionais, sendo que, nos RNMID se verifica uma idade gestacional para um mesmo IMC semelhante aos restantes grupos.
No estudo de seguimento aos 72 meses de idade média (Quadro 3), verificamos um cruzamento ascendente de percentis de IMC transversal a todos os grupos, denotando o panorama preocupante actual de crianças com excesso de peso e de algumas, obesas. Esta tendência é particularmente acentuada nas raparigas FMD ID (Percentil IMC 15-50 ao nascimento versus 85-97 ao resultado do estudo de seguimento). Da mesma forma, as pressões arteriais sistólicas (PAS) são sempre mais elevadas nestas mesmas raparigas FMD IN, ainda que sem significado estatístico.
O peso relativo da carga genética, em confronto com noxas intrauterinas e pós-natais, não está completamente esclarecido. No entanto, pelo menos em modelos animais, a prevenção da hiperglicémia na gravidez reduz significativamente a prevalência de diabetes em futuras gerações. Os dados por nós documentados sublinham estas preocupações e confirmam que, apesar da Declaração de St. Vincent de 1989, este desidrato está longe de ter sido conseguido.
QUADRO 2 – Dados ao nascimento de filhos de mães diabéticas e população controlo.
| Sexo feminino | |||||||
| DG (n=160) | Não-DG (n=138) | ||||||
| ID (n=50) | NID (n=110) | ||||||
| Id. gestacional (X±Dp) | 37,7±0,83 | 38,2±1,16 | p=0,002 | 39,3±3,57 | p=0,001 | ||
| IMC (X±Dp) Percentil | 13,1±1.49 15-50 | 13,2±1.25 15-50 | p=0,416 | 13,2±1.50 15-50 | p=0,491 | ||
| Sexo masculino | |||||||
| DG (n=175) | Não-DG (n=151) | ||||||
| ID (n=55) | NID (n=120) | ||||||
| Id. gestacional (X±Dp) | 37,8±0,56 | 38,0±1,49 | p=0,017 | 39.07±1,14 | p=0,001 | ||
| IMC (X±Dp) Percentil | 13,2±1.09 15-50 | 13,0±1.33 15-50 | p=0,623 | 13,3±1.03 15-50 | p=0,154 | ||
QUADRO 3 – Dados do estudo de seguimento de filhos de mães diabéticas e da população controlo.
| Sexo feminino | ||||||||
| DG (n=119) | Não-DG (n=138) | |||||||
| ID (n=32) | NID (n=87) | |||||||
| Idade (Meses±dp) | 70±5.8 | 72±6.0 | p=0,174 | 73±6.1 | p=0,029 | |||
| IMC (X±dp) Percentil | 17.4±2.80 85-97 | 16.6±2.18 50-85 | p=0,176 | 16,6±2.53 50-85 | p=0,541 | |||
| PAS (mmHg±dp) | 101.4±10.63 | 98.5±8.63 | p=0,059 | 99,65±10,65 | p=0,289 | |||
| PAD (mmHg±dp) | 54.7±8.80 | 52.6±8.02 | p=0,186 | 54,08±8.62 | p=0,343 | |||
| Sexo masculino | ||||||||
| DG (n=135) | Não-DG (n=151) | |||||||
| ID (N=44) | NID (N=91) | |||||||
| Idade (Meses±dp) | 72±5.9 | 71±9.2 | p=0,362 | 74±6.8 | p=0,001 | |||
| IMC (X±dp) Percentil | 16.5±2.25 50-85 | 16.7±3.33 50-85 | p=0,576 | 16.7±2.15 50-85 | p=0,326 | |||
| PAS (mmHg±Sd) | 102.1±9.08 | 98.8±9.66 | p=0,147 | 97,68.0±11,40 | p=0,090 | |||
| PAD (mmHg±Sd) | 53.0±9.41 | 52.6±7.72 | p=0,873 | 54,9±10,39 | P=0,230 | |||
Estratégias possíveis de intervenção
De acordo com estudos de medicina baseada na evidência, segundo os quais um bom controlo metabólico pode alterar favoravelmente o panorama da diabetes na gravidez, porque é que, mesmo em países desenvolvidos, a generalidade dos resultados deixa tanto a desejar?
Em parte, porque muitos destes resultados reflectem cuidados pré-concepcionais e gestacionais muito heterogéneos e frequentemente insatisfatórios. Ainda que a carga genética possa ser desfavorável e ainda que outros substractos metabólicos para além da glicose, actuando em diferentes fases do desenvolvimento, possam contribuir para a etiopatogénese desta síndroma, de momento, contudo, a prioridade reside nos cuidados pré-concepcionais intensivos às mulheres diabéticas e na identificação das mulheres com risco de desenvolverem DG.
Nesta perspectiva, tais situações, uma vez diagnosticadas, deveriam beneficiar de um programa de controlo adequado, com redobrada atenção aos FMD não apenas no período neonatal incentivando, entre outras medidas, o aleitamento materno exclusivo e um estudo evolutivo de seguimento rigoroso com eventual controlo analítico de parâmetros precoces de síndroma metabólica do adulto com início na idade pediátrica.
Agradecimentos: Os autores, muito reconhecidamente, agradecem a colaboração da Professora Cláudia Silva da Faculdade de Ciências da Saúde/Universidade Fernando Pessoa, Porto, responsável pela análise estatística dos dados constantes deste capítulo.
BIBLIOGRAFIA
Adamkin DH. Metabolic screening and postnatal glucose homeostasis in the newborn. Pediatr Clin N Am 2015; 62 : 385-409
Carrapato MRG. The offspring of gestational diabetes. J Perinatal Med 2003; 31: 5-11
Carrapato MRG. Programming or the fetal origins of adult disease. Prenat Neonat Med 1999; 4: 89-93
Carrapato MRG TS, Prior AC, Caldeira T. The Offspring of Diabetic Mothers. Perinatal events and future outcome. In A Kurjak, M Pajntar (eds). Textbook of Perinatal Medicine. Zagreb: Croatia Parthenon Publishing Group, 2005
Durnwald C. Gestational diabetes: Linking epidemiology, excessive gestational weight gain, adverse pregnancy outcomes, and future metabolic syndrome. Semin Perinatol 2015; 39: 254-258
Eriksson UJ, Borg LA. Diabetes and embryonic malformations. Role of substrate-induced free-oxygen radical production for dysmorphogenesis in cultured rat embryos. Diabetes 1993; 42: 411-419
Eslamian L, Akbari S, Marsoosi V, Jamal A. Effect of different maternal metabolic characteristics on fetal growth in women with gestational diabetes mellitus. Iranian J Reproductive Med 2013; 11: 325-334
Feresu SA, Wang Y, Dickinson S. Relationship between maternal obesity and prenatal, metabolic syndrome, obstetrical and perinatal complications of pregnancy in Indiana, 2008-2010. BMC Pregnancy and Childbirth 2015; 15: 266-269
Georgieff MK, Sasanow SR, Mammel MC, Pereira GR. Mid-arm circumference/head circumference ratios for identification of symptomatic LGA, AGA, and SGA newborn infants. J Pediatr 1986; 109: 316-321
Goldman L, Schafer AI (eds). Goldman-Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Hou RL, Zhou HH, Chen XY, et al. Effect of maternal lipid profile, C-peptide, insulin, and HBA1c levels during late pregnancy on large-for-gestational age newborns. World J Pediatr 2014; 10: 175-181
Huang T, Kelly A, Becker SA, et al. Hypertrophic cardiomyopathy in neonates with congenital hyperinsulinism. Arch Dis Child Fetal and Neonatal Edition 2013; 98: F351-354
Jenum AK, Morkrid K, Sletner L, Vangen S, Torper JL, Nakstad B, et al. Impact of ethnicity on gestational diabetes identified with the WHO and the modified International Association of Diabetes and Pregnancy Study Groups criteria: a population-based cohort study. Euro J Endocrinol 2012; 166: 317-324
Khandelwal M, Reece EA, Wu YK, Borenstein M. Dietary myo-inositol therapy in hyperglycemia-induced embryopathy. Teratology. 1998; 57: 79-84
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
McManus RM, Bouwmeester A, Hinz L, et al. Costs of recalled and recommended diets for pregnant women with type 1, type 2 and gestational diabetes. Canadian J Diabetes 2013; 37: 301-304
Nold JL, Georgieff MK. Infants of diabetic mothers. Pediatr Clin N Am 2004; 51: 619-637
Ornoy A, Reece EA, Pavlinkova G, Kappen C, Miller RK. Effect of maternal diabetes on the embryo, fetus, and children: congenital anomalies, genetic and epigenetic changes and developmental outcomes. Birth defects research Part C. Embryo Today Rev 2015; 105: 53-72
Rozance PJ. Update on neonatal hypoglycemia. Curr Opin Endocrinol, Diabetes, Obesity 2014; 21: 45-50
Sacks DA, Hadden DR, Maresh M, Deerochanawong C, Dyer AR, Metzger BE, et al. Frequency of gestational diabetes mellitus at collaborating centers based on IADPSG consensus panel-recommended criteria: the Hyperglycemia and Adverse Pregnancy Outcome (HAPO) Study. Diabetes Care 2012; 35: 526-528
Tin W. Defining neonatal hypoglycaemia: a continuing debate. Semin & Neonatal Med 2014; 19: 27-32
Ullmo S, Vial Y, Di Bernardo S, et al. Pathologic ventricular hypertrophy in the offspring of diabetic mothers: a retrospective study. Eur Heart J 2007; 28: 1319-1325
Wang F, Reece EA, Yang P. Advances in revealing the molecular targets downstream of oxidative stress-induced proapoptotic kinase signaling in diabetic embryopathy. Am J Obstetr Gynecol 2015; 213: 125-134
Wery E, Vambergue A, Le Goueff F, et al. Impact of the new screening criteria on the gestational diabetes prevalence. J Gynecol, Obstetri Biologie de la Reproduction 2014; 43: 307-313
Yuen L, Wong VW. Gestational diabetes mellitus: Challenges for different ethnic groups. World J Diabetes 2015; 6:1024-1032