Definição e importância do problema
A estenose hipertrófica do piloro (EHP), como o nome indica, é uma hipertrofia (e não hiperplasia) da camada interna das fibras musculares do piloro, acompanhada de certo grau de espasmo, de causa desconhecida. A mucosa não evidencia qualquer alteração.
Constituindo a causa cirúrgica mais comum de vómitos não biliosos no lactente, tal situação ocorre na proporção aproximada de 1-3/1.000 RN, com predomínio do sexo masculino na relação ~4/1 e, sobretudo, em crianças dos grupos sanguíneos B e 0. Os descendentes de progenitores com antecedentes de estenose hipertrófica do piloro comportam maior probabilidade de doença (~10%-20%).
Etiopatogénese
Embora a causa seja desconhecida, tem-se chamado a atenção para determinadas situações clínicas frequentemente associadas, tais como fístula traqueoesofágica, hipoplasia ou agenésia do freio do lábio inferior, síndroma de Zellweger, síndroma de Apert, trissomia 18, síndroma de Smith-Lemli-Opitz, síndroma de Cornelia de Lange, e administração prévia (cerca de 2 semanas) de eritromicina a RN. Esta última situação aumenta em 10 vezes o risco de surgimento de EHP.
Admite-se o papel de determinados factores como síntese aumentada de factor de crescimento epidérmico, inervação muscular anómala (por ex. falta de células intersticiais de Cajal), níveis séricos elevados de prostaglandinas E2 pós-infusão do fármaco, hipergastrinémia, e níveis reduzidos de NO (por défice de sintetase de NO nas fibras musculares do piloro).
Em estudos recentes foram identificados 2 genes em dois loci, respectivamente nos cromossomas 11q14-q22 e Xq23, com papel no funcionamento de canais iónicos e no controlo da musculatura lisa, conduzindo a hipertrofia.
Noutros estudos comprovou-se prevalência quatro vezes superior de EHP em bebés alimentados com biberão/fórmula relativamente aos alimentados com leite materno, especulando-se sobre o papel dos VIP, em concentração elevada no leite materno, promovendo relaxamento pilórico.
Manifestações clínicas e laboratoriais
Os primeiros sinais da EHP surgem, geralmente entre a 2ª e 6ª semana de vida, numa criança que estava em plena saúde e a evoluir normalmente: vómitos projécteis não biliosos, cujo aparecimento pode ser de modo abrupto com progressão rápida. Em determinados casos, os vómitos poderão surgir de modo insidioso, logo a partir dos primeiros dias de vida.
Os vómitos aparecem 20 a 60 minutos após as refeições, sendo cada vez mais frequentes e volumosos, podendo ser acastanhados ou com sangue “vivo”, por esofagite. Após o vómito a criança fica “esfomeada”, e, por vezes aparenta “vomitar mais do que o que ingeriu antes” aplicando a linguagem expressiva de muitas mães.
Se a situação evoluir sem qualquer intervenção (evolução natural), as fezes tornam-se mais escassas e duras, semelhantes a fezes de ovelha, e a desidratação começa a instalar-se num quadro de alcalose hipoclorémica e hipopotassémica (por perda de suco gástrico, hidrogeniões e potássio).
Consequentemente pode haver diminuição do débito urinário com urina concentrada, estagnação do peso e, depois, desnutrição com perda de peso. Por vezes as ondas peristálticas são visíveis através da parede abdominal no epigastro durante a deglutição de leite.
Em menos de 5% dos casos verifica-se icterícia por hiperbilirrubinémia não conjugada resultante de insuficiente absorção de glucose e de incapacidade de manutenção da actividade da glucuronil transferase.
O diagnóstico pode ser mais difícil nas crianças com antecedentes de prematuridade e/ou baixo peso de nascimento, as quais evidenciam quadro clínico mais insidioso.
Com experiência, pode palpar-se a “oliva pilórica“; para tal pesquisa o observador deverá ficar colocado à esquerda do doente e com a mão esquerda “a rolar” o piloro sobre a coluna. Dados da literatura apontam para uma modificação actual do espectro de manifestações da EHP, com menor percentagem de casos com oliva palpável (~13% versus 50% há cerca de 45 anos), assim como de menor incidência de alterações hidroelectrolíticas e do equilíbrio ácido-base. Tal poderá traduzir menor valorização da semiologia clínica, mais precoce utilização de métodos imagiológicos (ver adiante) e maior suspeição do problema, levando a diagnóstico mais precoce.
Exames complementares
A ecografia (Figura 1) é o exame de eleição, sendo critérios de positividade o alongamento e espessamento do piloro traduzidos quantitativamente pelos seguintes valores (especificidade ~95%):
- Espessura muscular > 4 mm; ou
- Comprimento > 14 mm.
Se eventualmente tiver sido realizada radiografia abdominal simples tornam-se notórios: distensão gástrica importante, ultrapassando a linha média, e sinais de escassez de ar na área correspondente ao intestino.
A radiografia do estômago com contraste não tem hoje qualquer indicação sendo de salientar riscos e desvantagens. Deverá ficar reservada para casos duvidosos ou complexos.
Os achados laboratoriais clássicos incluem: pH > 7.45 com bicarbonato > 25 mEq/L e excesso de bases > +3; hipoclorémia (cloreto < 98 mEq/L); hipopotassémia (potássio < 4 mMol/L).
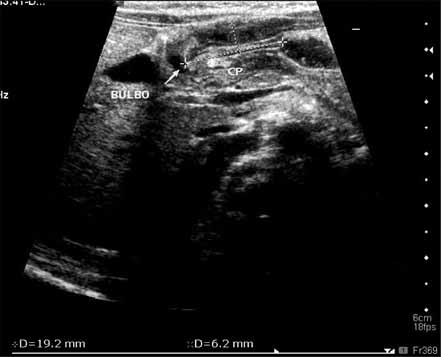
FIGURA 1. Achado ecográfico da região pilórica no contexto de EHP. (UCIN-HDE)
Tratamento
O tratamento é cirúrgico, de urgência, mas não de emergência: piloromiotomia extramucosa (operação de Fredet von Ramstedt). Com efeito, haverá que proceder previamente à correcção do desequilíbrio hidroelectrolítico e metabólico (desidratação e alcalose hipoclorémica e hipopotassémica): bolus inicial de soro fisiológico seguido de soro fisiológico diluído a 1/2 com dextrose a 5% em água, a que se acrescenta potássio uma vez verificada a diurese.
A técnica referida é realizada por via laparoscópica nalguns centros de cirurgia pediátrica. Autores japoneses têm utilizado atropina IV.
A introdução da alimentação oral deve ser precoce e progressiva, a partir das 6 horas do pós-operatório.
Apesar de não ser rara a ocorrência de vómitos nos dias imediatamente a seguir à intervenção cirúrgica, esta situação é passageira.
Prognóstico
O prognóstico é excelente.
BIBLIOGRAFIA
Ashcraft KW, Holcomb GW III, Murphy JP (eds). Pediatric Surgery. Philadelphia: Elsevier Saunders, 2005
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Guimarães JC, Carneiro MJ, Loio P, Macedo A, Tuna ML, et al. Manual Prático de Neonatologia. Lisboa: Hospital de S. Francisco Xavier/Uriage, 2016
Glatstein M, Carbell G, Boddu SK, et al. The changing clinical presentation of hypertrophic pyloric stenosis: the experience of a large, tertiary care pediatric hospital. Clin Pediatr (Phila) 2011; 50: 192-195
Kawahara H, Imura K, Nishikawa M, et al. Intravenous atropine treatment in infantile hypertrophic pyloric stenosis. Arch Dis Child 2002; 87: 71-74
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Krogh C, Biggar RJ, Fisher T, et al. Bottle feeding and the risk of pyloric stenosis. Pediatrics 2012; 130: e943- e949
To T, Wajja PW, Wales PW, Langer JC. Population demographic indicators associated with incidence of pyloric stenosis. Arch Pediatr Adolesc Med 2005; 159: 520-525
Wyllie R, Hyams JS, Kay M (eds). Pediatric Gastrointestinal and Liver Disease. Philadelphia: Elsevier, 2016
Yagmurlu A, Barnhart DC, Vernon A, et al. Comparison of the incidence of complications in open and laparoscopic pyloromyotomy: a concurrent single institution series. J Pediatr Surg 2004; 39: 292- 296