Definição e importância do problema
A designação de hérnia diafragmática (HDC) refere-se à comunicação/orifício de dimensões variáveis, entre as cavidades abdominal e torácica, com ou sem presença de vísceras abdominais na cavidade torácica. Tal defeito, que pode estar associado a grau variável de hipoplasia pulmonar e a outras anomalias, pode ter diversas localizações no diafragma, sendo a póstero-lateral a mais frequente (~90%), designada “hérnia de Bochdalek”. Assim, na maior parte das vezes quando nos referimos a hénia diafragmática congénita, admitimos em perincípio que se trata de hérnia de Bochdalek, a qual é objecto de estudo mais pormenorizado neste capítulo.
Sobre as outras localizações do orifício diafragmático, procede-se à respectiva descrição noutra alínea, adiante.
Verificando-se a presença de vísceras abdominais na cavidade torácica, considera-se que a hipoplasia pulmonar e a má-rotação intestinal, fazendo parte da entidade clínica, não são consideradas anomalias associadas.
A incidência da hérnia de Bochdalek é variável, sendo relatada em diversas séries a proporção de 1/2.000 a 5.000 nascimentos. Com os progressos da terapia intensiva ao longo dos anos, a taxa de sobrevivência nos países com recursos sofisticados passou de ~50% para >90%.
Aspectos embriológicos
A maioria dos casos de HDC/hérnia de Bochdalek ocorre de modo esporádico e, aparentemente, sem incidência familiar. No entanto, há descritos casos familiares, por vezes associados a síndromas, como é o caso da síndroma de Fryns, o que leva a admitir o possível papel de factores genéticos. Por outro lado, em cerca de 6% dos RN com HDC foram identificadas anomalias cromossómicas. Entretanto, foram identificados dois genes (NR2F2 e CHD2) localizados na região 15q26.1-15q26.2, possivelmente implicados na patogénese da HDC.
O desenvolvimento do diafragma realiza-se entre a 4ª e 12ª semana de gestação, resultando da formação de quatro esboços:
- Porção anterior, que representa a maior parte do septum transversum crescendo no sentido ântero-posterior;
- Pregas dorsolaterais ou pleuroperitoneais que se originam na parede lateral e crescem em direcção ao dorso;
- Porção única dorsal e média derivada da mesoderme esofágica; e
- Porções circulares que tapetam a periferia das membranas pleuroperitoneais.
O encerramento dos canais pleuroperitoneais realiza-se entre a 9ª e 10ª semana, para tal contribuindo as chamadas membranas ou pregas pleuroperitoneais de dupla camada, constituídas por peritoneu de um lado, e por pleura, do outro. A última parte a encerrar-se é a posterior e, sobretudo, o lado esquerdo onde persiste por mais tempo um orifício triangular.
Qualquer defeito no desenvolvimento dum ou mais componentes embrionários do diafragma, ou a falta de fusão duma das suas porções, condiciona o aparecimento de hérnia. Se a anomalia se verificar numa fase mais precoce, os órgãos herniados ficam em contacto directo com o parênquima pulmonar; se a reintegração for mais tardia, uma vez já verificada a junção dos dois folhetos peritoneal e pleural, estes são empurrados pelas vísceras abdominais através do foramen de Bochdalek, originando uma hérnia com saco; se o diafgragma estiver formado ao verificar-se a reintegração, não é possível a constituição da hérnia. Neste último caso, a única anomalia possível é uma insuficiência qualitativa ou quantitativa das fibras musculares do diafragma, conduzindo à chamada eventração diafragmática afectando toda a superfície duma cúpula cuja tradução funcional é o relaxamento ou hipotonia do músculo em questão. A eventração diafragmática é abordada em capítulo próprio.
No âmbito da embriologia, importa uma referência especial a certos factores determinantes do crescimento e desenvolvimento in utero do sistema respiratório em geral, e em especial do diafragma, os quais nos ajudam a compreender certas medidas de prevenção e tratamento da HDC, quer in utero, quer ex utero.
De acordo com a investigação nas últimas décadas, demonstrou-se que:
- A magnitude do incremento do líquido pulmonar fetal, expandindo o pulmão fetal é um importante determinante do crescimento pulmonar fetal. O líquido pulmonar fetal é segregado pelo epitélio pulmonar (pneumatócitos de tipo I) para o lume do tracto respiratório, fluindo dos pulmões para o líquido amniótico, através da traqueia;
- Que a hipoplasia pulmonar precede o defeito diafragmático, e que se a traqueia for obstruída, o líquido pulmonar não eflui, ocorrendo maior grau de expansão pulmonar. Este fenómeno constitui um potente estímulo para o crescimento pulmonar fetal, aumentando o peso pulmonar, bem como o ADN e o conteúdo proteico. Concomitantemente aumenta o diâmetro alveolar, a sua área e o número de alvéolos;
- Os glucocorticóides têm um efeito favorável no desenvolvimento e distensibilidade alveolar (compliance) e na diminuição do espessamento dos vasos pulmonares, em modelos animais com HDC; para além disso, promovem a produção de surfactante, o que é importante no tratamento da HDC, uma vez que estudos bioquímicos indicam que estes pacientes apresentam deficiência secundária de surfactante;
- A vitamina A, embora seja um agente teratogénico, constitui um indutor do crescimento pulmonar em fetos com HDC, promovendo a ramificação brônquica e dando ao pulmão embrionário um potencial de crescimento adicional, nos estádios de desenvolvimento seguinte;
- A grelina, ligando endógeno para o receptor secretagogo de hormona de crescimento – GHS-R, parece estar envolvida no crescimento pulmonar fetal (principalmente no estádio pseudoglandular de maturação pulmonar);
- A angiotensina II, sendo um regulador da morfogénese pulmonar, poderá explicar o facto de a administração de IECA e de antagonistas dos receptores da angiotensina durante a gravidez induzir hipoplasia pulmonar fetal.
Tipos de hérnia diafragmática
As HDC no sentido lato podem classificar-se de acordo com:
- Localização do orifício ou solução de continuidade;
- Constituição da referida hérnia.
Quanto à localização do orifício, distinguem-se:
A – Hérnias das cúpulas
Surgem em cerca de 80%-90% dos casos no lado esquerdo; as hérnias bilaterais, podendo ocorrer em cerca de 0,5%-1% dos casos, são na maioria dos casos fatais. As dimensões da solução de continuidade são muito variáveis (desde pequeno orifício a agenésia completa. Subdividem-se nos seguintes tipos:
- Hérnias póstero-laterais, as mais frequentes (designadas classicamente por hérnias de Bochdalek); (Figuras 1(A) 2- , 1(B))
- Hérnias por aplasia completa do hemidiafgagma, de prognóstico muito grave;
- Hérnias anterolaterais das cúpulas, mais raras, surgindo em idêntica proporção à direita e à esquerda.
B – Hérnias retrocostoxifoideias (anteriores)
São ainda chamadas hérnias pela fenda de Larrey ou pelo foramen de Morgagni; na realidade, trata-se de hérnias por aplasia (transformação das duas fendas de Larrey num orifício único, anterior, mediano e retrosternal, com diâmetro transverso superior ao ântero-posterior). Habitualmente são designadas por hérnias de Morgagni (correspondendo a cerca de 2-6% das hérnias HDC). (Figura 1(A) 3-)
C – Hérnias paresofágicas
São raras e diferentes das verdadeiras hérnias hiatais. Trata-se, de facto, de hérnias por deslizamento, estando o orifício herniário situado na vizinhança do orifício hiatal (ver adiante). Com efeito, na hérnia hiatal verdadeira o orifício herniário é comum com o orifício hiatal uma vez que existe agenesia do pilar direito do diafragma e da fita muscular pertencente ao anel muscular do orifício esofágico. (Figura 1(A) 1–)
FIGURA 1. A) Secção horizontal esquemática do diafragma; B) Secção parassagital esquerda (hérnia póstero-lateral).
Quanto à constituição da hérnia, há que distinguir:
A – As hérnias com e sem saco
Na maior parte dos casos não há saco, continuando-se a pleura com o peritoneu.
Em função do conteúdo, pode afirmar-se que todas as vísceras abdominais, excepto o duodeno, pâncreas e parte terminal da sigmoideia podem estar presentes na cavidade torácica; o intestino delgado, cólon direito e transverso estão sempre implicados.
As hérnias das cúpulas ou póstero-laterais são as que se manifestam de modo mais precoce e exuberante desde os primeiros momentos da vida extrauterina com um quadro de insuficiência respiratória obrigando a medidas de terapia intensiva do recém-nascido (RN).
Notas importantes:
|
Fisiopatologia
A partir da década de 90 do século XX, o conhecimento da fisiopatologia da HDC evoluiu significativamente, demonstrando-se que a principal causa de dificuldade respiratória e mortalidade pós-natal era a hipoplasia pulmonar associada a uma anormal muscularização arteriolar, conduzindo a hipertensão pulmonar (HTP) mantida no período pós-natal.
A hipoplasia vascular resulta duma diminuição efectiva dos ramos arteriais, bem como da diminuição da área de secção das arteríolas pré-acinares pequenas e intra-acinares, devido a um fenómeno de hipermuscularização. Esta hipoplasia vascular é responsável, por si só, pela manutenção da HTP no RN.
A hipoplasia alveolar resultante da diminuição da ramificação normalmente existente, coincidindo com a maturação pulmonar, perturba a capacidade ventilatória do RN. Tal resulta em hipóxia e hipercápnia mantidas.
A hipóxia, por sua vez, contribui para acentuar a vasoconstrição pulmonar, o que contribui para a manutenção e agravamento progressivo da HTP.
Mantendo-se a HTP no RN com HDC, a derivação circulatória direita-esquerda através do ductus arteriosus mantém-se concomitantemente, com consequente mistura de sangue mais oxigenado com menos oxigenado, o que leva a hipóxia tecidual caudal.
Esta hipóxia gera, além de vasoconstrição pulmonar, vasodilatação periférica, que desencadeia o conhecido fenómeno de “ruptura capilar” e consequente edema; este último origina compromisso da oxigenação dos tecidos, facilitando o metabolismo anaeróbio e consequente produção de lactato.
Instala-se seguidamente acidose metabólica a qual intensifica a vasoconstrição pulmonar provocada pela hipóxia. Com esta vasoconstrição é, então, mantida a HTP.
Entra-se, assim, num círculo vicioso difícil de reverter, o qual tende para falência multiorgânica.
Em suma, compreende-se que esta anomalia congénita comprometa a adaptação do feto à vida extrauterina. (Figura 2)
FIGURA 2. Fisiopatologia da adaptação do feto com HDC à vida extra-uterina.
Diagnóstico pré-natal
Como foi referido antes, o diagnóstico pré-natal ultrassonográfico de HDC é possível desde as 15-16 semanas de gestação. Por outro lado, a RM fetal pode estabelecer o diagnóstico diferencial com outras anomalias congénitas, como a malformação adenomatóide cística congénita, o sequestro pulmonar, o teratoma cístico mediastínico, os cistos broncogénicos, os tumores neurogénicos e o sarcoma pulmonar primário.
Uma vez confirmado o diagnóstico pré-natal de HDC, importa proceder ao rastreio de cromossomopatias/anomalias associadas (Figura 3). Para tal, deve realizar-se amniocentese e ecocardiografia fetal. Na verdade, a presença de cromossomopatias e de defeitos estruturais em geral, está associada a mau prognóstico, com mortalidade de ~90%.
Na ausência de alterações genéticas atrás referidas, e excluindo as condições que se consideram constituir a síndroma de HDC (hipoplasia pulmonar, ductus arteriosus e foramen ovale persistentes, e má-rotação), aproximadamente um terço dos RN com HDC tem outras anomalias associadas, das quais a maioria corresponde a defeitos cardíacos estruturais ou génito-urinários.
No caso de serem detectadas anomalias cromossómicas ou anomalias congénitas major, vários autores propõem interrupção médica da gravidez (IMG). Nos restantes há que estratificar o prognóstico, por forma a seleccionar aqueles que previsivelmente terão uma boa capacidade de adaptação pós-natal e aqueles cuja adaptação pós-natal será problemática beneficiando, por isso, de tratamento antenatal.
FIGURA 3. Algoritmo de abordagem de fetos com diagnóstico pré-natal de HDC. As setas a tracejado representam estratégias sob investigação experimental. IMG: interrupção medicamente assistida; LHR: right lung area to head circumference ratio.
Manifestações clínicas e exames complementares
Hérnia de Bochdalek
No período pós-natal, a expressão clínica da hérnia de Bochdalek é muito variável, o que está em relação com um amplo espectro de variantes anatómicas do próprio defeito; salienta-se que nem sempre existe uma relação directa entre a magnitude da hérnia e a sintomatologia.
Os sinais clínicos dependem essencialmente da hipoplasia pulmonar, da hipertensão pulmonar, e do défice ou disfunção do surfactante pulmonar.
Na sua forma mais típica de apresentação, o pós-parto imediato é caracterizado por má adaptação cardiorrespiratória à vida extrauterina (depressão respiratória neonatal, taquipneia, retracção costal, cianose, insuficiência respiratória progressiva na ausência de manobras de ressuscitação imediata e ventilação mecânica subsequente).
Verifica-se abdómen escavado, diminuição ou ausência do murmúrio vesicular do lado da hérnia e ruídos cardíacos audíveis no lado direito nos casos de hérnia póstero-lateral esquerda. Por vezes, auscultam-se no hemitórax correspondente ao lado do defeito, ruídos hidroaéreos. No entanto, há formas clínicas em que o diagnóstico é realizado mais tardiamente, pelo segundo ou terceiro dia de vida, quando o preenchimento gasoso progressivo do tracto intestinal passa a comprimir significativamente a cavidade torácica, exercendo efeito de massa sobre o mediastino ou sobre o pulmão contralateral.
O exame radiológico tóraco-abdominal é em geral suficiente para o diagnóstico, designadamente nos casos em que não se tenha realizado a vigilância pré-natal.
Podem ser observados sinais de preenchimento torácico por estômago ou ansas intestinais, vísceras sólidas como fígado ou baço, assim como de parênquima pulmonar não totalmente expandido, unicamente arejado no ápex, com empurramento do mediastino para o lado oposto. (Figura 4)
Em caso de dúvida, poderá introduzir-se tentativamente uma sonda radiopaca por via oral no estômago, avaliando ulteriormente a posição da respectiva extremidade: tórax ou abdómen.
A ecografia tóraco-abdominal permite definir a ausência de integridade diafragmática e a confirmação de presença de vísceras maciças no toráx, como o baço na hérnia diafragmática esquerda, e o fígado na hérnia diafragmática direita.
O ecocardiograma deverá ser efectuado na admissão na UCIN, às 24 horas de vida, antes da cirurgia, antes da alta (para documentar o valor de pressão pulmonar) e sempre que clinicamente se justificar (por exemplo face a agravamento hemodinâmico para avaliação funcional e da pressão arterial pulmonar).
Com efeito, um valor de pressão arterial pulmonar superior a 2/3 da pressão arterial sistólica sistémica, medida em simultâneo, sugere HTP grave, salientando-se, no entanto, que se trata duma avaliação indirecta da pressão arterial pulmonar, com limitações relacionadas, sobretudo, com a compressão cardíaca pelas vísceras abdominais em posição torácica.
Têm sido publicados diferentes estudos demonstrando o valor do doseamento do fragmento N terminal do péptido natriurético do tipo B (NT-pro BNP) na hipertensão pulmonar do adulto e do RN. Os níveis séricos deste péptido, produzido no miocárdio ventricular em resposta ao aumento da pós-carga causado por HTP, correlacionam-se com o valor de pressão na artéria pulmonar.
Os valores séricos no RN são habitualmente mais elevados do que no adulto, não estando absolutamente definido o intervalo de referência normal nesse grupo etário. No entanto, mais do que a medição instantânea do NT-proBNP, a sua avaliação seriada permite prever a evolução da HTP.
Assim, recomenda-se o doseamento de NT-proBNP às 24 horas de vida e, seriadamente, durante o período de estabilização, até à intervenção cirúrgica.
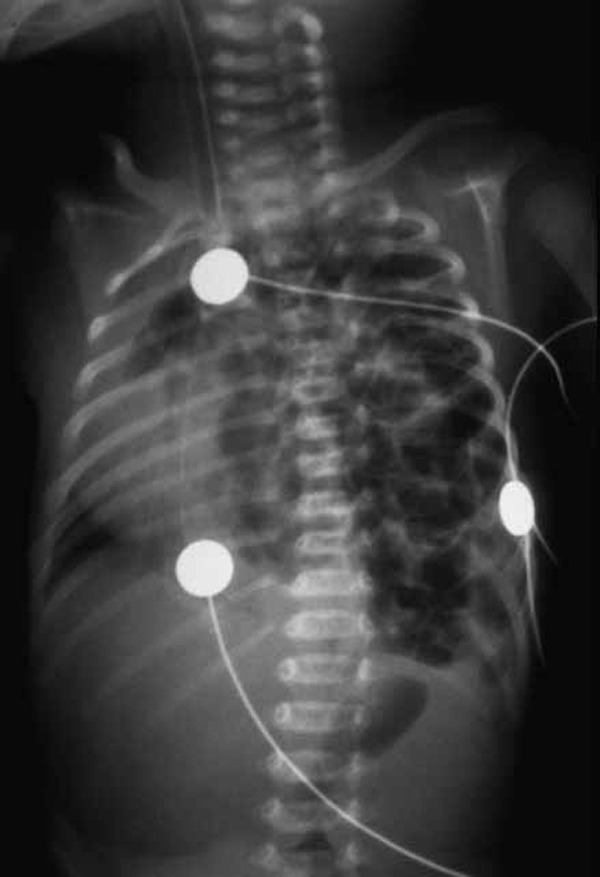
FIGURA 4. Aspecto radiográfico de HD de Bochdalek à esquerda. (UCIN-HDE)
Hérnia de Morgagni
Com este tipo de hérnia, dum modo geral, os doentes estão assintomáticos fazendo-se o diagnóstico após o período neonatal quando a criança é submetida a radiografia do tórax por qualquer razão.
A radiografia póstero-anterior evidencia uma estrutura sobreposta à sombra cardíaca; e a de perfil localiza uma imagem de massa retrosternal.
A TAC confirma o diagnóstico.
Os sinais clínicos, quando ocorrem, traduzem-se por infecções respiratórias recorrentes, tosse e/ou vómitos. Em casos raros pode surgir encarceramento do conteúdo herniário.
Hérnia paresofágica (peri-hiatal)
A hérnia paresofágica distingue-se da hérnia do hiato porque a junção gastresofágica está em localização normal. A herniação (do estômago em direcção à cavidade torácica, ou de parte do estômago adjacente à região gastresofágica) poderá conduzir a encarceração, estrangulamento ou perfuração. (Figura 5)
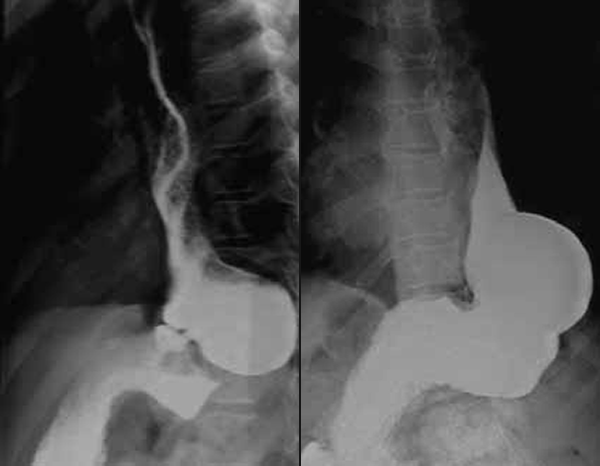
FIGURA 5. Aspecto radiográfico de hérnia peri-hiatal (contraste esofágico). (NIHDE)
Abordagem pré-natal
Técnicas
Numa perspectiva histórica importa uma referência à obstrução da traqueia aplicada em fetos humanos, técnica denominada PLUG (Plug the Lung Until it Grows). Para isso tem-se procurado desenvolver estratégias que permitam ocluir a traqueia, utilizando-se desde clips externos (~pinças), até balões intratraqueais.
Inicialmente, dado que a PLUG provocava elevada taxa de morbilidade e mortalidade, devida a problemas resultantes da histerotomia (parto pré-termo), desenvolveu-se outra, aparentemente menos traumática, designada pela sigla FETENDO (Video-Assisted Fetal Endoscopy), a qual permitia realizar a oclusão da traqueia sem histerotomia.
Os resultados do FETENDO, no entanto, têm sido contraditórios. Enquanto a escola americana não valorizou os resultados obtidos, segundo a escola europeia a FETENDO poderá ter utilidade na abordagem dos RN com HDC.
Foi neste contexto que surgiu a necessidade de investigar estratégias farmacológicas dirigidas ao feto com o objectivo de promover o crescimento e a maturação pulmonares.
Fármacos
De acordo com a investigação experimental, a utilização de glucocorticóides baseava-se no efeito favorável quanto ao desenvolvimento e distensibilidade alveolares (compliance) e à diminuição do espessamento dos vasos pulmonares; acrescentava-se ainda o efeito de produção de surfactante com base na verificação de deficiência secundária de surfactante em modelos animais com HDC.
Na espécie humana, no entanto, os benefícios da administração pré-natal de glucocorticóides no contexto pré-natal de hérnia de Bochdalek não se confirmaram.
Quanto à vitamina A, valorizou-se o efeito indutor do crescimento pulmonar em fetos com HDC, promovendo a ramificação brônquica e dando ao pulmão embrionário um potencial de crescimento adicional nos estádios de desenvolvimento seguintes.
Contudo, a administração profiláctica de vitamina A às grávidas não é viável, pois esta vitamina e os outros retinóides têm efeito teratogénico.
Correcção cirúrgica
O primeiro caso de correcção cirúrgica pré-natal de HDC, num feto humano, foi descrito em 1990. Desde então, a técnica praticada sofreu várias modificações. Inicialmente, realizava-se uma histerotomia e reparava-se o defeito diafragmático.
Posteriormente, numa perspectiva de avaliação dos resultados, a estratégia passou a considerar dois grupos de fetos com HDC: – com liver-down (fígado abdominal); e – com liver-up (fígado torácico).
Dado que em ambas as circunstâncias, os resultados foram desastrosos, os investigadores têm continuado a estudar métodos alternativos no âmbito da terapia pré-natal.
Abordagem pós-natal
Dando ênfase à HDC (Bochdalek), importa reter as seguintes noções:
Cuidados gerais
Para o êxito do tratamento dum problema clínico complexo como a HDC torna-se obrigatório o cumprimento dum conjunto de requisitos, destacando-se:
- Equipa especializada multidisciplinar;
- UCIN num hospital com centro de cirurgia neonatal, no pressuposto de que o parto foi planeado e realizado na respectiva instituição após transferência atempada da grávida;
- Vigilância pré-natal adequada.
Alguns destes aspectos, da maior relevância, são analisados na Parte sobre Neonatologia.
Antigamente, a HDC era entendida como uma emergência cirúrgica, ou seja, admitia-se que a insuficiência respiratória pós-natal era secundária à compressão pulmonar pelos órgãos herniados para o hemitórax. Assim, a redução da hérnia permitiria a reexpansão pulmonar.
Estando hoje estabelecido que a principal causa de dificuldade respiratória e mortalidade pós-natal é a hipoplasia pulmonar associada a hipertensão pulmonar (HTP), a correcção cirúrgica deve ser protelada até ao momento em que for atingida estabilidade hemodinâmica e ventilatória.
Nesta perspectiva e tendo em consideração os objectivos e características deste livro, é dada ênfase ao tratamento pré-operatório.
- Na sala de partos, a prestação de cuidados ao RN, nomeadamente a sua reanimação, deve estar a cargo da equipa de neonatologia.
É responsabilidade desta, estabelecer as funções dos respectivos componentes com o objectivo de actuar rapidamente e com estratégia coordenada; contudo, torna-se obrigatório que todos os gestos e atitudes terapêuticas sejam providenciados com extremo cuidado e manuseamento mínimo face ao risco de os estímulos mecânicos externos agravarem a hipertensão pulmonar. - Após admissão na UCIN deve realizar-se ecocardiograma. (ver alínea anterior)
- O RN deve ser entubado imediatamente após o nascimento, com um tubo orotraqueal e sonda orogástrica (8 F), assegurando-se a monitorização cardiorrespiratória. Após a colocação de acesso vascular (de preferência cateter percutâneo – epicutâneo-cava), deverá ser iniciada perfusão de soluto glicosado, com um suprimento hídrico a programar em função do balanço hídrico e da diurese; dum modo geral, até realização da intervenção cirúrgica, não deverá ser ultrapassado o suprimento de fluidos para além de 80 mL/kg/dia. Tal justifica-se pela necessidade de evitar a sobrecarga cardíaca, o edema associado à fuga de fluidos por via transcapilar e a disfunção cardíaca. (ver atrás)
A utilização de colóides está contraindicada, nomeadamente a utilização de albumina. Exceptua-se o sangue ou seus derivados, que serão ministrados de forma a manter Hb com valor ~14 g/dL. - Deve proceder-se ao cateterismo da artéria umbilical para determinação de pH e gasometria sanguíneos e à colocação de dois sensores cutâneos de oxímetro de pulso, respectivamente em território pré e pós-ductal.
- A acidose metabólica deve ser corrigida se pH < 7,2.
- Utiliza-se dopamina ao ritmo de 3 mcg/kg/min, independentemente da pressão arterial.
Não sendo objectivo da abordagem terapêutica da hérnia de Bochdalek pormenorizar o protocolo utilizado nas UCIN, são referidos apenas os aspectos essenciais.
Ventilação mecânica
Esta tem como objectivo diminuir a HTP e/ou rendibilizar as trocas gasosas minorando simultaneamente os barotrauma, volutrauma e atelectrauma pulmonares induzidos pela ventilação artificial. É neste contexto que se têm desenvolvido técnicas de ventilação cada vez mais sofisticadas, menos invasivas, a que se faz referência em capítulo próprio. (Parte de Parinatologia/Neonatologia – Problemas respiratórios)
- No sentido de reduzir o barotrauma, a pressão inspiratória (PIP) é cuidadosamente monitorizada, mantendo-a a < 25 cm H2O, e adopta-se estratégia de hipercápnia permissiva (PaCO2 de 45 a 60 mmHg), mantendo pH > 7,3. Salienta-se que os factores que contribuem para HTP são fundamentalmente hipóxia, acidose e hipotermia, devendo obviamente ser evitados.
De modo sucinto, salienta-se que actualmente são utilizados ventiladores de nova geração designados “com volume garantido/VG”, significando que, com moderna tecnologia de automatismo do ventilador, a PIP aumenta ou diminui de forma a manter um volume corrente aproximado do volume-alvo inicial marcado, desejável em função da situação clínica.
No caso da HDC, em RN de termo, o volume corrente inicial programado no ventilador é ~4-5 mL/kg/ciclo.
- No pré-termo com idade gestacional ≤ 34 semanas de gestação e/ou nos casos em que o padrão radiográfico do tórax sugira imaturidade pulmonar, está indicada a administração de surfactante.
- Deve ser evitada a utilização por rotina de morfina e vecurónio, estando estes fármacos reservados para situações particulares: i) o vecurónio poderá ser ponderado se houver dificuldade na ventilação; ii) nos RN muito reactivos está indicada a sedação com midazolam e, eventualmente, a administração de vecurónio, para o transporte para a UCIN, se a actividade motora e a agitação interferirem na ventilação.
- Se o RN evidenciar má perfusão periférica e/ou hipotensão arterial, está indicado bolus de soro fisiológico (10 mL/kg), que poderá ser repetido uma vez, se necessário. No entanto, é fundamental evitar o excesso de volume, ajustando-se, se necessário, a perfusão de dopamina.
- A ventilação é considerada adequada se saturação periférica de Hb-O2 pré-ductal (SpO2) > 95%, PaO2 pré-ductal > 75 mmHg e PaCO2 pós-ductal < 65 mmHg.
Nas situações de PaCO2 > 65 cm H2O, com aumento mantido, está indicado recorrer à ventilação de alta frequência (HFOV). Nos casos de HTP/hipoxémia refractária à ventilação mecânica e ao uso de surfactante, torna-se necessário recorrer a fármacos ou a técnicas ventilatórias que promovam diminuição de tal resistência.
- Recomenda-se a utilização de dobutamina nos casos de disfunção ventricular esquerda, demonstrada por ecocardiografia, ao ritmo de 5-10 mcg/kg/min.
- Nas situações de hipotensão associada a disfunção ventricular grave determinada por ecocardiografia, pode ser ponderada a utilização de milrinona.
- Se se verificar hipotensão resistente aos vasopressores, ou a outras modalidades de ventilação (alta-frequência ou por per-fluido-carbonetos), deverá ser ponderada a instituição de ECMO (sistema de oxigenação por membrana e circulação extracorporal) nos centros em que esteja disponível.
Notas complementares:
|
São critérios para iniciar terapêutica com iNO:
- HTP grave documentada por ecocardiografia e instabilidade hemodinâmica;
- Diferencial significativo entre SpO2 pré e pós-ductal (pós-ductal 10 pontos percentuais menor do que a pré-ductal); e
- PaO2 pós-ductal < 100 mmHg com FiO2 100%.
Se, ao fim de 6-12 horas de terapêutica, não se verificar resposta, o iNO deve ser suspenso. Nos RN em que se verifica resposta vasodilatadora, o iNO deve ser mantido até a pressão arterial pulmonar sistólica estimada ser inferior a 2/3 da pressão arterial sistémica e, eventualmente, até à correcção cirúrgica do defeito diafragmático.
Outra opção terapêutica válida no tratamento da HTP poderá ser o sildenafil (Viagra®). Este fármaco é um inibidor da fosfodiesterase tipo 5, responsável pela degradação do cGMP, pelo que promove a vasodilatação pulmonar. Pondera-se a sua utilização na HTP grave confirmada por ecocardiografia e, muitas vezes, na fase de interrupção da terapêutica com iNO. A sua utilização na criança não está autorizada, pelo que exige sempre o consentimento esclarecido por parte dos pais.
Correcção cirúrgica
Hérnia de Bochdalek
A HDC (Bochdalek) tem sempre indicação operatória; o objectivo da intervenção cirúrgica é a redução do conteúdo herniário e a correcção do defeito anatómico diafragmático. De referir que nalguns centros (entre eles, o de JCP) está actualmente a ser aplicada a técnica correctiva do defeito, minimamente invasiva, por via laparoscópica ou toracoscópica (também padrão de ouro). A correcção cirúrgica faz-se habitualmente por laparotomia transversa ou oblíqua no hipocôndrio direito.
Recentemente, no entanto, há relatos que descrevem a abordagem minimamente invasiva laparoscópica ou toracoscópica como uma opção possível. Em Portugal, segundo Jorge Correia Pinto (Universidade do Minho, em Braga), liderando equipa pioneira, a correcção consiste na redução das vísceras herniadas para o abdómen e encerramento do defeito diafragmático com suturas não absorvíveis, sendo nalguns casos necessário recorrer ao uso de prótese.
Os critérios para a correcção cirúrgica são os seguintes:
- Período de 24 horas de ventilação com parâmetros de FiO2 < 50%, PIP < 25 cm H2O ou MAP < 12 cm H2O (se, em HFOV);
- Sinais de resolução da hipertensão pulmonar (gradiente pré vs pós-ductal da SpO2 < 10 mmHg, pressão pulmonar estimada e NT-proBNP a diminuirem de modo mantido);
- Ausência de sinais de desequilíbrio hidroelectrolítico e ácido-base;
- Pressão sistémica estável; e
- Valor de Hb > 14 g/dL.
Os peritos no âmbito do CDH-EURO-Consortium, adoptaram os seguintes critérios para a referida intervenção:
- Pressão arterial normal para a idade gestacional;
- SpO2 pré-ductal entre 85% e 95% com FiO2 < 50%;
- Lactato sérico < 3 mmol/L;
- Diurese > 2 mL/kg/hora.
De acordo com estudos de metanálise, com a aplicação da técnica minimamente invasiva por toracoscopia na própria UCIN, concluiu-se que as taxas de recorrência e o tempo operatório são superiores em comparação com a técnica cirúrgica clássica, embora as taxas de sobrevivência sejam semelhantes.
Hérnia de Morgagni
O tratamento é cirúrgico, uma vez feito o diagnóstico. A abordagem por via laparoscópica está a ser progressivamente considerada padrão de ouro.
Hérnia paresofágica (peri-hiatal)
O tratamento é cirúrgico logo que a situação seja diagnosticada. A abordagem por via laparoscópica está também a ser progressivamente considerada padrão de ouro.
Prognóstico
Aspectos gerais
Após a alta, a maioria das crianças tem um neurodesenvolvimento próximo do normal. No entanto, existe uma maior propensão para o desenvolvimento de problemas respiratórios (bronquiolite), displasia broncopulmonar, problemas neurocognitivos e sensoriais (designadamente nos doentes anteriormente submetidos a ECMO), atraso de crescimento, escoliose, pectus excavatum e doença do refluxo gastresofágico.
Nesta perspectiva, com a coordenação do médico assistente, as crianças deverão ser encaminhadas para consultas de subespecialidade em função do contexto clínico para resolução de eventuais problemas surgidos ou previstos, pelo menos, durante os dois primeiros anos de vida.
Aspectos específicos
Desde cedo se percebeu que a sobrevivência associada à cirurgia fetal não superava a obtida com o tratamento pós-natal.
Perante estes resultados desastrosos, procurou-se desenvolver métodos alternativos para o tratamento pré-natal de fetos com prognóstico reservado ou mau.
Para além das cromossomopatias e/ou de anomalias malformativas associadas, são vários os factores de prognóstico que têm sido propostos para seguimento dos fetos com HDC: a presença do fígado no tórax, a razão área pulmonar-área transversa do tórax pequena, a presença do estômago no tórax, a diminuição dos componentes do surfactante no líquido amniótico, o lado e o tamanho do defeito, a hipoplasia da cavidade abdominal, a hipoplasia ventricular esquerda, a impedância da artéria pulmonar esquerda, a razão do tempo de aceleração/tempo de ejecção do VD, a diminuição do espaço morto e aumento da distensibilidade (compliance) dinâmica, mães com índice de massa corporal pré-concepcional igual ou menor que 19, e a idade materna (mulheres com 38 ou mais anos). Contudo, muitos destes índices não têm sido universalmente aceites.
De acordo com os resultados de estudos com grandes séries, os factores de prognóstico mais relevantes são: a posição do lobo hepático esquerdo, a avaliação ecográfica da razão entre a área pulmonar direita e o perímetro cefálico (LHR – right lung area to head circumference ratio), a idade gestacional aquando do diagnóstico pré-natal, coexistência de poli-hidrâmnio e o desvio acentuado do mediastino.
De um modo genérico, apontam-se os seguintes valores: a ausência de herniação hepática permite prever um bom prognóstico, com 93% de sobrevivência, enquanto a herniação hepática está associada apenas a 43% de sobrevivência.
A importância destes índices de prognóstico reside no facto de se poder estratificar com certa confiabilidade o prognóstico dos fetos com diagnóstico de HDC, de forma a seleccionar aqueles cujo prognóstico, com o tratamento pós-natal existente na actualidade, é previsivelmente insatisfatório.
Assim, é para este grupo de fetos que o tratamento antenatal surge como uma esperança e um estímulo para a investigação. Como perspectivas futuras, a terapia génica in utero (transferência de determinados genes para o feto), tendo como alvo preferencial o pulmão em desenvolvimento.
BIBLIOGRAFIA
Abman SH, Kinsella JP, Rosenzweig EB, et al. Implications of the U.S. FDA warning
Against the use of sildenafil for the treatment of pediatric pulmonary hypertension. Am J Resp Crit Care Med 2012;187:572-575
Ashcraft KW, Holcomb GW III, Murphy JP (eds). Pediatric Surgery. Philadelphia: Elsevier Saunders, 2005
Bancalari E (ed). The Newborn Lung. Philadelphia: Saunders Elsevier, 2012
Cloherty JP, Eichenwald EC, Strak AR. Manual of Neonatal Care. Philadelphia; Lippincott Williams & Wilkins, 2008
Colvin J, Bower C, Dickinson JE, Sokol J. Outcomes of congenital diaphragmatic hernia: a population-based study in Western Australia. Pediatrics 2005;116:e356-e363
Correia-Pinto J, Baptista MJ e Nogueira-Silva C. Hérnia diafragmática congénita como modelo em investigação. Implicações clínicas. In Tratado de Cínica Pediátrica. Videira Amaral JM (ed). Segunda edição. Lisboa: Abbott, 2013
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Gaxiola A, Varon J, Valladolid G. Congenital diaphragmatic hernia: an overview of the etiology and current management. Acta Paediatr 2009;98:621-627
Jaillard SM, Pierrat V, Dubois A, et al. Outcome at two years of infants with congenital diaphragmatic hernia. Ann Thorac Surg 2003;75:250-256
Klaassens M, de Klein A, Tibboel D. The etiology of congenital diaphragmatic hernia:still largely unknown ? Eur J Med Genet 2009;52:281-286
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Lakshminrusimha S. The pulmonary circulation in neonatal respiratory failure. Clin Perinatol 2012;39:655-683
Lawrence KM, Monos S, Adams S, et al Inhaled nitric oxide is associated with improved oxygenation in a subpopulation of infants with congenital diaphragmatic hernia and pulmonary hypertension. J Pediatr 2020;219:167-172.
McIntosh N, Helms P, Smyth R, Logan S (eds). Forfar and Arneil’s Textbook of Pediatrics. London: Churchill Livingstone, 2008
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Oldham KT, Colombani PM, Foglia RP (eds). Principles and Practice of Pediatric Surgery. Philadelphia: Lippincott Williams & Wilkins, 2005
O’Neill Jr JA, Rowe MI, Grosfeld JL, et al (eds). Pediatric Surgery. Philadelphia: Elsevier, 2017
Polin RA, Abman SH, Rowitch DH, Benitz WE, Fox WW (eds). Fetal and Neonatal Physiology. Philadelphia: Elsevier, 2017
Polin RA, Yoder MC. Workbook in Practical Neonatology. Philadelphia: Elsevier Saunders, 2015
Sluiter I, van den Ven CP, Wijnen RMH, Tibboel D. Congenital diaphragmatic hernia:still a moving target. Semin Fetal & Neonatal Med 2011;16:139-144
Smith NP, Jesudason EC, Featherstone NC, et al. Recent advances in congenital diaphragmatic hernia. Arch Dis Child 2005;90:426-428
Sydorak RM, Harrison MR. Congenital diaphragmatic hernia: advances in prenatal therapy. World J Surg 2003;27:68-76.
The Neonatal Inhaled Nitric Oxide Study Group (NINOS). Inhaled nitric oxide and hypoxic respiratory failure in infants with congenital diaphragmatic hernia. Pediatrics 1997;99:838-845.
Tiruvoipati R, Vinogradova Y, Faulkner G, et al. Predictors of outcome in patients with congenital diaphragmatic herni requiring extracorporeal membrane oxygenation. J Pediatr Surg 2007;42:1345-1350
Van Meures L, Congenital Diaphragmatic Hernia Study Group. Is surfactant therapy beneficial in the treatment of the term newborn infants with congenital diaphragmatic hernia? J Pediatr 2004;145:312-316
Weiner GM, (ed). Textbook of Neonatal Resuscitation. Elk Grove Village, IL: Amarican Academy of Pediatrics, 2106