Generalidades sobre leishmanioses
As leishmanioses constituem um grupo heterogéneo de doenças causadas por protozoários do género Leishmania, parasitas intracelulares das células endoteliais ou dos leucócitos do sangue. Existem múltiplas espécies provocando doença no Homem, com expressão clínica na pele, mucosas e sistema reticuloendotelial de diversos órgãos.
Cada forma clínica tem particularidades em relação com: a distribuição geográfica, a espécie do agente implicado, a ecologia, os mamíferos como reservatórios e os insectos hematófagos como vectores, e o estado imunitário do paciente. Assim, o agente Leishmania pode provocar infecção numa larga gama de vertebrados e, em particular, em canídeos, roedores, e primatas, incluindo humanos.
São descritas as seguintes formas clínicas de Leishmaniose: Cutânea localizada, Cutânea difusa, Disseminada no contexto de imunodeficiência, Mucosa e Sistémica visceral.
A doença cutânea é ligeira, podendo originar sequelas com repercussão cosmética. As formas de leishmaniose mucosa e visceral, pelo contrário, comportam maior grau de morbilidade.
Neste capítulo é abordada apenas a forma clínica visceral, a qual predomina na idade pediátrica.
Definição e aspectos epidemiológicos
A forma de Leishmaniose Visceral, designada classicamente como Calazar ou Kala-azar é uma doença infecciosa sistémica não contagiosa que afecta sobretudo crianças com < 5 anos de idade. O termo calazar significa “febre negra” de acordo com a descrição da doença na Índia em 1903 pelos investigadores Leishman e Donovan.
A leishmaniose visceral é considerada uma zoonose na maior parte das zonas do globo, uma vez que a doença também afecta diversas espécies animais como cães e raposas; com efeito, há que referir que nalgumas zonas como a Índia e África Oriental o Homem também poderá ser o reservatório do protozoário. Os vectores de Leishmania são insectos hematófagos com escassa autonomia de voo, Phlebotomus ou Lutzomyia. O contágio inter-humano é possível mas raro, podendo ocorrer por transfusões de sangue, partilha de seringas e transmissão materno-fetal.
Em Portugal, o cão é o principal reservatório; o protozoário transmite-se de cão a cão, ou de cão ao Homem (hospedeiro final). Ou seja, o cão tem um papel relevante na disseminação e manutenção da infecção humana.
De acordo com a OMS, surgem em todo o mundo cerca de 300.000 novos casos anuais, dos quais resultam 20.000 mortes; cerca de 90% dos casos fatais ocorrem em apenas seis países, incluindo Índia, Bangladesh, Sudão, Sudão do Sul, Etiópia e Brasil.
Assim, a leishmaniose é considerada a terceira doença parasitária mais frequente a seguir à toxoplasmose a criptosporidiose. A distribuição da doença coincide com a distribuição do vector acometendo populações pobres, vulneráveis, subnutridas e habitando em zonas sem saneamento básico e sem acesso a cuidados preventivos de saúde.
Em Portugal Continental, com base em estudos de seroprevalência, podem ser consideradas zonas endémicas Trás-os-Montes e Alto Douro, Cova da Beira (entre as serras da Estrela e da Gardunha), regiões de Lisboa e Vale do Tejo (onde actualmente existe o maior número de casos) e Alto Alentejo.
Há décadas, o calazar era considerado tradicionalmente uma doença das zonas rurais, de ocorrência endémica e esporádica. Actualmente este panorama modificou-se à mercê de um conjunto de circunstâncias tais como:
- Fenómenos migratórios de populações não imunes para áreas em que o vector está presente;
- A urbanização/domesticação dos focos zoonóticos naturai
Segundo dados do INSA e da DGS, em Portugal entre 2008 e 2013 foram notificados 42 casos de leishmaniose, na sua maioria afectando crianças entre 1 e 4 anos de idade e do sexo masculino. A incidência real deverá ser superior, dada a subnotificação desta doença. Actualmente, têm sido relatados casos de coinfecção com o VIH em zonas de elevada prevalência das duas situações.
Etiopatogénese
São descritas três espécies de Leishmania que causam leishmaniose visceral:
- donovani, prevalente sobretudo na Ásia;
- infantum, prevalente sobretudo na Europa (incluindo Portugal), Ásia e África;
- chagasi, prevalente nas Américas.
Após inoculação do protozoário no organismo verifica-se disseminação hematogénica, salientando-se o viscerotropismo do agente etiológico; ou seja, a doença comporta-se como doença sistémica afectando as células do sistema reticuloendotelial (SRE) de todos os órgãos, com especial relevância para fígado, baço, medula óssea, e gânglios linfáticos.
A infecção por Leishmania, no ciclo evolutivo, pode assumir duas formas: uma, arredondada ou ovóide, de escassa mobilidade, sem flagelo, designada amastigota, residente no interior das células do SRE/fagócitos mononucleares dos vertebrados, onde se replica; e outra, alongada, com flagelo e grande mobilidade, designada promastigota, e presente no tubo digestivo dos insectos vectores; isto é, a forma promastigota, ao entrar no macrófago, transforma-se em amastigota.
A transmissão da leishmaniose visceral dá-se quando o flebótomo/vector adquire o protozoário ao picar um reservatório infectado (como se referiu atrás, na maioria dos casos um animal) e, após completado o ciclo parasitário no vector, transmite o referido protozoário (formas promastigotas na saliva) ao hospedeiro definitivo humano através de picada. As formas promastigotas são fagocitadas pelos macrófagos do referido hospedeiro, onde resistem ao estresse oxidativo dentro de vacúolos. Isto condiciona uma activação do sistema imunitário, nomeadamente através do eixo IL12-IFN gama numa tentativa de aumentar a capacidade oxidativa dos fagócitos.
A ineficácia e hiperactivação do sistema imunitário conduz a:
- Redução progressiva da produção de eritrócitos, granulócitos e plaquetas;
- Aumento de dimensões do fígado e baço com áreas de inflamação, necrose e ulterior fibrose, explicável pela própria proliferação dos macrófagos.
Nas formas graves verifica-se a presença de histiócitos (o elemento fundamental do tecido reticuloendotelial, dotado de grande poder fagocitário), contendo Leishmanias em todos os órgãos (miocárdio, rim, pulmões, etc.).
As características genéticas do hospedeiro influenciam o desenvolvimento da doença. Em particular, mutações no gene NRAMP1 desempenham um papel fundamental na susceptibilidade para doença visceral. Outros factores que determinam o grau de expressão clínica são a virulência e magnitude do inóculo do parasita, assim como o genótipo do vector.
Manifestações clínicas
As manifestações clínicas de leishmaniose visceral são, de um modo geral, semelhantes nas zonas endémicas, independentemente da área geográfica.
O período de incubação do calazar varia entre 10 dias e 2 anos, com um período médio de 2 a 6 meses. Em regra, o início da sintomatologia é abrupto nas crianças pequenas, e insidioso nas crianças maiores; acompanha-se de sinais inespecíficos como adinamia, anorexia, mal-estar geral, perda de peso e palidez. A febre prolongada, oscilando entre 37,5ºC e 40ºC, pode evidenciar diversos padrões em termos de periodicidade e intermitência, os quais não são característicos da doença.
À medida que a doença evolui são notórios os seguintes sinais, evoluindo progressivamente: palidez, emagrecimento, adenomegálias e aumento do volume abdominal. Este aumento do volume abdominal explica-se sobretudo por esplenomegália indolor de consistência elástica ou ligeiramente dura, a qual pode atingir proporções enormes ultrapassando por vezes a cicatriz umbilical; acompanha-se em geral de hepatomegália importante, embora mais discreta. Uma pequena minoria pode apresentar uma úlcera no local da picada do insecto (Leishmanioma). (Figura 1)
Outras manifestações associadas incluem insuficiência renal, diarreia, vómitos, obstipação, hemorragias (epistaxe, petéquias, gengivorragias), sinais respiratórios sobreponíveis aos verificados em infecções víricas comuns, dificuldade respiratória, artralgias, mialgias, etc.. Existem por vezes manifestações neurológicas, como neuropatia periférica ou de pares cranianos em relação com degenerescência axonal e desmielinização.
Dado que as alterações provocadas por Leishmania são de natureza sistémica, em zona endémica, perante quadro de febre prolongada, anemia, espleno-hepatomegália e manifestações hemorrágicas, deverá ser evocada a hipótese diagnóstica de calazar.
Estão descritas, no entanto, formas assintomáticas, oligossintomáticas ou subclínicas, que se poderão traduzir fundamentalmente por febre, ou tosse, ou diarreia, hipersudorese, adinamia, ou hepatomegália e esplenomegália ligeiras, etc..
Este quadro, se não tratado, poderá persistir durante 3 a 6 meses evoluindo, ou no sentido de regressão espontânea, ou de calazar dito clássico, atrás referido.
Duas notas importantes acerca da leishmaniose visceral surgindo em situações de imunodeficiência:
- Em doentes infectados com o VIH/SIDA, salientam-se esplenomegália e envolvimento do tracto gastrintestinal, pulmão, esófago menos frequentes;
- Nos casos de doença granulomatosa crónica ou de defeitos do eixo interferão gama–IL 12, evolução mais grave e prolongada, com frequentes recaídas e compromisso multiorgânico.
No que respeita a complicações, cabe uma referência especial a dois quadros clínicos:
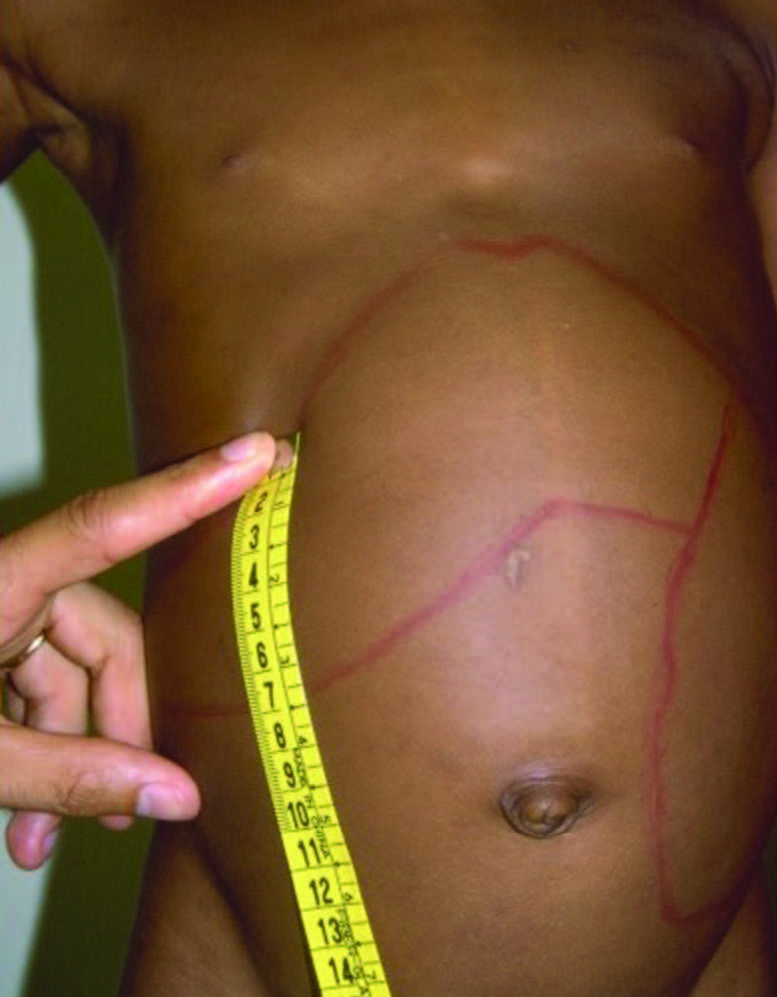
FIGURA 1. Calazar: Hepatoesplenomegália. (NIHDE)
Síndroma hemofagocítica
Trata-se duma das complicações mais graves desta doença, sobretudo em lactentes, consideradas como o reflexo de uma resposta imunológica ineficaz. A “explosão” de citocinas conduz a um quadro sistémico com as seguintes características: febre alta, agravamento da esplenomegália e da pancitopénia, ferritina elevada, hipertrigliceridémia, hipofibrinogenémia, muitas vezes em associação a instabilidade hemodinâmica e insuficiência renal. Apesar de habitualmente se verificar resposta à terapêutica dirigida para a parasitose, por vezes é necessário frenar a resposta imune com fármacos imunossupressores ou imunomoduladores.
Dermatose por Leishmania pós-calazar
Esta complicação pode surgir até 3 anos após o calazar, consistindo em máculas hipopigmentadas e/ou pápulas/nódulos generalizados. Não se associam a morbilidade ou mortalidade mais elevadas, mas podem ter um importante impacte cosmético. Ocorre muito mais frequentemente após infecção com L. donovani.
Exames complementares
Existe frequentemente pancitopénia, citólise hepática, elevação da gama-GT, da fosfatase alcalina, e hipergamaglobulinémia policlonal, evidente na electroforese de proteínas. As alterações nefrológicas podem traduzir-se por hematúria e proteinúria.
Quanto ao contributo dos vários exames complementares para o diagnóstico, procedeu-se à sistematização que se segue, e à elaboração do Quadro 1.
Diagnóstico parasitológico
Decorre da demonstração de formas amastigotas em esfregaços de tecido (gânglio linfático, medula óssea ou baço, com sensibilidades crescentes, 55%, 70% e 95%) obtidos por punção aspirativa e coloração pelo método de Giemsa.
Continua a ser o método “padrão de ouro”, embora evidenciando uma sensibilidade baixa.
Diagnóstico serológico
Baseia-se na detecção de antigénios do parasita ou de anticorpos contra a Leishmania. Existem vários testes com diferentes sensibilidades e especificidades.
Diagnóstico molecular
Actualmente, as técnicas de biologia molecular como a da reacção em cadeia da polimerase (PCR), com especificidade e sensibilidade elevadas, permitem a identificação do material genético de parasitas em amostras de punção biópsia, e também de sangue periférico. A sensibilidade é maior nos tecidos (por exemplo, baço ou medula óssea); e é variável no sangue periférico, provavelmente porque a carga de parasitas no sangue varia com a gravidade da doença. Não estão disponíveis na maior parte dos países com doença endémica.
Teste cutâneo (Leishmania Skin Test)
Este teste, também conhecido como prova de Montenegro, testa a hipersensibilidade tardia. Sendo positivo somente ~ 2-4 meses após a cura, não tem qualquer interesse diagnóstico.
Relativamente aos exames complementares, importa destacar:
- Teste de aglutinação directa, onde é feita a incubação do soro do doente contra o antigénio do promastigota. Ao final de 18 horas existe aglutinação visível no caso de existirem anticorpos no soro. A possibilidade de leitura a “olho nu” promove a sua utilização em países em vias de desenvolvimento;
- ELISA: detecta a presença de anticorpos, salientando-se que a sua sensibilidade depende do antigénio usado. A utilização de antigénios solúveis tem sido insatisfatória, sendo que actualmente se usam antigénios recombinantes, de que o antigénio K28 é o mais utilizado. Os maiores problemas do teste são a possibilidade de, em zonas endémicas, pessoas com infecção assintomática evidenciarem teste positivo e o facto de os títulos, permanecendo positivos após o tratamento, não poderem ser utilizados como monitorização da resposta à terapêutica;
- Testes rápidos: apesar de usados de forma generalizada nos países endémicos, a sensibilidade varia muito de acordo com a localização e com os antigénios usados. A sua elevada sensibilidade permite a sua utilização como teste de rastreio, apesar de se dever sempre confirmar a doença com outro método;
- Aglutinação em látex: permite a detecção do antigénio na urina. Tem uma elevada especificidade (desde que a urina seja fervida durante 5 minutos), mas a sensibilidade é baixa, limitando a sua utilização.
Nota Importante – Dado que os testes serológicos evidenciam menor sensibilidade, deverá ser dada preferência aos métodos de diagnóstico parasitológico ou de biologia molecular. |
O Quadro 1 permite elucidar com pormenor sobre um largo espectro de exames complementares.
Quadro 1 – Leishmaniose visceral e exames complementares.
| Métodos | Amostra utilizada | Tempo exigido | Dificuldade | Sensibilidade (%) | Especificidade (%) | |
Diagnóstico parasitológico
| Biópsia aspirativa esplénica | Tecido de baço | Horas | Alta | 93-99 | 100 |
| Biópsia aspirativa medular | Medula óssea | Horas | Alta | 53-86 | 100 | |
| Biópsia ganglionar | Gânglio linfático | Horas | Alta | 53-65 | 100 | |
| Cultura | Baço ou medula óssea | Dias | Média | 97-100 | 100 | |
| Diagnóstico serológico | IFAT | Soro/plasma | Horas | Alta | 80-100 | 96-100 |
| Teste de aglutinação directa | Soro/plasma | Dias | Média | 94,80 | 97,10 | |
| ELISA | Soro/plasma | Horas | Média | 93-100 | 97-98 | |
| Saliva | Horas | Média | 83,30 | 88,6-100 | ||
| Tira de teste rápido | Soro | Minutos | Baixa | 96,3-100 | 90,1-100 | |
| Sangue | Minutos | Baixa | 96-100 | 90,8-100 | ||
| Saliva | Minutos | Baixa | 82,50 | 84,6-91,48 | ||
| Urina | Minutos | Baixa | 96,40 | 66,2-100 | ||
| Ensaio de immunoblotting | Soro/plasma | Horas | Média | 83-94 | 90 | |
| IFN- 𝛾 release assay (IGRA) | Sangue total | Dias | Média | 80-85 | 100 | |
| Aglutinação em látex | Urina | Horas | Média | 48-87 | 89-100 | |
| Diagnóstico molecular | PCR | Sangue total | Horas | Alta | 70-100 | 85-99 |
| Zaragatoa bucal | Horas | Alta | 83 | 90,56 | ||
| Urina | Horas | Alta | 88 | 100 | ||
| Medula óssea | Horas | Alta | 95,30 | 92,60 | ||
| PCR ELISA | Sangue total | Horas | Alta | 83,90 | 100 | |
| qPCR | Sangue total | Horas | Alta | 91,3-100 | 95-100 | |
| Oligo C-test | Sangue total | Horas | Alta | 96,2 | 90 | |
| Gânglio linfático | Horas | Alta | 96,8 | NA | ||
| Medula óssea | Horas | Alta | 96,9 | NA | ||
| LAMP | Sangue total | Horas | Média | 83 | 98 | |
| Buffy coat | Horas | Média | 90,7 | 100 |
| Diagnóstico imunológico | IFAT |
| Teste de aglutinação directa | |
| ELISA | |
| Tira de teste rápido | |
| Ensaio de immunoblotting | |
| IFN- 𝛾 release assay (IGRA) | |
| Aglutinação em látex |
Tratamento
Aplicam-se as medidas gerais de suporte em casos de doenças febris com compromisso do estado geral (anemia, síndroma hemorrágica, leucopénia, etc.). Neste capítulo é dada ênfase ao tratamento farmacológico específico anti-Leishmania;
As alternativas terapêuticas disponíveis incluem a anfotericina B, os antimoniais pentavalentes, a paromomicina e o miltefosine. A sensibilidade a cada um deles varia de região para região em todo o globo.
Anfotericina B
A anfotericina B convencional, apesar de eficaz, deixou de ser utilizada pelo melhor perfil de segurança da anfotericina B lipossómica.
Pode ser usada em diversos esquemas mas a dose cumulativa preconizada pela OMS é de 20 mg/Kg. A grande diversidade de esquemas terapêuticos reflecte provavelmente o facto de o fármaco se acumular nas vísceras e ser depois libertado progressivamente.
Antimoniais pentavalentes
Em todo o mundo os fármacos mais utilizados são os antimoniais pentavalentes (Sb v) cujo mecanismo de acção se relaciona provavelmente com o efeito leishmanicida intramacrófago. Os dois sais mais frequentemente disponíveis e empregues são o estibogluconato de sódio (Pentostam®) e o antimoniato de N-metil-glucamina (Glucantime®), este último o mais utilizado em Portugal. A eficácia e perfil de segurança são comparáveis.
Ambos os compostos podem ser administrados por via IM ou IV. De acordo com recomendações da OMS, deverá ser administrada a dose de 20 mg/kg/dia numa ou duas doses diárias durante 28-30 dias seguidos. Se, após esta série, se verificar a existência de sinais clínicos ou a presença de parasitas na medula óssea, deverá proceder-se a novo curso terapêutico com igual duração.
Dados os efeitos adversos do tratamento (cardiotoxicidade, hepatotoxicidade, pancreatite, artralgias etc.), o mesmo deverá ser acompanhado de vigilância clínica rigorosa, laboratorial e electrocardiográfica (para detecção de possíveis alterações da repolarização, inversão da onda T e aumento do intervalo Q-T).
Está descrita resistência aos antimoniais em cerca de 1% a 2% dos casos.
Miltefosine
É o único componente oral aprovado para o tratamento da doença em adolescentes e adultos com peso mínimo de 30 kg. A dose é de 2,5 mg/kg/dia durante 28 dias.
Apesar de ter um perfil de segurança aceitável, não pode ser utilizado na grávida; por outro lado, em percentagem significativa de doentes (20% a 65%) pode surgir diarreia e vómitos. As transaminases surgem com valores alterados.
A semivida prolongada e a potencial baixa adesão ao tratamento, levanta questões relativamente à possível emergência de resistências.
Paromomicina
Este aminoglicosídeo apresenta actividade contra o parasita, mas os esquemas posológicos variam de acordo com a região (e respectiva Leishmania prevalente). Mais frequentemente a dose usada é de 15 mg/kg/dia durante 21 dias.
Todos os doentes deverão ser seguidos clinicamente durante 1 ano para detecção de eventuais recorrências que poderão surgir, em geral, até 6 meses após conclusão da terapêutica.
Prognóstico
Excluindo as formas subclínicas e assintomáticas, na ausência de tratamento o calazar tem evolução fatal em cerca de 80% dos casos, sendo o risco mais elevado em crianças com menos de 5 anos (síndroma de disfunção multiorgânica traduzido fundamentalmente por edema, síndroma hemorrágica, anemia, insuficiência hepática, pancitopénia e infecções associadas).
Prevenção
As medidas preventivas correspondem, afinal, à intervenção em vários pontos do elo protozoário🡪 reservatório🡪 vector: tratamento dos casos identificados, diminuindo o contacto do homem com o vector, e destruindo os reservatórios e os vectores. Este desiderato é concretizado através de medidas de saneamento e de educação para a saúde coordenadas, identificando as zonas de risco. Na prática, os repelentes e os insecticidas têm papel importante. A vacina aplicada a humanos ainda não está disponível, mas já existe para administração a caninos.
BIBLIOGRAFIA
Bennett JF, Dolin R, Blaser MJ (eds). Mandell, Douglas and Bennett’s Principles and Practice of Infectious Diseases. Philadelphia: Elsevier, 2015
Bergelson JM, Shah SS, Zaoutis TE. Pediatric Infectious Diseases. The Requisites in Pediatrics. Philadelphia: Mosby Elsevier, 2008;401-403
Bhattacharya SK, Dash AP. Treatment of visceral leishmaniasis: options and choice, Lancet Infect Dis 2016;16:142-143
Cascio A, di Martino L, Occorsio P, et al. A 6 day course of liposomal amphotericin B in the treatment of infantile visceral leishmaniasis: the Italian experience. J Antimicrob Chemother 2004;54:217-220
Cherry J, Demmler- Harrison GJ, Kaplan SL, et al (eds). Feigin and Cherry’s Textbook of Pediatric Infectious Diseases. Philadelphia: Elsevier Canada, 2018
Cook GC, Zumla AI (eds). Manson’s Tropical Diseases. Philadelphia: Saunders, 2002
Cox FE. History of human parasitology. Clin Microbiol Rev 2002;15:595-612
Drake LJ, Bundy DA. Multiple helminth infections in children: impact and control. Parasitology 2001;122 Suppl:S73-81
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Goldman L, Schafer AI (eds). Goldman – Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: McGraw Hill Education, 2018
Krepis P, Argyri I, Aggelis A, et al. Childhood visceral leishmaniasis: distinctive features and diagnosis of a re-emergent disease. An 11-year experience from a tertiary referral center in Athens, Greece. Pediatr Infect Dis J 2018;37:419-423
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
Lockhood DNJ, Sundar S. Serological tests for visceral leishmaniasis. BMJ 2006;333:711-712
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
Martins S, Vilares A, Ferreira I, Reis T, Gargaté MJ. Leishmaníase: confirmação laboratorial de casos clínicos suspeitos de infecção entre 2008 e 2013. Bol Epidemiol do Laboratório Nacional de Referência de Infeções Parasitárias e Fúngicas. Lisboa: INSA, 2014
McIntosh N, Helms P, Smyth R, Logan S(eds). Forfar and Arneil’s Textbook of Pediatrics. London: Churchill Livingstone, 2008;1312-1315
Mohebali M, Moradi-Asl E, Rassi Y. Geographic distribution and spatial analysis of Leishmania infantum infection in domestic and wild animal reservoir hosts of zoonotic visceral leishmaniasis in Iran: A systematic review. J Vector Borne Dis 2018;55:173-83
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Murray HW, Berman JD, Davies CR, et al. Advances in leishmaniasis. Lancet 2005;366:1561-1577
No JH. Visceral leishmaniasis: Revisiting current treatments and approaches for future discoveries. Acta Trop 2016;155:113-123
Núncio M, Alves M. Doenças associadas a artrópodes vetores e roedores. Lisboa: Instituto Nacional de Saúde Doutor Ricardo Jorge 2014;63-69
Pijpers J, den Boer ML, Essink DR, et al. The safety and efficacy of miltefosine in the long-term treatment of post-kala-azar dermal leishmaniasis in South Asia – A review and meta-analysis. PLoS Negl Trop Dis. 2019 Feb;13(2):e0007173. doi: 10.1371/journal.pntd.0007173
Remington J, Klein J, Wilson C, Baker C (eds). Infectious Diseases of the Fetus and Newborn Infant. Philadelphia: Saunders, 2006
Strickland GT (ed). Hunter’s Tropical Medicine and Emerging Infectious Diseases. Philadelphia: Saunders, 2000
Sundar SH, Agarwal D. Visceral leishmaniasis-optimum treatment options in children. Pediatr Infect Dis J 2018;5:492-494
Thakur CP. Is elimination of kala-azar feasible by 2017? Indian J Med Res 2016;144:799-802
Varandas L. Viajar com Crianças para Regiões Tropicais. Lisboa: GSK, 2007
Zijlstra EE. Visceral leishmaniasis: a forgotten epidemic. Arch Dis Child 2016;101:561-567