1. VARICELA-ZÓSTER
Definição
As infecções pelo vírus da varicela-zóster (VVZ) são doenças contagiosas exantemáticas vesicobolhosas, de distribuição universal, geralmente benignas e autolimitadas em doentes imunocompetentes.
Importância do problema e etiopatogénese
O vírus da varicela–zóster (VVZ) pertence a um dos 8 membros da família dos Herpesvirus, subfamília Herpesviridae, género Varicelavirus; de grandes dimensões em comparação com outros vírus, com uma estrutura icosaédrica e um núcleo de DNA, cresce dificilmente em cultura de laboratório. Tem semelhanças com o vírus Herpes simplex, que também é um herpes vírus-alfa.
É causa de duas doenças distintas:
- Varicela, correspondente à infecção primária ou primoinfecção; e
- Zona ou herpes-zóster, correspondente a reactivação do vírus latente.
O Homem é o único hospedeiro natural do vírus.
Do ponto de vista clínico, este vírus tem três características muito importantes:
- A sua alta contagiosidade, sendo o único vírus herpes que se transmite por disseminação aérea (aerossóis). A varicela é uma das doenças mais contagiosas na idade pediátrica (taxa de transmissão de 61%-100%);
- A infecção latente dos gânglios das raízes sensoriais, com capacidade de reactivação sob a forma de zona ou herpes-zóster; (ver adiante)
- A presença de sintomas no decurso da infecção primária, em contraste com os outros vírus herpes (nomeadamente VEB e CMV) cuja primoinfecção é muitas vezes assintomática.
A transmissão surge por contacto directo de pessoa a pessoa, ou por intermédio de gotículas de muco ou de saliva eliminadas pelo doente infectado; existe ainda a possibilidade de transmissão por líquidos das vesículas de doentes com herpes-zóster.
O período de incubação é cerca de 15 dias, podendo variar de 10 a 21.
Durante a primeira parte deste período verifica-se replicação do vírus no tecido linfóide local, a que se segue breve período de virémia subclínica (1ª virémia) que veicula o vírus para o SRE. As lesões cutâneas disseminadas ocorrem durante uma 2ª virémia que dura 3-7 dias. As células sanguíneas mononucleares transportam vírus, gerando o aparecimento de novas vesículas durante este 2º período de virémia.
O VVZ é também transportado “de retorno” à mucosa das vias respiratórias superiores na parte final do período de incubação, permitindo a disseminação do vírus a contactos susceptíveis antes do aparecimento do exantema.
Em condições de resposta imune normal (indivíduos saudáveis) há possibilidade de o organismo limitar a replicação do vírus, facilitando a cura. Pelo contrário, nos indivíduos imunodeprimidos (sobretudo em situações associadas a defeitos congénitos de linfócitos T ou a síndroma de imunodeficiência adquirida), a replicação do vírus continua, podendo surgir infecção disseminada com repercussões em vários órgãos.
O vírus é transportado de modo retrógrado através dos neurónios sensoriais/espinhal-medula para os gânglios das raízes dorsais paravertebrais, onde fica em estado latente.
A reactivação subsequente causa herpes-zóster, quadro caracterizado por erupção vesicular distribuída em dermátomo, sendo que a supressão da imunidade celular aumenta o risco de reactivação do VVZ.
Aspectos epidemiológicos
Antes da introdução da vacina antivaricela nos EUA há mais de 14 anos, a maior parte das crianças adquiria infecção até aos 15 anos. Cerca de uma década depois verificou-se declínio de hospitalizações da ordem de 75%, em relação com varicela complicada. Igualmente se verificou diminuição acentuada da mortalidade entre as idades de 1 e 9 anos (menos 90% de óbitos).
No que respeita à idade de manifestação da infecção por VVZ há essencialmente 2 padrões:
- O padrão dos climas temperados, em que se inclui a Europa, com contacto precoce com o vírus; nesta circunstância é, como a varicela, uma doença da idade pediátrica, com pico de incidência no final do Inverno/início da Primavera. Em populações não vacinadas, > 90% dos casos ocorrem antes da adolescência.
- O padrão dos climas tropicais, com infecção protelada até à adolescência e idade adulta, idade com maior probabilidade de evolução mais grave e de aparecimento de complicações.
Em relação à prevalência da infecção, em Portugal, o Segundo Inquérito Serológico Nacional Portugal Continental 2000-2002 revelou que 86,8% da população estudada é seropositiva para VVZ e, tal como noutros países europeus, a infecção por este vírus ocorre predominantemente em crianças. Dos 15 aos 19 anos a seropositividade é 94,2%, após o que se verifica um aumento gradual para 99,3%. Neste estudo, verificou-se também que apenas 2,8% das mulheres nos períodos de maior fertilidade (20-29 anos e 30-44 anos) são susceptíveis.
De acordo com o mesmo inquérito, concluiu-se que a varicela ocorre predominantemente na infância: 41,3% das crianças entre os 2 e os 3 anos já se infectaram com o vírus, aumentando para o dobro dos 6 aos 7 anos.
Num estudo prospectivo, nacional, de Janeiro 2006 a Julho 2007 (19 meses), através de notificação pela Unidade de Vigilância Pediátrica (UVP) de crianças e adolescentes internados por varicela ou zona, identificaram-se 158 casos com uma incidência de complicações de 5,8/100.000/ano. No mesmo estudo concluiu-se que:
- A maioria dos internamentos por complicação da varicela ocorreu em crianças saudáveis (89%), sem factor de risco de varicela grave;
- As complicações mais frequentes foram sobreinfecção bacteriana (49%); neurológicas (8,2%); respiratórias (8,2%); digestivas (5,7%) e hematológicas (0,02%); Streptococcus pyogenes e Staphylococcus aureus foram os agentes mais frequentemente isolados, nas sobreinfecções;
- Não houve óbitos.
A varicela é um problema de saúde pública e em vários países foram demonstrados benefícios com a introdução da vacina nos programas nacionais de vacinação. Em Portugal, uma vez que a doença não é de notificação obrigatória, não existe uma informação precisa sobre o impacte da doença na comunidade.
Manifestações clínicas
1 – Na VARICELA da criança não existe habitualmente período prodrómico, ao contrário do que acontece com o adolescente e o adulto. Este período caracteriza-se por febre, cefaleia, sensação de mal-estar, 1 a 2 dias antes do aparecimento do exantema. Este evolui rapidamente de mácula para vesícula de conteúdo transparente (que se rompe facilmente) e, posteriormente, para crosta, com distribuição crânio-caudal e centrípeta. As crostas destacam-se espontaneamente em cerca de 8 a 15 dias.
É típica a presença de lesões nos vários estádios numa mesma área anatómica. As mucosas podem ser igualmente atingidas, com ulcerações superficiais no palato e vulva. O prurido intenso acompanha geralmente o estádio vesicular do exantema da varicela. Pode verificar-se o aparecimento de linfadenopatias generalizadas. (Figura 1, evidenciado manifestações de exantema muito exuberante)
Os doentes são contagiosos desde cerca de 48 horas antes do início do exantema até à fase em que todas as vesículas se apresentam na forma de crosta (5 a 10 dias).
A varicela é uma doença de evicção escolar obrigatória.
2 – A ZONA surge por reactivação do VVZ, o qual ficou latente nos gânglios das raízes sensoriais a seguir a infecção aguda; ocorre raramente (em cerca de 5% dos casos de varicela anterior: ~ 5% até aos 15 anos, e ~ 10%-15% na idade adulta); manifesta-se sobretudo nas seguintes circunstâncias:
- Infecção primária in utero;
- Quadros clínicos com imunossupressão (como foi referido antes, sobretudo défice da imunidade celular), em que há probabilidade de herpes-zóster mais exuberante e mais grave, com risco de disseminação cutânea, compromisso visceral e tendência para a cronicidade. A incidência é cerca de 15% nas crianças que já tiveram leucemia, e ~ 30% nos receptores de transplante medular e nos infectados pelo VIH;
- Envelhecimento, a partir dos 50 anos; se um indivíduo viver até aos 80 anos aumenta a probabilidade de adquirir infecção zóster, que é tanto mais grave quanto mais tardio o seu aparecimento. (ver atrás)
Esta forma clínica caracteriza-se por uma erupção unilateral, por vezes acompanhada de linfadenopatia regional. Na fase de pré-erupção existe dor, mal-estar, febre, hiperestesia, sensação de “queimadura” ao longo de uma área limitada de pele de trajecto mais ou menos rectilíneo, suprida por nervos sensitivos de um ou dois gânglios das raízes dorsais, (dermátomo); no adolescente e adulto a dor relaciona-se com neurite aguda.
Surge, ao cabo de alguns dias, a erupção de pápulas que rapidamente se transformam em vesículas segundo um trajecto mais ou menos rectilíneo (ou paralelamente, em dois trajectos se estiverem em causa dois dermátomos), progredindo até à fase de crosta em cerca de 5 a 7 dias. Em cerca de um terço dos casos poderá verificar-se a ocorrência de vesículas “vizinhas” que ultrapassam o limite do dermátomo.
Embora raramente, poderá a zona ter localização ao nível do trajecto do nervo trigémio, acompanhando-se as lesões cutâneas de conjuntivite, ceratite e iridociclite. Outro possível nervo craniano afectado é o facial. Neste caso a tradução clínica mais típica é paralisia facial e aparecimento de vesículas no canal auditivo externo (síndroma de Ramsay-Hunt).
A nevralgia pós–zóster, mantida por vezes 2 a 3 meses, é rara em idade pediátrica.
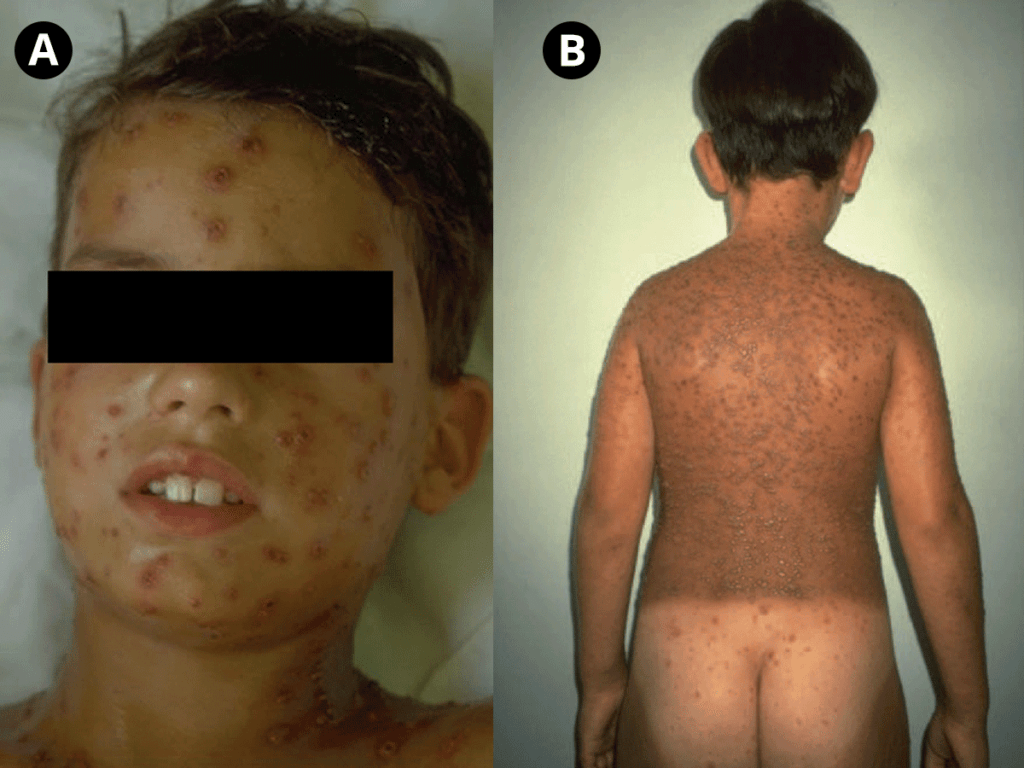
FIGURA 1. A) Varicela – predomínio de vesículas visualizando-se algumas crostas; B) Varicela confluente com predomínio de vesículas; zona nadegueira protegida da luz, menos exuberante em lesões (fotoprotecção). (NIHDE)
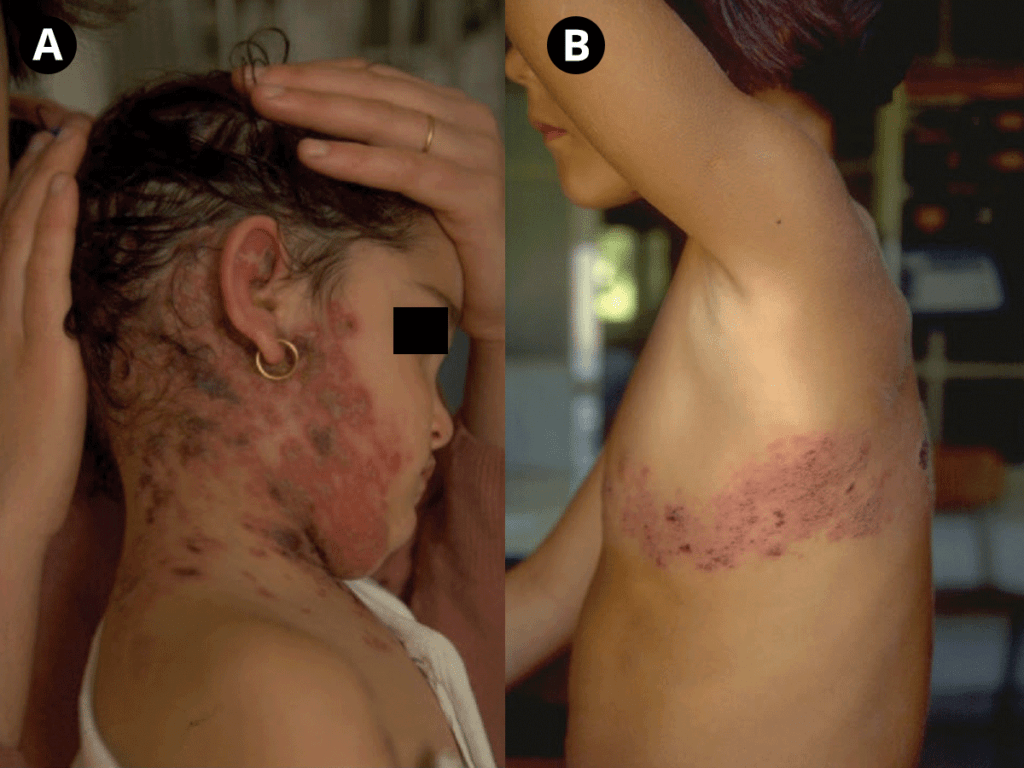
FIGURA 2. A) Herpes-zóster: lesões na área do trigémio; B) Herpes-zóster de localização torácica; lesões de trajecto rectilíneo ao longo dos nervos intercostais acompanhando a direcção das costelas. (NIHDE)
Factores de gravidade
No que se refere à gravidade da doença verifica-se um aumento da morbilidade e mortalidade na mulher grávida susceptível, e no feto. A síndroma da varicela congénita caracteriza-se por lesões do SNC, globo ocular (cegueira), cicatrizes cutâneas permanentes e defeitos dos membros, com incidência de 2% nas primeiras vinte semanas de gravidez.
Esta situação é distinta da varicela perinatal, surgindo no recém-nascido quando a mãe contrai varicela no período entre 5 dias antes do parto e 5 dias depois. A varicela perinatal é geralmente muito grave pois, para além da imaturidade imunológica do recém-nascido, nesta fase não houve ainda passagem transplacentária de anticorpos maternos que seriam um factor de protecção. A terapêutica com imunoglobulina específica e aciclovir tem melhorado muito o prognóstico destes doentes.
Para além destes dois quadros clínicos, há um risco acrescido de complicações para a mulher e para o feto na varicela contraída no último trimestre, respectivamente pneumonia e disseminação da doença.
A gravidade da varicela é maior no adulto, com maior morbilidade e mortalidade: o número de lesões é maior, os sintomas sistémicos mais duradouros e as complicações mais frequentes, tendo sido verificado nalguns estudos que a encefalite é sete vezes mais frequente que na criança, e a mortalidade vinte e cinco vezes maior.
O risco de varicela grave é também maior nas síndromas acompanhadas de imunodeficiência, especialmente nos casos de doença maligna sob quimio ou radioterapia, no caso de corticoterapia em altas doses e nos defeitos da imunidade celular.
Por este motivo, as complicações da varicela passaram a ser mais frequentes à medida que maior número de crianças com doença maligna, transplantação de órgãos ou asma grave, foi sendo tratado com sucesso. Igualmente nos casos de SIDA, têm sido descritos casos graves e fatais. Doentes submetidos a terapêutica prolongada com salicilatos também têm maior risco de doença grave e complicações.
A infecção congénita é abordada na Parte sobre Perinatologia/Neonatologia.
Complicações
A partir da década de 90 passou a verificar-se aumento de complicações na criança saudável e sem factores de risco prévios, nomeadamente cutâneas, respiratórias e neurológicas.
No que se refere às complicações cutâneas, especialmente na varicela, salienta-se o papel de Streptococcus pyogenes, responsável por situações muito graves como a fascite necrosante. É controverso se as complicações cutâneas e sistémicas estão associadas a toma prévia de anti-inflamatórios não esteróides como nimesulido e ibuprofeno, pelo que estas drogas não devem ser prescritas no decurso da varicela. A medicação com salicilatos antes e durante a doença relacionou-se com o aparecimento de síndroma de Reye.
Outras complicações descritas na literatura em relação com infecções por VVZ em geral, incluem: meningite asséptica, síndroma de Guillan-barré, encefalite (nalguns casos em relação com o próprio vírus), ataxia cerebelar (por mecanismo imunológico, sem acção directa do vírus), púrpura trombocitopénica concomitante com a doença aguda ou de aparecimento a posteriori.
Exames complementares
Na prática, em situações correntes, o diagnóstico é essencialmente clínico-epidemiológico. Em situações especiais ou em casos complicados poderá estar indicada a realização de exames complementares: por microscopia electrónica para estudo citológico (pesquisa de corpos de inclusão, células gigantes) e isolamento do vírus no fluido das vesículas ou nos produtos de raspagem das lesões.
A pesquisa de DNA por PCR (reacção em cadeia da polimerase), mais sensível que a imunofluorescência, pode ser feita no raspado das lesões cutâneas, saliva e líquido céfalo-raquidiano cutâneas, saliva e LCR. Também pode ser utilizada para diferenciar a estirpe selvagem da estirpe vacinal (OKA). O isolamento através de cultura de células é pouco utilizado.
Para confirmar a infecção poderão utilizar-se provas serológicas como provas de fixação do complemento, pesquisa de anticorpos fluorescentes para os antigénios de membrana, métodos ELISA, radioimunoensaio, etc..
Para confirmar o estado de imunidade relativamente à varicela após vacina, pode recorrer-se ao estudo serológico. Nalguns centros, para confirmar o estado de imunidade relativamente à varicela procede-se a uma prova intradérmica utilizando a estirpe OKA inactivada do vírus. Tal prova evidenciou sensibilidade e especificidade ~ 95%, comparável à obtida com o estudo serológico com pesquisa de anticorpos fluorescentes.
Tratamento
O tratamento da maioria dos casos é sintomático.
O doente internado com varicela deve ser isolado, com precauções de transmissão de contacto e via aérea.
Se a criança estiver febril, deve ser administrado paracetamol, não devendo ser administrados salicilatos nem anti-inflamatórios não esteróides.
Os banhos de amido são, regra geral suficientes para o bem-estar da criança. Igualmente não se utiliza a aplicação de tópicos. Em relação ao prurido, a terapêutica com anti-histamínicos pode ser administrada.
Os pais e mais directos responsáveis pelos cuidados a prestar à criança doente devem ser instruídos no sentido de procederem ao corte das unhas e de correcta lavagem das mãos de modo a diminuir o risco de sobreinfecção bacteriana.
As roupas devem ser de algodão e fáceis de despir, sem traumatizar a pele. Os banhos estão indicados, com a água à temperatura habitual, mas deverão ser rápidos, tendo o cuidado de secar a criança sem friccionar o corpo com a toalha.
As crianças com varicela não complicada podem regressar à escola após todas as lesões estarem em fase de crosta.
A terapêutica com aciclovir não é recomendada para uso generalizado na criança saudável com varicela. Quando indicada, deve ser iniciada o mais precocemente possível (idealmente nas primeiras 24 horas, logo após início do exantema; é inútil após o 3º dia de evolução da doença).
O aciclovir oral (20 mg/kg/dose até máximo de 800 mg/dose, em 4 tomas diárias durante 5 dias) está indicado em crianças com risco aumentado de doença grave: adolescentes; doenças crónicas dermatológicas ou pulmonares; terapêutica mantida com salicilatos; terapêutica com corticóides, de curta duração, intermitente ou por aerossóis; casos secundários num agregado familiar (os casos secundários são geralmente mais graves). O valciclovir (20 mg/kg/dose, máximo 1000 mg, 3x dia, 5 dias) também pode ser utilizado, em crianças dos 2-18 anos. O aciclovir endovenoso está indicado nos doentes imunodeprimidos (5-10 mg/kg/dose de 8-8 horas durante 7 a 10 dias) ou em complicações graves, como encefalite por VZV.
No herpes-zóster o aciclovir abrevia a cura das lesões cutâneas, reduz o tempo de evolução da neurite aguda, assim como o risco de nevralgia pós-fase aguda. Está igualmente indicado nos casos de doentes com imunodepressão, contribuindo para diminuir o risco de disseminação visceral.
O tratamento das infecções cutâneas secundárias é abordado noutros capítulos.
Prevenção
Imunização passiva – Imunoglobulina humana antivaricela zoster (IgVZ)
A imunoglobulina antivaricela zóster (IgVZ) deve ser administrada para prevenir a varicela em doentes que não têm imunidade para o vírus e que apresentam risco de complicações graves se adquirirem a infecção. A IgVZ deve ser administrada o mais precocemente possível após exposição, com limite máximo de 96 horas para a forma endovenosa, e 72 horas para a forma intramuscular; e, de preferência, nas primeiras 48 horas. A varicela após IgVZ é, regra geral, mais benigna mantendo-se, contudo, contagiosa.
A decisão de administrar IgVZ deve fundamentar-se em três parâmetros: susceptibilidade à doença; probabilidade de a exposição resultar em infecção; risco de complicações graves.
Aos indivíduos com risco de complicações graves, com exposição continuada ao vírus, deve ser feita uma segunda administração de IGVZ passadas três semanas.
Os doentes sob terapêutica mensal com altas doses de IGIV estarão muito provavelmente protegidos se a última administração tiver ocorrido menos de 3 semanas antes da exposição. A IgVZ interfere com a resposta imunológica às vacinas vivas, especialmente VASPR nos 5 meses subsequentes à sua administração, razão pela qual o calendário vacinal da criança a quem foi administrada IgVZ deve ser adaptado a esta circunstância.
Se não for respeitado o intervalo entre IgVZ e VASPR deve proceder-se à titulação dos anticorpos para VASPR, um mês após a vacinação.
A IgVZ não é recomendada para indivíduos já vacinados contra a varicela.
A IgVZ não deve ser usada indiscriminadamente já que condiciona apenas uma protecção temporária de cerca de 3 semanas (um caso de varicela numa enfermaria não implica a prescrição alargada de IGVZ baseada apenas na susceptibilidade à doença).
Vacina antivaricela
A propósito desta medida de prevenção, sugere-se a consulta do Capítulo sobre Imunizações e Vacinas.
Considera-se actualmente que a administração de duas doses confere uma maior protecção.
Estão descritos casos de varicela surgindo algum tempo após a vacinação, por falência vacinal secundária devida a uma perda progressiva, ao longo do tempo, da imunidade contra o vírus (breakthrough disease). Esta eventualidade poderá ser minorada com o esquema vacinal de duas doses.
2. CITOMEGALOVÍRUS
Definições e aspectos epidemiológicos
O citomegalovírus humano (CMV) é um vírus ADN da família Herpesviridae, ubiquitário na comunidade. A prevalência da infecção por CMV aumenta com a idade, é mais elevada nos países em desenvolvimento e nos estratos socioeconómicos mais precários.
Na maioria, as infecções por CMV são assintomáticas; contudo, o espectro de manifestações é amplo, entre infecções ligeiras e fatais. Certos grupos populacionais são considerados de risco, como os recém-nascidos e os imunodeprimidos, nomeadamente as imunodeficiências primárias com disfunção das células T e NK, transplantados e os portadores de infecção por VIH. Em indivíduos imunocompetentes a infecção por CMV poderá apresentar-se como mononucleose infecciosa.
A infecção congénita é abordada na Parte sobre Perinatologia/Neonatologia.
Considera-se infecção primária a que ocorre num indivíduo susceptível, seronegativo. Infecção recorrente é a que surge por reactivação de infecção latente ou por reinfecção de hospedeiro imune-seropositivo. Doença por CMV poderá resultar de infecção primária ou recorrente, sendo que no primeiro caso existe maior probabilidade de quadro clínico mais grave.
Em países em desenvolvimento, a maioria das crianças é infectada até aos 3 anos de idade; em países desenvolvidos, a infecção ocorre geralmente na infância e adolescência, sendo que 60%-80% da população já teve a infecção quando chega à idade adulta.
Etiopatogénese
Da família Herpesviridae fazem parte também outros vírus: Epstein-Barr (VEB), herpes simplex 1 e 2, varicela-zoster, e herpesvirus 6, 7 e 8. Como qualquer herpesvírus, tem a característica de se manter latente no organismo, o que condiciona a possibilidade de reactivação. (ver atrás)
Estão descritos diversos modos de transmissão:
- Congénita: via placentária. A incidência de infecção congénita por CMV varia de 0,2%-2,4%;
- Perinatal: secreções vaginais (parto), leite materno (incidência de 10%-60% nos primeiros seis meses de vida), urina, saliva ou por transfusão;
- Crianças: saliva, lágrimas, leite materno, urina (taxa de infecção de 50%-80%); sobretudo na infância; as creches contribuem para a disseminação da doença nesta faixa etária;
- Adolescentes: sémen, secreções vaginais; durante este período ocorre um segundo pico de infecção devido à transmissão sexual;
- Outros: intrafamiliar, transfusões de sangue e derivados (infecção por resíduos de leucócitos no derivado), transplante de órgãos.
A doença clínica resulta fundamentalmente dos seguintes factores:
- Depressão da imunidade celular (sobretudo de células T e NK); a imunidade humoral não parece ser tão importante, sendo a presença de anticorpos contra CMV indicador de infecção prévia ou recente e não um marcador de imunidade por si;
- Replicação vírica intensa com consequente aumento da respectiva carga; alguns genótipos estão associados a doença mais grave
- Compromisso multiorgânico por efeito citopático directo dos vírus, sobretudo em determinados órgãos-alvo.
O vírus induz reacção inflamatória com infiltração celular focal por células mononucleadas. Os órgãos mais afectados são o pulmão, fígado, rins, aparelho gastrintestinal, glândulas salivares e outras glândulas exócrinas. Pode surgir necrose focal no cérebro e fígado, acompanhada de granulomas com calcificações.
A presença de CMV intracelular e a replicação do vírus incrementa a expressão de mediadores inflamatórios como citocinas e quimocinas; as células infectadas aumentam de tamanho e podem conter inclusões (grandes, intranucleares, e mais pequenas, intracitoplásmicas) podem conter inclusões que são patognomónicas da infecção por CMV (doença de inclusões citomegálicas).
Manifestações clínicas e laboratoriais
As manifestações clínicas são variáveis e influenciadas pelo momento em que ocorre a transmissão da doença (congénita, perinatal ou pós-natal), idade do doente e concomitância, ou não, de imunodeficiência.
Uma vez que a infecção perinatal é abordada na Parte sobre Perinatologia/Neonatologia, é dada ênfase às manifestações pós-neonatais.
Na sua maioria, as crianças imunocompetentes com infecção por CMV são assintomáticas; em cerca de 10% dos casos surge febre, tosse, cefaleia, dor abdominal com diarreia, artralgias, mialgias; por vezes, exantema petequial ou morbiliforme, linfadenopatias e hepatoesplenomegália. Em crianças mais velhas e adolescentes, o quadro é semelhante à mononucleose infecciosa, com elevação de ALT e AST, e linfocitose atípica, febre, fadiga, faringite, adenopatia (sobretudo cervical) e hepatite. Podem surgir manifestações ou complicações pouco frequentes em doentes previamente saudáveis. Nos doentes imunocomprometidos (sobretudo em casos de SIDA e de doentes transplantados) existe risco aumentado de infecção primária ou recorrente, incluindo febre isolada, leucopénia, pneumonite intersticial, miocardite, hepatite, coriorretinite, doença gastrointestinal (ulcerações submucosas, pancreatite, colecistite, colite), e compromisso do sistema nervoso central, com meningoencefalite ou síndroma de Guillain-Barré.
Diagnóstico
Antes da abordagem desta alínea, importa recordar conceitos: o conceito de infecção é biológico e o conceito de doença é clínico, traduzindo, em princípio, a presença de sintomatologia.
Assim, é importante diferenciar entre infecção e doença por CMV:
- Infecção por CMV define-se como evidência de replicação de CMV independentemente da existência ou não de sinais ou sintomas;
- Doença por CMV define-se como evidência de infecção por CMV com sinais e sintomas acompanhantes.
As modalidades diagnósticas disponíveis incluem serologia, PCR CMV qualitativa e quantitativa, antigenémia pp65, exame cultural e exame histopatológico.
O diagnóstico de infecção primária em indivíduos imunocompetentes baseia-se na detecção de IgM CMV (surgindo nas primeiras 2 semanas após o aparecimento dos sintomas e podendo persistir até 6 meses após o início dos sintomas), ou na detecção simultânea de IgM e IgG de baixa avidez, ou na seroconversão (um aumento 4 vezes do título de IgG com 2-4 semanas de intervalo). Durante as primeiras semanas após infecção primária, a avidez funcional dos anticorpos da classe IgG é muito baixa, atingindo o pico 4-5 meses depois. Os anticorpos IgG geralmente só são detectados 2-3 semanas após o início da sintomatologia e persistem por toda a vida. Os imunocomprometidos graves podem ser seronegativos, apesar de infectados.
A cultura vírica convencional é morosa e demora algumas semanas, mas pode ser utilizada em várias amostras.
As técnicas de amplificação de ácidos nucleicos existem em vários laboratórios e são sensíveis para detectar o DNA do CMV, determinar a carga vírica e monitorizar a resposta à terapêutica, sobretudo nos doentes imunodeprimidos.
A biópsia de tecidos é útil para o diagnóstico de doença invasiva tecidual por CMV, sobretudo em imunodeprimidos. O exame histopatológico pode evidenciar a presença de corpos de inclusão, tipicamente inclusões intranucleares basófilas, embora também se possam observar inclusões no citoplasma dos eosinófilos. A sensibilidade deste teste pode ser melhorada com coloração imuno-histoquímica.
O exame cultural, laborioso, necessita de várias semanas para o vírus crescer.
No paciente em estado de imunossupressão, quando não é possível a biópsia tecidual, o aumento da carga vírica no sangue pode fundamentar o diagnóstico.
Nalgumas amostras, a detecção do vírus por exame cultural ou PCR (este último, muito sensível) não confirma doença activa por CMV, pois pode haver excreção do vírus pela urina, secreções respiratórias e fezes por períodos prolongados de tempo, mesmo na ausência de doença clínica.
A distinção entre reactivação de vírus endógeno e reinfecção com estirpe diferente de CMV requer técnicas especiais com análise do ADN do vírus (com enzimas de restrição ou determinação de anticorpos específicos para epitopos do CMV, por ex. glicoproteína H).
Como nota final, cabe referir que nos doentes imunocomprometidos é habitual haver excreção aumentada de CMV, mesmo em presença de títulos elevados de IgG e de IgM, o que pode dificultar a destrinça entre infecção primária e recorrente.
Tratamento
No hospedeiro imunocompetente não está indicada qualquer terapêutica específica.
No contexto de doentes com imunossupressão utiliza-se o ganciclovir associado ou não à IGIV standard ou à IGIV hiperimune-CMV. Um dos esquemas utilizado é o seguinte:
- ganciclovir IV (5 mg/kg/dose 12/12h ev durante 2-3 semanas, seguido de manutenção 5 mg/kg em dias alternados ou 5 dias/semana) + IGIV/CMV (400 mg/kg/dia, em esquemas diferentes).
Verifica-se, como resultado desta terapêutica, diminuição da carga vírica CMV dentro de 1 semana em 70%-80% dos doentes. Na ausência de resposta clínica ou virológica deve suspeitar-se de resistência ao fármaco antivírico.
Outros antivíricos podem ser usados: foscarnet (menor experiência em crianças) e cidofovir.
Nas formas ligeiras de infecção por CMV pode utilizar-se valganciclovir oral (16 mg/kg/dose 12/12h oral).
O ganciclovir tem diversos efeitos tóxicos, nomeadamente supressão medular, alterações hepáticas, redução da espermatogénese; e cancerígeno e potencialmente teratogénico.
O ganciclovir e valganciclovir têm excreção renal.
Prevenção
Na prevenção devem ser consideradas as seguintes medidas:
- Medidas de protecção pessoal;
- Vacina (ainda em estudo);
- Esterilização do leite de mães seropositivas para RN pré-termo;
- IGIV no período pré-transplante de órgãos (visto que o doente transplantado comporta risco acrescido de aquisição de infecção grave por CMV);
- Utilização de sangue e derivados de dadores com anticorpos negativos para CMV a RN pré-termo e doentes imunocomprometidos (sobretudo pós-transplante e com infecção por VIH); se tal não for possível, utilização de sangue desleucocitado;
- Se possível, utilização de órgãos de dadores livres de CMV.
Prognóstico
O prognóstico é variável consoante a data da infecção. No caso de infecção congénita, geralmente surgem sequelas neurossensoriais graves como surdez (5%-10%), coriorretinite (3%-5%), microcefalia, atraso mental ou motor. A infecção no período perinatal raramente origina sequelas.
A maioria dos doentes imunocompetentes recupera completamente. Como regra, nos imunodeprimidos o prognóstico é variável consoante a doença de base e o grau de imunossupressão.
3. VÍRUS de EPSTEIN-BARR (VEB)
Aspectos epidemiológicos
O vírus de Epstein-Barr (VEB) tem uma distribuição mundial. Nos países em vias de desenvolvimento, a infecção é geralmente muito precoce e assintomática. Nos países desenvolvidos a infecção surge habitualmente na adolescência e no adulto jovem, sendo a mesma frequentemente sintomática.
Cerca de 85% a 95% dos adultos têm anticorpos anti-VEB. Portugal segue o padrão dos países desenvolvidos de acordo com estudos do INSA/Instituto Nacional de Saúde Dr. Ricardo Jorge. A incidência anual varia, de acordo com diversas estatísticas, grupos etários e regiões do globo, entre 20 a 70/ 100.000 indivíduos. A infecção por VEB pode ser assintomática ou comportar-se como uma infecção vírica ligeira e inespecífica.
A entidade clínica conhecida por mononucleose infecciosa (MNI) tem como causa mais frequente a primoinfecção por VEB, síndroma associada ao desenvolvimento de linfomas de células B e T, linfoma de Hodgkin, linfomas primários do SNC em doentes com SIDA e carcinomas nasofaríngeos. Salienta-se que existem outras causas de “síndromas mononucleósicas”.
Etiopatogénese
O vírus de Epstein-Barr (VEB) é um vírus de DNA pertencente à família dos Herpesviridae.
A transmissão faz-se pela saliva, sangue e, possivelmente, por contacto sexual. O vírus penetra na cavidade oral, invade as células epiteliais e as glândulas salivares, causando virémia, infecção dos linfócitos B e sistema reticuloendotelial (SRE), estimulando uma resposta imune e a formação de linfócitos atípicos (linfócitos T CD8+ que aumentam em valor absoluto e relativo).
Nos adultos, este aumento de linfócitos T CD8+ resulta numa inversão transitória da relação normal de 2/1 de linfócitos T CD4+/CD8+ ou (helper/supressor), sendo menos marcada nas crianças.
Pondo em contacto secreções da orofaringe de doentes afectados por mononucleose infecciosa com linfócitos B humanos, estes são transformados espontaneamente por acção do vírus em linhas celulares linfoblastóides; por isso se chama a este vírus o agente transformador de linfócitos.
Após infecção primária, o VEB permanece latente em múltiplos epissomas dos núcleos dos linfócitos B, o que corresponde, de facto, a um estado de infecção de longa duração, clinicamente inaparente. Para além da capacidade de latência, o agente infeccioso tem capacidade de reactivação e de incorporação genómica nas células do hospedeiro, o que se repercute nas características genéticas destas últimas.
Pode, pois, considerar-se que a infecção por VEB corresponde a uma doença linfoproliferativa, já que representa uma “guerra civil linfocitária” em que os linfócitos T activados, que correspondem aos linfócitos atípicos do sangue periférico, tentam destruir os linfócitos B infectados pelo vírus, sendo esta reacção imunológica a principal responsável pelas diversas manifestações da doença.
Nos gânglios e baço verifica-se uma reacção inflamatória inespecífica com hiperplasia das células do SRE e predomínio de linfócitos normais e atípicos. No fígado podem ser evidentes sinais de necrose e distensão dos espaços porta por exsudado inflamatório constituído sobretudo por linfócitos, sem alterações, e atípicos.
Após descrição sucinta de aspectos epidemiológicos e etiopatogénese da infecção por VEB em geral, procede-se à abordagem clínico-laboratorial específica das formas clínicas: 3.1, 3.2 e 3.3.
Por fim, são focados aspectos genéricos do diagnóstico, tratamento e prognóstico das infecções por VEB em geral.
3.1 MONONUCLEOSE INFECCIOSA
Definição e manifestações clínicas
A mononucleose infecciosa (MNI) clássica é uma síndroma clínica aguda de causa infecciosa que tem como agente etiológico mais frequente o vírus de Epstein-Barr. O período de incubação varia entre 4-6 semanas, podendo o início ser agudo ou insidioso. É caracterizada essencialmente por febre, adinamia, amigdalite frequentemente exsudativa, faringite, e linfadenopatia cervical ou generalizada. Conforme o predomínio de um ou de outro sinal ou sintoma, poderão ser descritas formas febris, amigdalinas, ou ganglionares.
Podem surgir também dor abdominal, náuseas, vómitos, dificuldade respiratória, edema palpebral, esplenomegália e hepatomegália, petéquias no palato e exantema maculopapular ou morbiliforme.
O exantema pode estar associado à administração de ampicilina (ou amoxicilina), sobretudo nos adultos. A fadiga pode ser proeminente.
A designação popular de “doença do beijo” e de “doença dos noivos” sublinha o facto de o agente da doença se poder transmitir muitas vezes pela saliva. A designação antiga de “febre ganglionar” traduz a comparticipação do sistema linfóide nesta entidade clínica.
Em suma, a tríade linfadenopatias, faringoamigdalite exsudativa e muito dolorosa, e esplenomegália num doente febril é típica – conquanto não patognomónica – de MNI.
Exames complementares
A leucocitose (10.000-20.000/mm3) é mais frequente do que a leucopénia; observa-se, regra geral, predomínio de linfócitos, com linfócitos atípicos pleomorfos, que correspondem aos linfócitos T activados.
A trombocitopénia ligeira é referida na literatura (20.000-50.000/mm3) em mais de 50% dos doentes; habitualmente comprova-se uma elevação ligeira a moderada das transaminases (ALT e AST).
Diagnóstico diferencial
Apesar de, tal como foi referido, o agente etiológico mais frequente da síndroma de mononucleose infecciosa ser o VEB, há que considerar outros agentes causais da referida síndroma, nomeadamente citomegalovírus (CMV), Toxoplasma gondii, vírus das hepatites A, B e C (VHB, VHC) e, por vezes, VIH.
As situações acompanhadas de leucocitose muito acentuada põem problemas de diagnóstico diferencial com leucemia aguda. Quando a elevação das transaminases predomina há que considerar a hipótese de hepatite aguda por vírus. A amigdalite da infecção por VEB deve ser distinguida da amigdalite estreptocócica (se bem que por vezes haja co-infecção por estes dois agentes), da diftérica e de outras amigdalites por outros agentes víricos como adenovírus.
3.2 INFECÇÃO PRIMÁRIA por VEB
Em crianças pequenas, a infecção por VEB é frequentemente assintomática. Quando existe sintomatologia, as manifestações são variáveis: otite média, diarreia, queixas abdominais, infecção das vias respiratórias superiores, e quadro semelhante ao descrito para a entidade clínica “mononucleose infecciosa”.
A infecção primária por VEB pode causar dum modo geral diversas manifestações, por vezes com complicações graves:
- Alterações hematológicas (anemia hemolítica, trombocitopénia, anemia aplásica, púrpura trombótica trombocitopénica, síndroma hemolítica-urémica, coagulação intravascular disseminada;
- Ruptura esplénica (mais frequente durante a segunda semana de doença, embora possa surgir como apresentação clínica inicial;
- Sintomas neurológicos (meningoencefalite, paralisia do nervo facial, síndroma de Guillain-Barré, meningite asséptica, mielite transversa, neurite periférica e neurite óptica);
- Pneumonia, ou outras complicações respiratórias com obstrução das vias aéreas por hiperplasia do tecido linfóide;
- Miocardite ou pericardite;
- Pancreatite, adenite mesentérica ou hepatite fulminante;
- Glomerulonefrite;
Como particularidades de algumas formas de infecção primária citam-se:
- Sobreinfecção bacteriana, sobretudo por Streptococcus-hemolítico do grupo A, abcessos cervicais ou periamigdalinos;
- Associação a síndroma de Gianotti-Crosti (constando de exantema simétrico pápulo-eritematoso podendo confluir em placas, com a duração de 15-20 dias e localização predominante nas extremidades e nádegas). Este quadro imita a dermatite atópica.
3.3 OUTRAS FORMAS CLÍNICAS de INFECÇÃO por VEB
Estão descritas alterações genéticas hereditárias determinando resposta anómala traduzida por maior gravidade ou tendência para a cronicidade da infecção por VEB. Como exemplos, são referidas mutações de genes SAP ou XIAP, ITK, MAGT1 (XMEN). (ver adiante)
Nesta perspectiva são descritas as seguintes formas clínicas:
- Forma crónica activa: os sintomas são persistentes por mais de 6 meses, os títulos de IgG VCA são elevados (ver adiante), há evidência histológica de envolvimento focal e a virémia é elevada;
- Síndroma hemofagocítica ou linfo-histiocitose hemofagocítica (HLH): esta situação, pouco frequente, é caracterizada por febre, hepatoesplenomegália, pancitopénia, hipertrigliceridémia e/ou hipofibrinogenémia, com fagocitose das células sanguíneas e seus precursores, actividade deficiente das células T/NK e produção anárquica de citocinas. Devem ser excluídas as formas familiares de HLH, associadas a mutação da perforina, MUNC13-4 e UNC13D;
- Doenças linfoproliferativas: a infecção por VEB pode ser considerada um “cancro abortado”, tendo-se demonstrado que o referido vírus possui um elevado potencial oncogénico. Exemplos dessas patologias são a doença linfoproliferativa ligada ao X ou síndroma de Duncan (por mutação SAP ou XIAP), linfoma de Burkitt, carcinoma nasofaríngeo, linfomas de células B ou T e a doença de Hodgkin.
O poder oncogénico do vírus expressa-se de modo diferente consoante as regiões geográficas. Por exemplo, o linfoma de Burkitt predomina na África Equatorial, entre o Trópico de Capricórnio e o Trópico de Câncer, e ainda na Papua Nova Guiné; o cofactor mais importante para o aparecimento desta patologia é a malária, nomeadamente por Plasmodium falciparum: a exposição contínua à malária actua como mitogénico dos linfócitos B infectados pelo vírus, diminuindo, por efeito sobre a imunidade celular, o controlo exercido pelas células T.
A doença de Hodgkin tem um pico de incidência na infância nos países em desenvolvimento, enquanto nos países desenvolvidos a incidência é maior no adulto jovem, o que coincide com o perfil da infecção por VEB nesses países; - Doença linfoproliferativa pós-transplante: resulta da ausência de vigilância imune efectiva contra o VEB, pela imunossupressão. Surge habitualmente febre e infiltração linfomatosa disseminada (gânglios, fígado, baço, rim, pulmão, SNC e intestino). É mais frequente nas situações decorrentes do transplante de órgão sólido, sobretudo intestino e pulmão.
Diagnóstico
O diagnóstico de infecção por VEB pode ser suspeitado pelos dados clínicos e por certos achados laboratoriais característicos.
A confirmação do diagnóstico de infecção por VEB baseia-se na demonstração de diversos tipos de anticorpos específicos anti-VEB: VCA (viral capside antigen) IgG e IgM, EBNA (nuclear antigen), EA (early antigen); cada tipo de anticorpo é detectável em fases diferentes da infecção:
- VCA-IgM – anticorpo surge na fase precoce da doença aguda (geralmente nas primeiras duas semanas de infecção); desaparece após vários meses de infecção; nesta fase há ausência de anticorpos EBNA. A existência de factor reumatóide pode causar um resultado falso positivo;
- VCA-IgG – persiste durante toda a vida após infecção inicial;
- EA – associa-se à replicação vírica; presente em 70%-80% casos de doença aguda, desaparece após 6 meses;
- EBNA – tardio, surge cerca de 6-12 semanas após infecção, persiste para o resto da vida.
Em suma, a detecção de VCA-IgM e IgG constitui a prova serológica mais valiosa e específica para o diagnóstico de infecção por VEB, na ausência de EBNA, sendo geralmente suficiente para confirmar o diagnóstico de infecção aguda.
Como provas qualitativas de aglutinação, citam-se:
- Prova de Paul-Bunnell-Davidsohn, em que se pesquisa a aglutinação de eritrócitos de espécies diferentes (carneiro, cavalo, etc.), empregando soro do doente contendo anticorpos/aglutininas que se formam no decurso da MNI; como aglutinam eritrócitos de outras espécies, tais anticorpos são chamados heterófilos;
- Monospot test, que constitui uma variante da metodologia descrita antes.
Estas provas evidenciam habitualmente valores falsos positivos em menos de 10% dos casos e elevado número de resultados falsos negativos em crianças pequenas.
A detecção de DNA do VEB por técnicas moleculares no sangue, LCR e noutros produtos biológicos, tem utilidade nos doentes imunossuprimidos, em que a resposta imunológica poderá estar ausente, e em situações clínicas mais complexas. Embora por vezes difícil de avaliar, a monitorização da carga vírica do VEB no sangue é importante na síndroma linfoproliferativa pós-transplante e em doenças malignas.
Diagnóstico diferencial
Apesar de, tal como foi referido, o agente etiológico mais frequente da síndroma de mononucleose infecciosa ser o VEB, há que considerar outros agentes causais originando “síndromas mononucleósicas” nomeadamente citomegalovírus (CMV), Toxoplasma gondii, vírus das hepatites B e C (VHB, VHC) e, por vezes, VIH. As situações acompanhadas de leucocitose muito acentuada põem problemas de diagnóstico diferencial com leucemia aguda.
Quando a elevação das transaminases predomina há que considerar as hepatites agudas por vírus. A amigdalite da infecção por VEB deve ser distinguida da amigdalite estreptocócica (se bem que por vezes haja co-infecção por estes dois agentes), da diftérica e de outras amigdalites por outros agentes víricos como adenovírus.
Tratamento
Não existe tratamento específico para a síndroma de mononucleose infecciosa. O tratamento é geralmente de suporte, visto que a doença é autolimitada. Se existir fadiga debilitante aconselha-se repouso no leito. Os desportos de contacto devem ser evitados enquanto houver esplenomegália ou alterações da coagulação devido ao risco de ruptura esplénica.
A terapêutica com aciclovir, ganciclovir ou foscarnet diminui a replicação vírica e a disseminação orofaríngea durante o período de administração, mas não reduz a gravidade ou duração dos sintomas, nem altera o prognóstico, pelo que não é aconselhado.
Pequenos cursos de corticosteróides poderão ter utilidade nos casos de complicações da doença, nomeadamente nos casos de dificuldade respiratória por inflamação amigdalina marcada, miocardite, anemia hemolítica, trombocitopénia grave ou síndroma hemofagocítica.
Prognóstico
O prognóstico de MNI é geralmente bom, sendo as complicações pouco frequentes. Os sintomas principais podem durar entre quatro semanas a 10 meses, seguindo-se uma recuperação gradual. Um estado de fadiga pode permanecer durante mais tempo (meses). Na doença linfoproliferativa a mortalidade é elevada, atingindo os 50%.
BIBLIOGRAFIA
American Academy of Pediatrics. Varicella-zoster infections. In Pickering LK (ed). Red Book 2003. Report of the Committee on Infectious Diseases. Elk Grove Village, Il: AAP, 2003;672-680
Arvin AM, Fast P, Myers M, et al. Vaccine development to prevent cytomegalovirus disease: Report from the National Vaccine Advisory Committee. Clin Infect Dis 2004;39:233-239
Balfour HH Jr, Holman CJ, Hokanson KM, et al. A prospective clinical study of Epstein – Barr virus and host interactions during acute infectious mononucleosis. J Infect Dis 2005;192:1505-1511
Bergelson JM, Shah SS, Zaoutis TE. Pediatric Infectious Diseases. The Requisites in Pediatrics. Philadelphia: Mosby Elsevier, 2008
Chaves SS, Gargiullo P, Zhang JX, et al. Loss of vaccine-induced immunity to varicella over time. NEJM 2007;356:1121-1129
Cherry J, Demmler-Harrison GJ, Kaplan SL, Steinbach WJ, Hotez P (eds). Feigin and Cherry’s Textbook of Pediatric Infectious Diseases. Philadelphia: Elsevier Saunders, 2014
Crawford DH, Macsween KF, Higgins CD, et al. A cohort study among university students: identification of risk factors for Epstein–Barr virus seroconversion and infectious mononucleosis. Clin Infect Dis 2006;43:276-282
Demmler GJ. Screening for congenital cytomegalovirus infection: a tapestry of controversies. J Pediatr 2005;146:162-164
Detrick B, Hamilton RG, Folds JD (eds). Manual of Molecular and Clinical Laboratory Immunology. Washington,DC: American Society for Microbiology, 2006
Direcção Geral da Saúde (DGS). Doenças de Declaração Obrigatória (2010-2013). Lisboa: DGS, 2016
Direcção Geral da Saúde (DGS). Segundo inquérito serológico nacional: Portugal Continental 2001-2002 – Avaliação do programa nacional de vacinação e melhoria do seu custo de efectividade. Lisboa: DGS, 2004;213-225
Dunmire SK, Verghese PS, Balfour HHJr. Primary Epstein-barr virus infection. J Clin Virol 2018;102:84-92
Feder HM Jr, Hoss DM. Herpes zoster in otherwise healthy children. Pediatr Infect Dis J 2004;23:451-457
Feigin RD, Cherry JD, Demmler GL, Kaplan SL (eds). Textbook of Pediatric Infectious Diseases. Philadelphia: Saunders Elsevier, 2014
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Harris D, Redhead J. Should acyclovir be prescribed for immunocompetent children presenting with chickenpox? Arch Dis Child 2005;90:648-650
Heininger U, Seward JF. Varicella. Lancet 2006;368:1365-1376
Hsu BS, Smith JP, Griese ER. Varicella Zoster virus. Pediatr Rev 2019;40:375-377
Imashuku S. Treatment of Epstein-Barr virus-related hemophagocytic lymphohistiocytosis (VEB-HLH), update 2012. J Pediatr Hematol Oncol 2011;33:35-39
Jenson H. Acute complications of Epstein Barr virus infectious mononucleosis. Curr Opin Pediatr 2000;12:263-268
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: McGraw Hill Education, 2018
Leça A. Complicações da varicela – experiência hospitalar. Simpósio UCB/Pharma Aventis Pasteur MSD 2004/Livro de resumos.Congresso Nacional de Pediatria. Lisboa: Sociedade Portuguesa de Pediatria(SPP), 2004
Leça A. Vacina da Varicela – os prós. Livro de resumos. XXXI Jornadas Nacionais de Pediatria. Braga: SPP, 2005
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
Lopez AS, Zhang J, Brown C, Bialek S. Varicella-related hospitalizations in the United States, 2000-2006: the 1-dose varicella vaccination era. Pediatrics 2011;127:238-245
MacDonald MG, Seshia MMK (eds). Avery’s Neonatology: Pathophysiology and Management of the Newborn. Philadelphia, PA: Lippincott Williams & Wilkins, 2015
McIntosh N, Helms P, Smyth R, Logan S (eds). Forfar and Arneil’s Textbook of Pediatrics. London: Churchill Livingstone, 2008
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Nigro G, Adler SP, La Torre R, et al. Passive immunization during pregnancy for congenital cytomegalovirus infection. NEJM 2005;353:1350-1362
Oxman MN, Levin MJ, Johnson GR, et al. A vaccine to prevent herpes zoster and postherpetic neuralgia in older adults. NEJM 2005;352:2271-2284
Patel RA, Binns HJ, Shulman ST. Reduction in pediatric hospitalizations for varicella-related invasive group A streptococcal infections in the varicella vaccine era. J Pediatr 2004;144:68-74
Pierik JC, Gums PD, Fortanier SA, et al. Epidemiological characteristics and societal burden of varicella zoster in the Netherlands. BMC Infect Dis 2102;12:110-113
Pineda V, Pérez Benito AM. Síndrome mononucleósico. Infectologia Básica. Manual de la Sociedad Española de Infectología. Madrid: Panamericana, 2012
Remington JS, Klein JO (eds). Infectious Diseases of the Fetus and Newborn Infant. Philadelphia: Saunders, 2005
Somekh E, Bujanover Y, Tal G, et al. An intradermal skin test for determination of immunity to varicella. Arch Dis Child 2001;85:484-486
Thompson SK, Doerr TD, Hengerer AS. Infectious mononucleosis and corticosteroids. Arch Otolaryngol Head Neck Surg 2005;131:900-904
Vasquez M, La Russa PS, Gershon AA, et al. Effectiveness over time of varicella vaccine. JAMA 2004;291:851-855
Williams H, Macsween K, McAuley K, et al. Analysis of immune activation and clinical events in acute infectious mononucleosis. J Infect Dis 2004;190:63-71