Definição e importância do problema
As displasias esqueléticas, também designadas osteocondrodisplasias/OCD, integram um grupo, clínica e geneticamente muito heterogéneo, de entidades caracterizadas por alterações do crescimento e desenvolvimento do esqueleto (osso e cartilagem – esta última com importância na formação óssea -, em cuja composição entra o tecido conectivo).
Com uma prevalência na data do nascimento cerca de 1/4.000, tal patologia é explicável por mutações em genes. De salientar que há formas clínicas que se manifestam durante o primeiro ano de vida ou, mais tarde, na segunda infância.
De acordo com a mais recente classificação de tais doenças (International Working Group on Bone Dysplasias, 2015 e The Nosology and Classification of Genetic Skeletal Disorders and Online Mendelian Inheritance in Man – OMIM; www.omim.org/), foram já identificadas cerca de 450 entidades, divididas em 42 grupos, relacionados com 364 genes conhecidos.
Embora as manifestações clínicas se relacionem com o esqueleto, na maioria dos casos, os tecidos não esqueléticos estão também envolvidos. Aquelas têm, pois, um largo espectro, oscilando entre ligeiras e por vezes não detectadas, e formas graves e letais in utero. A letalidade, num contexto de hipocrescimento desarmónico, resulta geralmente de tórax de reduzidas dimensões, de hipoplasia pulmonar e de disfunção respiratória.
Muitas displasias esqueléticas graves podem ser diagnosticadas no período pré-natal por ecografia a partir das 20 semanas de gestação, aspecto com implicações clínicas importantes no plano de actuação futura. O diagnóstico é também já possível através do estudo do ADN fetal em sangue da mãe, grávida.
Quanto à hereditariedade, são descritos diversos padrões principais: autossómico recessivo ou dominante (AR, AD), dominante ou recessivo ligado ao X, e ligado ao Y. A acondroplasia, produzida por alteração no gene FGFR3, é a displasia óssea mais frequente, apresentando-se com uma incidência em nados vivos de 1/10.000 a 1/30.000. (ver adiante)
Histopatologia fundamental
Relevando a importância da cartilagem na formação e desenvolvimento do esqueleto, a repercussão do osso e da cartilagem nos músculos, tendões e ligamentos, e o facto de o tecido conectivo fazer parte da composição do osso e cartilagem, importa referir esquematicamente que a patologia em análise pode ser consequência de alteração:
- do tecido mesenquimatoso ou forma jovem do tecido conectivo (o qual tem como elemento constitutivo essencial fibrilhas da proteína principal – colagénio – que actuam como elemento de suporte dos tecidos de diversos órgãos e sistemas);
- da actividade de osteoblastos e osteoclastos; ou ainda
- de outras proteínas complexas da matriz extracelular.
Aspectos semiológicos
A abordagem dos casos sugestivos de displasia esquelética implica um conjunto de procedimentos semiológicos, salientando sucintamente:
- Anamnese, a qual deverá inquirir sobre antecedentes familiares tendo em atenção aspectos somatométricos dos progenitores e doutros familiares;
- Somatometria rigorosa do paciente: peso, comprimento ou altura, perímetro cefálico, comprimento do braço, relação segmento superior (SS) do corpo/segmento inferior (SI) do corpo.
- A relação SS/SI considerada normal até à adolescência oscila entre 1,6 e 0,93; se tal relação no recém-nascido for superior a 1,8 está-se em geral perante uma situação de baixa estatura desproporcionada associada a membros curtos; se a relação for inferior 0,93 está-se em geral perante uma situação de baixa estatura com tronco curto.
Se as extremidades dos dedos das mãos (habitualmente atingindo a coxa no seu terço superior) estiverem ao nível da crista ilíaca ou acima desta, a desproporção torna-se evidente. - Importa igualmente averiguar qual a região do corpo com maior encurtamento (segmento do membro ou tronco).
Se a porção proximal de um membro – respectivamente úmero ou fémur – constituir a parte mais curta, está-se perante um encurtamento chamado rizomélico (por ex. acondroplasia). Se o encurtamento afectar a parte medial do membro – respectivamente antebraço ou perna – o encurtamento é designado mesomélico. Se o encurtamento se verificar na parte distal do membro – respectivamente mãos e pés – o encurtamento é chamado acromélico.
Se o tronco corresponder à área predominantemente mais curta, o mesmo é acompanhado de pescoço, tórax e coluna vertebral mais curtos.
- A relação SS/SI considerada normal até à adolescência oscila entre 1,6 e 0,93; se tal relação no recém-nascido for superior a 1,8 está-se em geral perante uma situação de baixa estatura desproporcionada associada a membros curtos; se a relação for inferior 0,93 está-se em geral perante uma situação de baixa estatura com tronco curto.
- Detecção de eventuais anomalias associadas salientando-se a prioridade da observação, logo no período neonatal da laringe, traqueia e região cervical.
- Exame radiográfico do esqueleto com medições dos vários segmentos dos membros, tórax, coluna (salientando-se a elevada incidência de anomalias vertebrais cervicais, etc..
- Exames complementares vários a seleccionar em função do contexto clínico: estudo citogenético, exame da pele (histoquímico, cultura de fibroblastos para estudo do colagénio, etc.), bioquímico (balanço do cálcio/fósforo, fosfatase alcalina, etc.), genético, biomolecular, biópsia da cartilagem e do osso, etc..
Manifestações clínicas
As osteocondrodisplasias mais representativas e ou frequentes integram os seguintes grandes grupos:
I – Displasias esqueléticas propriamente ditas
- Relacionadas com o crescimento ósseo
- Osteodisplasias cujo exemplo prototípico é a osteogénese imperfeita, que se distingue das restantes pela fragilidade óssea, associada às características gerais atrás referidas;
- Condrodisplasias, associadas a genes que são essenciais para o crescimento e desenvolvimento do esqueleto, tendo em conta o papel da cartilagem na formação óssea; as mesmas englobam dois subgrupos:
2.1) casos em que predominam membros curtos; e
2.2) casos em que predomina tronco curto.
- Não relacionadas com o crescimento ósseo
- Disostoses, ou anomalias isoladas de determinado osso ou de ossos de determinada região anatómica não conduzindo em geral a encurtamento da estatura e ou dos membros, e cuja etiopatogénese pode ser diversa. Em geral, trata-se de alterações simétricas, deformações esqueléticas, mobilidade articular anormal, protuberâncias articulares ou periarticulares, deformações ósseas da base do crânio, costelas curtas, fenda palatina, etc., que, por sua vez, podem afectar os tecidos não esqueléticos.
II – Displasias não esqueléticas (ou do tecido conectivo)
Estas afecções, em geral designadas por não esqueléticas (mais propriamente, predominatemente não esqueléticas), partilham características comuns com as displasias esqueléticas no que se refere à etiopatogénese (mutação de determinados genes com papel especial no referido tecido conectivo) e têm uma expressão clínica mais relevante ao nível de tecidos não esqueléticos (exceptuando na síndroma de Marfan e aracnodactilia congénita). Como exemplos, citam-se: defeitos cardíacos na síndroma de Ellis-van-Creveld, descolamento da retina na displasia espondiloepifisária, disfunção renal na distrofia torácica asfixiante, imunodeficiência na hipoplasia cartilagem-cabelo, etc..
Notas importantes:
|
Etiopatogénese e nosologia
Actualmente, quer as displasias predominantemente esqueléticas, quer as predominantemente não esqueléticas, são classificadas e agrupadas tendo em conta determinados critérios etiopatogénicos interligados e baseados na genética, na biologia molecular, e nas manifestações clínicas e radiográficas.
Aspectos da patogénese
Conhecem-se mais de 360 genes que expressam de forma específica as proteínas do colagénio, dando lugar a diferentes tipos de colagénio tri-helicoidal. As mutações nos genes destes tipos de colagénio e nos genes que sintetizam outras proteínas da matriz extracelular dão lugar a diferentes fenótipos.
O atingimento ósseo pode dever-se à alteração do crescimento e da diferenciação das diversas células que fazem parte do tecido ósseo (condroblastos, condrócitos, osteoblastos, osteócitos, osteoclastos), assim como às alterações das proteínas que constituem a matriz extracelular, sobretudo o colagénio, com implicação nas alterações, quer ósseas, quer do tecido conectivo.
Considerando os diferentes tipos de colagénio (29 tipos), são os colagénios fibrilhares e, em especial, do tipo I, II, IX, e XI os mais implicados nas displasias ósseas.
Também as alterações de outras moléculas proteicas complexas, como a proteína oligomérica da matriz do colagénio – POMC ou proopiomelanocortina, a matrilina 3, e os proteoglicanos (decorina, betaglicano, etc.) são causa de displasias esqueléticas.
As alterações dos proteoglicanos e outras moléculas, como as glucoproteínas de adesão, permitindo que a matriz extracelular (perlecano, filamina, fibronectina, tenascina, laminina, entactina, condronectina e osteonectina) adira às células, estão também implicadas neste grupo de doenças.
De referir que os iões sulfato são fundamentais para a célula cartilagínea e para a síntese de proteoglicanos destinados à formação da matriz extracelular; do défice de sulfato nos proteoglicanos da cartilagem resultam as manifestações clínicas e o fenótipo.
Todos estes processos são regulados por distintas hormonas que actuam no crescimento e mineralização ósseos:
- Hormona paratiroideia ou paratormona (PTH), calcitonina, vitamina D e seus metabólitos.
- Hormona de crescimento (GH) e factor de crescimento análogo da insulina (IGF-1), tri-iodotironina (T3). Existem receptores para a IGF-1 ao nível da zona de proliferação da cartilagem de conjugação. T3 actua na maturação óssea mediante efeito directo sobre a diferenciação do condrócito, e indirecto, ao estimular GH e IGF-1.
- Androgénios e estrogénios que aumentam a produção de osteoblastos e favorecem a fusão metáfise-epífise.
- Hormonas do córtex suprarrenal inibindo o crescimento através do seu efeito anti-GH.
Aspectos genéticos e moleculares
Os progressos da biologia molecular e da genética permitiram concluir que diversos quadros clínicos de displasias esqueléticas e não esqueléticas resultam de mutações de genes que codificam proteínas colagénicas e não colagénicas, as quais fazem parte da matriz extracelular da cartilagem e do osso, essenciais para o crescimento e desenvolvimento do esqueleto; são exemplo o factor de crescimento dos fibroblastos E-3, o colagénio dos tipos II e I, este último o principal colagénio do osso.
As anomalias do tecido conjuntivo, esporádicas ou hereditárias, derivam, em princípio, de mutações de um só gene. Admite-se que na grande maioria se trata de mutações de novo, não se tendo identificado qualquer situação de risco epidemiológico associado a agentes externos indutores.
Salienta-se, a propósito, que as mutações conhecidas na actualidade são de dois tipos fundamentais: mutações pontuais (que afectam apenas um nucleótido) ou deleções/grandes inserções (que afectam vários nucleótidos).
O efeito da mutação sobre a função duma proteína também é muito variável: pode produzir diminuição, anulação ou transformação da referida função. Em muitos destes transtornos, a detecção de portadores da anomalia somente é possível analisando os polimorfismos do ADN no indivíduo e na sua família.
Nas doenças com gene conhecido podem empregar-se técnicas de diagnóstico directo mediante amplificação por PCR (polymerase chain reaction ou reacção em cadeia da polimerase).
Actualmente investiga-se a hipótese de determinado fenótipo poder corresponder a dois ou mais genes. Neste tipo de patologia, a transmissão hereditária (complexa, como foi referido no início) pode evidenciar um tipo de transmissão autossómica dominante muito marcado. Em certos casos, a descendência de um indivíduo normal pode levar ao aparecimento de dois ou mais indivíduos gravemente afectados; este último padrão, sugestivo de transmissão autossómica de modo recessivo, pode corresponder a mosaicismos germinais no progenitor.
Como resultado da investigação em biologia molecular, foram identificados seis mecanismos – cada mecanismo numerado e identificado com dígitos entre parêntesis, de (1)… a (6), a que correspondem outros tantos grupos de entidades clínicas, servindo de base à já referida classificação e nosologia OMIM: (1) Alterações dos receptores transmembranares |
Nosologia
O Quadro 1 discrimina os grupos de displasias esqueléticas (numeração romana de I a XXI correspondendo às características clínicas mais marcantes) e identificados no período neonatal, com especificação do mecanismo patogénico de base atrás explicado, de (1) a (6), e ou do tipo de hereditariedade, e do gene ou genes implicados.
QUADRO 1 – Displasias esqueléticas identificadas no período neonatal
| Grupo ou Nome da Doença | Mecanismo | Modo de Hereditariedade | Gene |
| I. Alteração do receptor 3 do factor do crescimento do fibroblasto (FGFR3) | |||
| Displasia tanatófora (letal no RN) | (1) | AD | FGFR3 |
| Acondroplasia | (1) | AD | FGFR3 |
| Hipo/pseudo/acondroplasia | (1) | AD | FGFR3 |
| Acondroplasia grave com atraso do desenvolvimento e acanthosis nigricans | (1) | AD | FGFR3 |
| II.Doenças do colagénio tipo II | |||
| Acondrogénese II (letal) | AD | COL2A1 | |
| Hipocondrogénese (letal) | AD | COL2A1 | |
| Displasia espondiloepifisária | (2) | AD | COL2A1 |
| Displasia de Kniest | (2) | AD | COL2A1 |
| Displasia de Stickler (osteoartro-oftalmopatia) | (2) | AD | COL2A1 |
| Displasia de Strudwick | (2) | AD | COL2A1 |
| III.Doenças do colagénio tipo X1 | |||
| Fibrocondrogénese | AR | COL11A1 | |
| Fibrocondrogénese | AD | COL11A1, COL11A2 | |
| Displasia otoespondilomegaepifisária | AR | COL11A2 | |
| IV.Doenças do sistema de transporte do sulfato | |||
| Acondrogénese IB | (3) | AR | SLC26A2 |
| Atelosteogenénese II | (3) | AR | SLC26A2 |
| Displasia diastrófica | (3) | AR | SLC26A2 |
| Condrodisplasia com luxações articulares congénitas | AR | CHST3 | |
| V.Doenças do perlecano | |||
| Displasia dissegmentar | AR | PLC | |
| Displasia dissegmentar, tipo Silverman-Handmaker | AR | PLC | |
| Displasia dissegmentar, tipo Rolland Desbuquois | AR | PLC | |
| VI.Doenças das filaminas e similares | |||
| Síndroma otopalatodigital I and II | (6) | XLD | FLNA |
| Displasia fronto-metafisária, síndroma de Melnick-Needles | XLD | FLNA | |
| Atelosteogénese tipos I e III | AD | FLNB | |
| Síndroma de Larsen | AD | FLNB | |
| Displasia de Boomerang (espondilo-cárpico-társica) | AR | FLNB | |
| Síndroma com rim poliquístico e fibula em serpentina | AD | NOTCH2 | |
| VII. Doenças TRPV4 | |||
| Displasia metatrópica | (6) | AD | TRPV4 |
| Displasia espondilometafisária, tipo Kozlowski | (6) | AD | TRPV4 |
| VIII.Displasias de costela curta (com ou sem polidactilia) | |||
| Displasia condroectodérmica (Ellis-van Creveld) | (6) | AR | EVC1, EVC2 |
| Síndroma de costela curta e polidactilia I, II, III, e IV incluindo distrofia torácica asfixiante (Jeune) | (6) | AR | DYNC2H1, IFT80, NEK, WDR35, WDR19, WDR34 |
| Displasia toracolaríngea | AD | ? | |
| IX.Displasias metafisárias | |||
| Hipoplasia cartilagem-cabelo (McKusik) | (6) | AR | RMRP |
| Displasia metafisária, tipo Jansen | (1) | AD | PTHR1 |
| X.Displasia espondilo-epi-(meta)-fisária | |||
| Síndroma de membro curto e calcificação anormal | AR | DDR2 | |
| XI.Displasias espondilodisplásicas | |||
| Acondrogénese 1A | AR | GMAP210 | |
| Displasia de Schneckenbecken | AR | SLC35D1 | |
| Opsismodisplasia | AR | INPPL1 | |
| XII.Doenças acromesomélicas | |||
| Displasia acromesomélica, tipo Maroteaux | AR | NPR2 | |
| XIII.Displasias mesomélicas e rizo-mesomélicas | |||
| Discondrosteose homozigótica tipo Langer | Pseudo-AR/XLD | SHOX | |
| Omodisplasia | AR | GPC6 | |
| Síndroma de Robinow, recessiva | AR | ROR2 | |
| Síndroma de Robinow, dominante | AD | WNT5 | |
| XIV.Displasias de osso arqueado | |||
| Displasia campomélica | (4) | AD | SOX9 |
| Displasia de Stuve-Wiedemann | AR | LIFR | |
| Displasia de osso arqueado tipo FGFR2 | AD | FGFR2 | |
| Nanismo osteodisplásico microcefálico primordial 1 | AR | RNU4ATAC | |
| Nanismo osteodisplásico microcefálico primordial 2 | AR | PCNT | |
| Osteocraniostenose | ? | FAM111A | |
| XV.Displasias de osso delgado | |||
| Nanismo osteodisplásico microcefálico primordial 1 | AR | RNU4ATAC | |
| Nanismo osteodisplásico microcefálico primordial 2 | AR | PCNT | |
| Osteocraniostenose | ? | FAM111A | |
| XVI.Displasias com múltiplas luxações | |||
| Displasia de Desbuquois | AR | CANT1, XYLT1 | |
| Displasia pseudodiatrófica | AR | ? | |
| XVII.Grupo da condrodisplasia punctata (CDP) | |||
| CDP, ligada ao X, dominante | XLD | EBP | |
| Tipo Conradi-Hunermann (CDPX2) | XLR | ARSE | |
| Tipo braqui-tele-falângica (CDPX1) | XLD | NSDHL | |
| Hemidisplasia congénita com eritrodermia ictiosiforme e defeitos dos membros –síndroma CHILD | XLD | EBP | |
| Displasia de Greenberg | AR | LBR | |
| CDP rizomélica tipo 1 | AR | PEX7 | |
| CDP rizomélica tipo 2 | AR | DHPAT | |
| CDP rizomélica tipo 3 | AR | AGPS | |
| XVIII.Displasias osteoscleróticas neonatais | |||
| Displasia de Bloomstrand | AR | PTHR1 | |
| Desmosterolose | AR | DHCR24 | |
| Doença de Caffey (infantil) | (6) | AD | COL1A1 |
| Displasia de Raine | AR | FAM20C | |
| XIX.Grupo de densidade óssea aumentada | |||
| Osteopetrose (formas neonatais ou infantis graves) | (5) | AR | TCIRG1 |
| Osteopetrose (formas neonatais ou infantis graves) | (5) | AR e AD | CLCN7 |
| Disosteosclerose /picnodisostose | (5) | AR | SLC29A3 |
| Displasia hiperostótica de Lenz-Majewski | SP | PTDSS | |
| XX.Osteogénese imperfeita e grupo de densidade óssea diminuída | |||
| Osteogénese imperfeita (OI), moderada, grave e perinatal letal | (5) | AD | COL1A1, COL1A2, IFITM5 |
| OI moderada, grave e perinatal letal | (5) | AR | CRTAP, P3H1,PPBI, FKBP10, HSP47, SP7, WNT1, TMEM33B |
| Síndroma de Bruck | ? | PLOD2, FKBP10 | |
| Síndroma de osteoporose-pseudoglioma | AR | LRP5 | |
| Displasia de Cole-Carpenter | SP | SEC24D, P4HB, CRTAP | |
| XXI.Grupo com mineralização anormal | |||
| Hipofosfatasia, formas perinatal e infantil | (5) | AR e AD | TNSALP |
Reportando-nos ao Quadro 1 e tendo em consideração os objectivos pedagógicos do livro, optou-se por uma selecção das entidades clínicas de maior prevalência e ou fazendo parte da iconografia dos autores, e mais conhecidas pelo médico de família e pelo pediatra geral (respectivamente grupos I, II, IV, VI, VII, VIII, IX, XIV, XVII, XVIII, XIX, XX e XXI.
I.
- Displasia tanatófora, habitualmente letal, caracterizada por hipocrescimento micromélico, macrocefalia (Figuras 1 e 2).
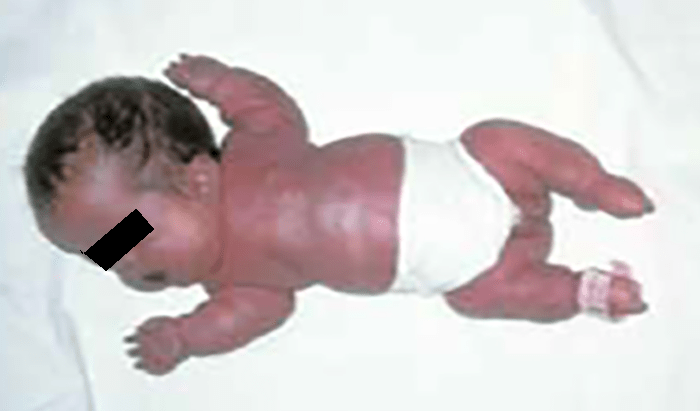
FIGURA 1 – Displasia tanatófora (fenótipo) (NIHDE)
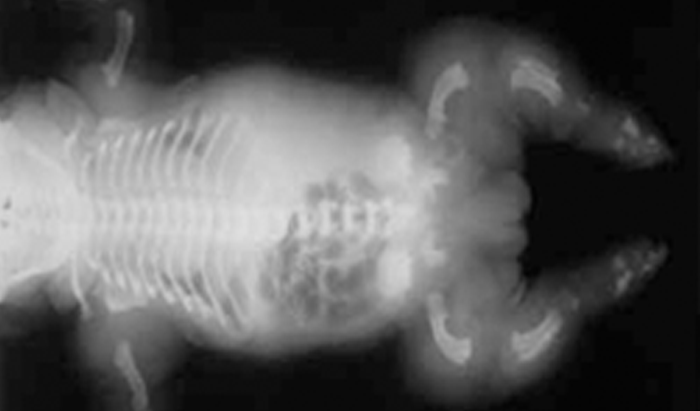
FIGURA 2 – Displasia tanatófora. Radiografia do esqueleto evidenciando sinais de situs inversus, encurtamento e encurvamento dos ossos longos (NIHDE).
- Acondroplasia, como foi referido, a displasia esquelética mais frequente, verificando-se hipocrescimento rizomélico, macrocefalia, fronte proeminente, ponte nasal plana ou deprimida, e mãos curtas com dedos “em tridente” na extensão. Atingimento precoce do desenvolvimento motor, cifose toracolombar e sintomatologia da via respiratória superior, incluindo apneia do sono, e otites de repetição (Figuras 3 e 4).
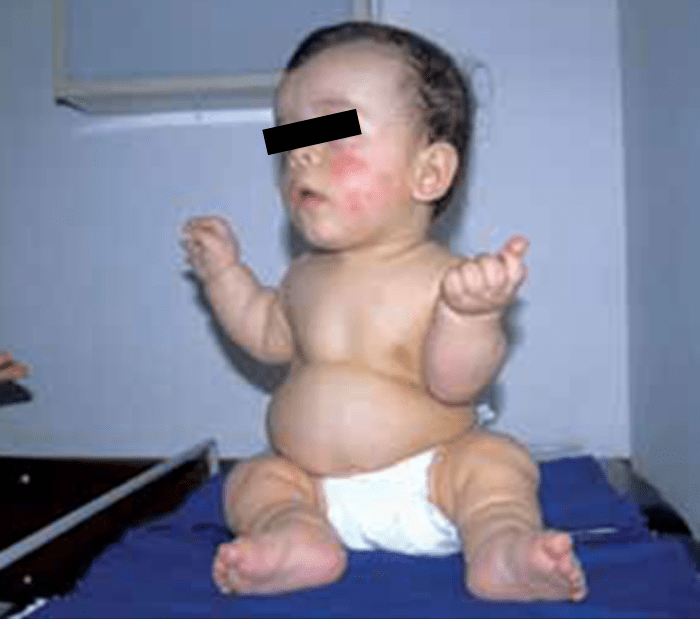
FIGURA 3 – Acondroplasia (NIHDE).
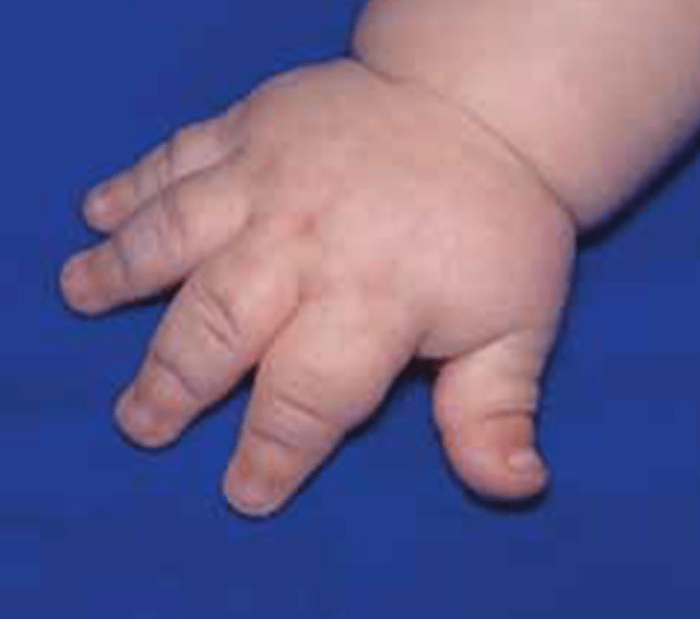
FIGURA 4 – Mão de criança com acondroplasia (NIHDE).
- Hipocondroplasia ou pseudoacondroplasia, cerca de vinte vezes mais rara do que a acondroplasia (~1/200.000): hipocrescimento, normocefalia, mãos e pés pequenos. Forma semelhante à acondroplasia, embora mais ligeira. Casos descritos submetidos a tratamento com hormona do crescimento e melhoria do crescimento e da desproporção corporal.
| Nota: A abordagem das entidades clínicas que integram a alínea I é retomada noutro capítulo. |
II.
- Acondrogénese tipo II / hipocondrogénese, letais: hipocrescimento, extremidades curtas, normocefalia.
- Displasia congénita espondiloepifisisária: displasia rara (~1/300.000), caracterizada por hipocrescimento de tronco curto, artropatia, achatamento facial, palato fendido, miopia, degenerescência retiniana, descolamento da retina, mielopatia cervical e hipotonia. Formas evidenciando traqueomalácia e insuficiência respiratória. Atraso da ossificação epifisária, coxa vara progressiva. Instabilidade atlanto-axial, com compromisso neurológico.
- Displasia de Kniest: estatura baixa, extremidades curtas, pés botos, artropatia dolorosa, rigidez e contracturas em flexão, palato fendido, défice auditivo, miopia, descolamento da retina. Imagem radiológica de irregularidades epifisárias e de alargamento metafisário.
- Displasia de Strudwick: hipocrescimento, pectus carinatum, escoliose, palato fendido, miopia, degenerescência retiniana, mielopatia cervical.
- Síndroma de Stickler (Osteoartro-oftalmopatia): pelas manifestações articulares e oculares, assemelha-se à displasia espondiloepifisária. A mesma evidencia fenda palatina, alterações orofaciais/ micrognatia, hipoacúsia, exoftalmo, epicanto, miopia grave, cataratas, descolamento retiniano, pés equinovarus, encurtamento rizomélico, atraso mental, hipotonia, prolapso mitral.
Ao contrário das restantes entidades que fazem parte do grupo II, com o mecanismo (2), nesta displasia não existe baixa estatura.
Notas importantes:
|
IV.
Da família ou grupo IV (doenças do sistema de transporte do sulfato), a que corresponde o mecanismo (3), destacamos:
- Acondrogénese do tipo IB – hipocrescimento rizomélico neonatal grave, escassa ou ausente ossificação vertebral, pélvica e craniana, crânio mole, fémures curtos; frequentemente letal.
- Atelosteogénese do tipo II – frequente morte in utero ou prematuridade, hipocrescimento micromélico grave, hipoplasia dos corpos vertebrais, hipoplasia dos úmeros e fémures, escassa ossificação do cúbito e perónio.
- Displasia diastrófica – hipocrescimento micromélico, indicador curto, polegar implantado mais proximalmente, afastado dos dedos restantes e perpendicular ao eixo do membro superior, 1º metacárpico ovóide, pé equinovaro, cifoscoliose, anomalias dos pavilhões auriculares, palato fendido, micrognatia. A radiografia da mão evidencia ossos das falanges e metacárpicos irregulares e curtos (Figura 5).
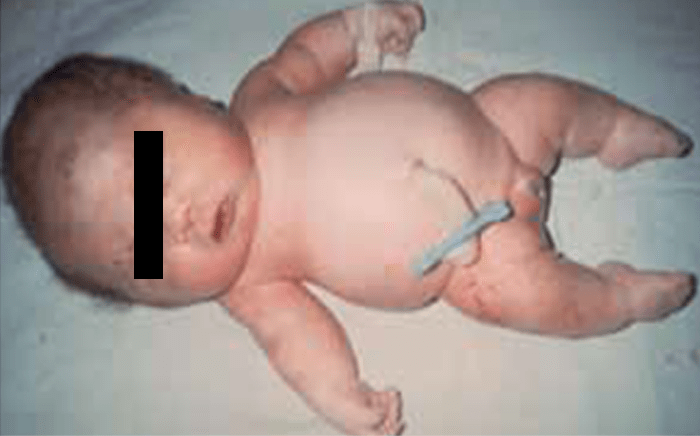
FIGURA 5 Displasia diastrófica. (NIHDE)
| Nota importante: tal como nas duas entidades anteriores (desta alínea IV), a displasia diastrófica associa-se à presença de mutações heterozigóticas do gene transportador de iões sulfato (SLC26A2) localizado em 5q31-q34. O modo de transmissão é autossómico recessivo em todas estas afecções; para a manifestação da doença é condição fundamental a presença de dois alelos mutantes, sendo que o fenótipo é determinado pela combinação de alelos mutantes. |
VI.
As filaminas A e B estabelecem conexão funcional das proteínas estruturais extracelulares com as intracelulares; tal é fundamental para o crescimento e desenvolvimento esquelético.
Mutações nos genes codificando as proteínas filaminas A foram detectadas em diversas alterações do desenvolvimento esquelético:
- Síndroma otopalatodigital tipos I e II e
- Displasia fronto-metafisária e, ainda
- Síndroma de Melnick-Needles.
Quanto a mutações nos genes relacionados com as filaminas B, citam-se:
- Síndroma de Larsen
- Atelosteogénese tipos I e II, perinatais letais e,
- Displasia de Boomerang (espôndilo-cárpico-társica).
VII.
- Displasia metatrópica – entidade com nome derivado da palavra grega metatropos significando” mudança de padrão”; neste caso, modificação das proporções corporais com a idade. O fenótipo no RN chama a atenção por tronco estreito e longo, a par de extremidades curtas. Por vezes nota-se apêndice ou pequena “cauda” ao nível da região sagrada. Outros achados incluem: hipoplasia odontoide, por vezes associada a instabilidade cervical; cifoescoliose acentuando-se com a idade e conduzindo a alterações da postura e a insuficiência respiratória; articulações proeminentes levando a restrição da mobilidade, exceptuando nas mãos; rigidez articular progressiva, notória sobretudo nas ancas e joelhos; platispondilia com alargamento dos espaços intervertebrais; epífises inferiores do fémur em sino, com alargamento das respectivas metáfises; hipoplasia dos ossos ilíacos. Atingindo a idade adulta (com estatura baixa, de 110-120 cm), pode agravar-se a função respiratória, levando a morte prematura.
- Displasia espondilometafisária, tipo Kozlowski. O fenótipo desta displasia é dominado por escoliose e platispondilia progressivas. Manifesta-se na primeira infância, com baixa estatura envolvendo sobretudo o tronco, e mãos e pés curtos; alargamento e mineralização irregular das metáfises, especialmente no fémur proximal. As manifestações limitam-se ao esqueleto. Na idade adulta, a estatura ronda os 130-150 cm.
VIII.
- Displasia condroectodérmica (síndroma de Ellis-van Creveld) – Hipocrescimento, membros curtos (segmentos médio e distal), polidactilia pós-axial, dente congénito, tórax estreito e comprido, displasia das unhas, defeitos cardíacos, genu valgum, ilíacos curtos e quadrangulares, disfunção renal, disfunção hepática, cabelos escassos; adultos baixos (119-161 cm); problemas respiratórios ou cardíacos em 30% dos casos.
- Síndromas de costela curta e polidactilia – Letal no RN por estreitamento da caixa torácica, levando a insuficiência respiratória; polidactilia, extremidades curtas e outras anomalias associadas.
- Distrofia torácica asfixiante (síndroma de Jeune) – Fácies aparentemente normal; fenótipo semelhante ao da síndroma de Ellis –Van Creveld; caixa torácica longa e estreita associada a hipoplasia pulmonar, membros curtos, polidactilia; casos descritos evidenciando má-absorção intestinal e disfunção hepática.
IX.
- Hipoplasia cartilagem cabelo (condrodisplasia metafisária – tipo McKusick) – Esta displasia, rara, surge com incidência compreendida entre 1/700 (nos EUA) a 1/ 18.000 nascimentos (na Finlândia). Para além das manifestações esqueléticas (baixa estatura, arqueamento femoral, alargamento das metáfises, perónio mais comprido que a tíbia, hipoplasia das cartilagens, platispondilia, encurtamento das falanges associado a alargamento da região metacárpica), evidencia sinais não esqueléticos (cabelo escasso e frágil, neutropénia, défice imunitário (anomalias das células T, neutropenia, leucopenia, e susceptibilidade a infecções por vírus da varicela); igualmente estão descritos casos associados a doença de Hirschprung, doença celíaca e a susceptibilidade a neoplasias como tumores cutâneos e linfomas. A altura na idade adulta é ~107-157 cm.
- Displasia metafisária, tipo Jansen – Trata-se duma condrodistrofia primária muito rara. É causada por uma mutação no gene PTHrP localizado em 3p21-p22, o qual codifica o receptor peptídico relacionado com a paratormona.
Associada a baixa estatura, é caracterizada por metáfises alargadas e concavas, inicialmente com acentuado grau de osteólise (zonas com lacunas /”ratamento” de densidade óssea diminuída, em”mapa geográfico”); com o tempo, a esse nível, surge calcificação nas extremidades distais dos ossos longos dos membros inferiores (tíbia, perónio e fémur). Vértebras igualmente afectadas, com irregularidades no crescimento. Surge hipercalcémia (13-15 mg/dL).
O diagnóstico diferencial faz-se com a condrodisplasia metafisária tipo Schmid, com manifestações mais ligeiras, embora as alterações ao nível da anca sejam mais debilitantes que na de tipo Jansen; a displasia tipo Schmid está relacionada com defeitos no colagénio tipo X, alfa 1 relacionados com mutações no gene COL10A1, localizado em 6q21-q22.3.
XIV.
- Displasia campomélica – No âmbito das displasias que têm como mecanismo básico as alterações dos factores de transcrição do ADN-mecanismo designado por (4), ressalta a displasia campomélica, considerada historicamente uma condrodisplasia. Aparente na data de nascimento, chama a atenção a baixa estatura, o arqueamento dos membros, sobretudo dos inferiores (fémur e tíbia arqeuados); o exame radiográfico do esqueleto evidencia conformação de crânio grande e pequena face, micrognatismo, tórax pequeno, hipoplasia ou ausência das omoplatas, ossos da bacia hipoplásicos e extremidades inferiores curtas. A par de sinais esqueléticos, verificam-se manifestações não esqueléticas, como dificuldade respiratória, sintomatologia neurológica, cardíaca e renal. (Figuras 6 e 7).
Cumpre anotar que alguns autores incluem neste grupo, cujo mecanismo é o assinalado por (4), certas disostoses (anomalias apenas de certos ossos), como a displasia cleidocraniana (ausência de clavículas e ombros descidos e estreitos, fronte proeminente, escafocefalia, paralisia facial, etc.), e a síndroma nail-patella ou da unha rótula (osteo-onicodisostose), caracterizada essencialmente por displasia das unhas e ausência ou hipoplasia da rótula.
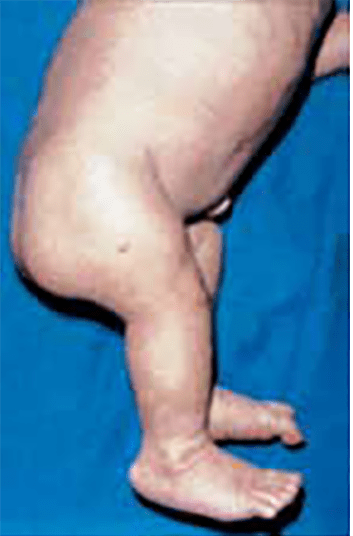
FIGURA 6 – Displasia campomélica. Pormenor do encurtamento da coxa direita.
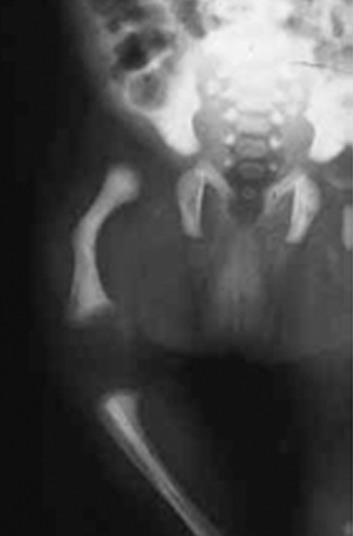
FIGURA 7 – Displasia campomélica. Hemissoma direito. Pormenor do aspecto radiográfico do encurvamento do fémur direito.
XVII.
- Condrodisplasia punctata (CDP) – Este termo refere-se a uma entidade, clínica e geneticamente heterogénea, integrando diversos tipos. A síndroma designada por CDP tipo Conradi-Hunermann, de transmissão dominante ligada ao X (XLD), mais bem caracterizada, é a forma mais típica, pela abundância de manifestações.
O fenótipo é, em geral, semelhante ao da acondroplasia, com encurtamento dos membros. Descrevem-se calcificações punctiformes transitórias (até ~3-4 anos) nas epífises e nas áreas de formação óssea encondral (ao longo das vértebras e região pélvica), microcefalia, cataratas, atrofia do nervo óptico, defeitos cardíacos. Na quase totalidade das formas XLD, e em cerca de 25% das formas de transmissão recessiva, verificam-se lesões cutâneas ictiosiformes, com hiperqueratose, eritema e descamação. (Figura 8)
Como nota importante, importa referir que a sintomatologia que engloba a entidade CDP poderá estar associada a antecedentes maternos de défice em vitamina K, a efeito teratogénico da warfarina, assim como a certas doenças hereditárias do metabolismo, como doenças do peroxisoma e da biossíntese do colesterol.
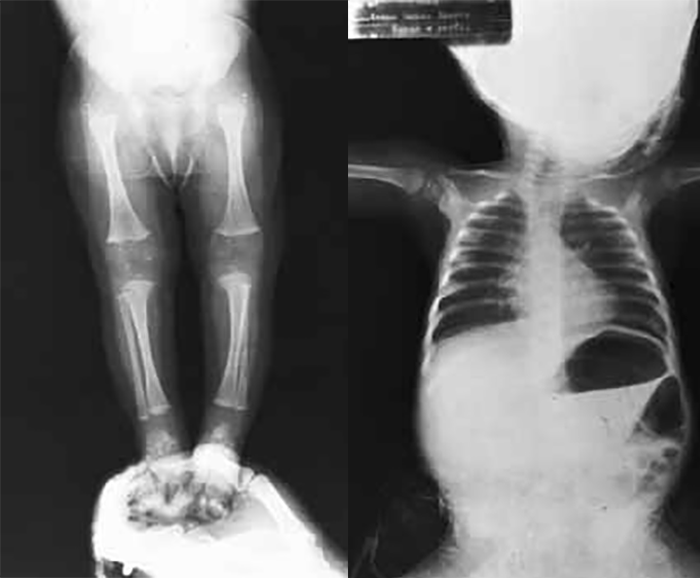
FIGURA 8 – Condrodisplasia calcificante congénita (Doença de Conradi). Aspecto radiológico das epífises com calcificações punctiformes.
XVIII.
- Doença de Caffey (Hiperostose cortical infantil) – Trata-se duma doença rara que tem como base o mecanismo designado por (6), pertencendo ao grupo de displasias osteoscleróticas neonatais; caracteriza-se por hiperostose cortical com inflamação da fascia e músculos contíguos à estrutura óssea. Início de sintomas antes dos 6 meses de idade, com tumefacção dos tecidos moles contíguos aos ossos, precedendo as alterações ósseas. Citam-se a seguir alguns aspectos das manifestações clínicas, do diagnóstico diferencial e do tratamento : a) início súbito com irritabilidade e tumefacção dolorosa dos tecidos moles (esta última nem sempre evidente) suprajacente aos ossos em que se verifica hiperostose cortical (aspecto imagiológico), a qual se verifica ulteriormente à sintomatologia referida; ao nível da face, uma tumefacção da região geniana ou do maxilar inferior, unilateralmente, é suspeita; b) febre e anorexia; c) os ossos mais afectados são a clavícula, maxilar inferior, rádio e cúbito; d) remissões e recaídas com duração variável(~2 semanas -3 meses); e) elevação da velocidade de sedimentação, da fosfatase alcalina e, por vezes, da PGE; f) o diagnóstico diferencial faz-se com intoxicação crónica com vitamina A, infusão IV com PGE em casos de cardiopatia dependente de PDA, tumores ósseos e escorbuto; g) o tratamento inclui, entre outras medidas, indometacina e prednisolona.
XIX.
- Osteopetrose – A afecção mais representativa do grupo de densidade óssea aumentada em relação com o mecanismo (5), em que se verifica defeito na reabsorção óssea por disfunção dos osteoclastos, é a osteopetrose, com vários subtipos, e a picnodisostose. A raridade desta patologia traduz-se por incidências de 1/250.000 nascimentos (nas formas graves) e de 1/20.000 nascimentos (nas formas ligeiras).
A forma grave, geralmente detectada na primeira infância, evidencia macrocefalia, hepatosplenomegalia (por eritropoiese extramedular compensatória), alterações dentárias, surdez, cegueira, anemia, hipocrescimento, atraso do neurodesenvolvimento e fracturas patológicas; e sinais radiográficos ósseos de osteosclerose difusa, aumento da densidade óssea, alargamento das metáfises e surgimento de bandas com densidades variáveis, perpendiculares ao eixo do rádio e cúbito, sobrepostas, em sanduíche, justa metafisárias. Do estreitamento dos foramina dos ossos do crânio, resultam diversos tipos de neuropatia dos nervos cranianos, designadamente do nervo facial.
Como dados laboratoriais, valores séricos baixos de cálcio e fósforo, normais de 25-OH-vitamina D, e elevados de PTH.
Na forma de manifestação tardia (adolescência e adultícia) – doença de Albers-Schonberg) as manifestações são mais ligeiras.
O tratamento inclui, para além de medidas sintomáticas (cuidados dentários, transfusões de sangue e derivados no contexto de anemia, antibioticoterapia para infecções, etc.), o transplante de células estaminais hematopoiéticas, assim como a administração de calcitriol e interferão-gama.
XX.
No grupo caracterizado essencialmente por densidade óssea diminuída, sobressai a Osteogénese imperfeita, entidade que é abordada ulteriormente, em capítulo especial.
XXI.
Hipofosfatasia
Esta entidade clínica, caracterizada essencialmente por mineralização anormal, é rara (incidência de 1/100.000 nascimentos) e heterogénea. A mesma resulta de mutações no gene que codifica a fosfatase alcalina não específica dos tecidos hepático, ósseo e renal (tissue non-specific alkaline phosphatase ou TNSALP), essencial para a normal mineralização óssea. Como consequência das mutações, verifica-se redução da actividade de TNSALP.
A heterogeneidade clínica traduz-se essencialmente por seis formas de apresentação, salientando-se como mais frequentes:
- a neonatal ou perinatal (hipofosfatasia congénita letal), mais grave, e
- a infantil (hipofosfatasia tarda), mais ligeira, ocorrendo na infância ou adolescência.
Na forma congénita, no feto ou RN surge: – ausência de ossificação dos arcos neurais, e ausência de visualização da maioria dos corpos vertebrais; – deformidades das extremidades com, arqueamento bizarro e encurtamento dos ossos longos; -hipercalcémia; e – esqueleto em geral, e designadamente o crânio, deficientemente ossificados.
Na forma mais ligeira salientam-se: – defeitos de ossificação ao nível das metáfises, surgindo o aspecto em “taça”; – arqueamento dos membros inferiores; – radiografia do crânio evidenciando alguns “ilhéus” de ossificação irregular; – encurtamento estatural; – deformação do tórax simile raquítico.
Na forma mais tardia incluem-se: – craniossinostose; – perda precoce dos dentes decíduos ou permanentes por hipoplasia do cimento; – dores e fracturas ósseas; – sinais semelhantes aos do raquitismo.
Considerando as formas de transmissão AR, ambos os progenitores são geralmente portadores.
Como dados laboratoriais próprios da hipofosfatasia citam-se: hipercalcémia nas formas neonatais e infantis (por não incorporação do cálcio nos condrócitos maduros), o que poderá originar nefrocalcinose; diminuição do nível sérico da fosfatase alacalina (dado importante para o diagnóstico diferencial com raquitismo, em que existe aumentado); elevação do nível sérico de vitamina B6; e elevação urinária da fosfoetanolamina. Os exames de genética molecular são evidentemente importantes para o diagnóstico (ver atrás).
No que respeita ao tratamento, cabe uma referência especial ao fármaco asfotase-alfa.
Actuação prática e seguimento – generalidades
A actuação prática nas displasias esqueléticas incide em diversas vertentes, tendo em conta a multiplicidade de problemas associados tais como:
- problemas médicos associados (por ex. dificuldade respiratória decorrente de deformações torácicas), ou cardiopatias congénitas, estando indicado em tais circunstâncias o suporte ventilatório;
- problemas do foro ORL e oftalmológico;
- problemas ósseos em relação com a etiopatogénese de cada situação, por ex. tratamento de diversas formas de raquitismo obrigando aos respectivos tratamentos etiológicos;
- problemas ortopédicos e cirúrgicos obrigando a diversas modalidades de intervenção, com algumas limitações quanto a resultados finais.
Deduz-se, pois, que a abordagem de pacientes com a patologia descrita terá que ser necessariamente multidisciplinar, incluindo perinatologistas, pediatras gerais, geneticistas, endocrinologistas, neurocirurgiões, otorrinolaringologistas, cirurgiões pediátricos e neurocirurgiões.
Salienta-se que tal abordagem torna indispensável a prestação de cuidados centrados na família em ligação estreita ao médico de família e pediatra geral, e que na ausência de formas clínicas não letais é possível obter uma qualidade de vida boa.
O fluxograma que integra a figura 9 sintetiza a actuação recomendada para os casos de suspeita de displasia esquelética no recém-nascido.
Actuação prática e seguimento – generalidades
A actuação prática nas displasias esqueléticas incide em diversas vertentes, tendo em conta a multiplicidade de problemas associados tais como:
- problemas médicos associados (por ex. dificuldade respiratória decorrente de deformações torácicas), ou cardiopatias congénitas, estando indicado em tais circunstâncias o suporte ventilatório;
- problemas do foro ORL e oftalmológico;
- problemas ósseos em relação com a etiopatogénese de cada situação, por ex. tratamento de diversas formas de raquitismo obrigando aos respectivos tratamentos etiológicos;
- problemas ortopédicos e cirúrgicos obrigando a diversas modalidades de intervenção, com algumas limitações quanto a resultados finais.
Deduz-se, pois, que a abordagem de pacientes com a patologia descrita terá que ser necessariamente multidisciplinar, incluindo perinatologistas, pediatras gerais, geneticistas, endocrinologistas, neurocirurgiões, otorrinolaringologistas, cirurgiões pediátricos e neurocirurgiões.
Salienta-se que tal abordagem torna indispensável a prestação de cuidados centrados na família em ligação estreita ao médico de família e pediatra geral, e que na ausência de formas clínicas não letais é possível obter uma qualidade de vida boa.
(Adaptado de Krakow D, 2015)
FIGURA 9 – Actuação perante a suspeita de Displasia Esquelética no Recém-Nascido
O fluxograma que integra a figura 9 sintetiza a actuação recomendada para os casos de suspeita de displasia esquelética no recém-nascido.
No que respeita às displasias do tecido conectivo (não esqueléticas), em capítulos seguintes é dada ênfase às síndromas de Ehlers – Danlos, de Alport, epidermólise bolhosa, síndroma de Marfan, cutis laxa, pseudoxantoma elástico e síndroma de Williams.
GLOSSÁRIO
Platispondilia > Achatamento do corpo vertebral de várias vértebras da região dorsolombar que pode conduzir a cifose.
BIBLIOGRAFIA
Bonafe L, Cormier-Daire V, Hall C, et al. Nosology and classification of genetic skeletal disorders: 2015 revision. Am J Med Genet A 2015; 167A: 2869- 2892
Calder AD, Foley P. Skeletal dysplasias: an overview. Paediatrics and Child Health 2017; 28: 84 – 92
Goldman L, Schafer AI (eds). Goldman-Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Goodman RM, Gorlin RJ. The Malformed Infant and Child. An Illustrated Guide. Oxford: Oxford University Press, 1983
Hall CM, Offiah AC, Forzano F, et al. Dysplasias; an atlas of multimodality imaging. London: Radcliffe Publishing, 2012
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Krakow D. Skeletal dysplasias. Clin Perinatol 2015; 42: 301 – 319
Krakow D, Rimoin DL. The skeletal dysplasias. Genet Med 2010; 12: 327 – 341
Krakow D, Alanay Y, Rimoin LP, et al. Evaluation of prenatal-onset osteochondrodysplasias by ultrasonography: a retrospective and prospective analysis. Am J Med Genet A 2008; 146A: 1917 -1924
Krakow D, Lachman RS, Rimoin DL. Guidelines for the prenatal diagnosis of fetal skeletal dysplasias. Genet Med 2009; 11: 127 – 133
Liu A, McEntee. Osteochondrdysplasia. Pediatr Rev 2019; 4: 435-438. DOI: 10.1542/pir.2017-0340
Maddirevula S, Alsahli S, Alhabeeb L, et al. Expanding the phenome and variome of skeletal dysplasia. Genet Med 2018; 20: 1609-1616. doi: 10.1038/gim.2018.50
Milks KS, Hill LM, Hosseinzadeh K. Evaluating skeletal dysplasias on prenatal ultrasound: an emphasis on predicting lethality. Pediatr Radiol 2017; 47: 134 – 145
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Parilla BV, Leeth EA, Kambich MP, et al. Antenatal detection of skeletal dysplasias. J Ultrasound Med 2003; 22: 255 – 258
Trotter TL, Hall JG. Health supervision for children with achondroplasia. Pediatrics 2005; 116: 771 – 783
Unger S. A genetic approach to the diagnosis of skeletal dysplasia. Clin Orthop Relat Res 2002; (401):32 – 38
Warman ML, Cormier-Daire, Hall C, et al. Nosology and classification of genetic skeletal disorders: 2010 revision. Am J Med Genet 2011; 155A: 943-968
Uttarilli A, Shah H, Bhavani GS, et al. Phenotyping and genotyping of skeletal dysplasias: Evolution of a center and a decade of experience in India. Bone 2019;120: 204-211. doi: 10.1016/j.bone.2018.10.026
Warman ML, Cormier-DaireV, Hall C, et al. Nosology and classification of genetic skeletal disorders: 2010 revision. Am J Med Genet A 2011; 155 A: 943 -968
Watson SG, Calder AD, Offiah AC, Negus S. A review of imaging protocols for suspected skeletal dysplasia and a proposal for standardisation. Pediatr Radiol 2015; 45: 1733 – 1737