Importância do problema
O canal arterial é uma estrutura vascular que, durante a vida fetal, faz comunicar a porção proximal do ramo esquerdo da artéria pulmonar com a aorta descendente, depois da emergência da artéria subclávia esquerda. Tem a sua origem embriológica na porção distal do sexto arco embrionário esquerdo, do qual tem igualmente origem a artéria pulmonar.
Na circulação fetal, a sua permeabilidade é determinante no desvio do sangue vindo do ventrículo direito para a circulação sistémica e de volta à placenta, contornando a circulação pulmonar de alta resistência.
A permeabilidade do canal arterial no feto é mantida pela reduzida PaO2 e pelos elevados níveis de óxido nítrico e prostaglandinas E2 produzidas pela placenta. Após o nascimento, com a subida dos níveis tensionais de oxigénio e a remoção da fonte de produção de prostaglandinas, ocorre o encerramento funcional do canal arterial ao fim de 10 a 18 horas (por contracção da camada muscular), e o anatómico pela segunda a terceira semana de vida (por disrupção da íntima e formação de fibrose). Pelas 8 semanas de vida, o canal arterial encontra-se encerrado em cerca de 88% dos recém-nascidos normais.
A persistência de canal arterial ocorre como lesão isolada em 5-10% de todas as cardiopatias congénitas. Mais frequente no sexo feminino (2/1), é uma anomalia comum nos recém-nascidos pré-termo, ocorrendo em 20-40% das crianças com peso de nascimento inferior a 1.000 gramas.
Etiopatogénese
O principal factor causal é a prematuridade, que condiciona: menor sensibilidade ao oxigénio das fibras musculares imaturas da camada média; incapacidade de metabolização das prostaglandinas pelo pulmão imaturo; e patologia pulmonar hipoxémica, frequente no recém-nascido pré-termo. Os factores genéticos parecem estar envolvidos, existindo um risco de recorrência de 2-4% em irmãos de um caso afectado, sendo que determinados genes têm sido associados a maior incidência (por ex. TRAF1, MYH11). Está documentada também a associação com a infecção por vírus da rubéola no primeiro trimestre de gravidez.
Com a diminuição da resistência vascular pulmonar após o nascimento, o sangue oxigenado da aorta descendente passa pelo canal arterial e mistura-se na artéria pulmonar com o sangue venoso proveniente do ventrículo direito (shunt esquerdo-direito). O aumento de volume de sangue através do pulmão, aurícula esquerda, ventrículo esquerdo e novamente aorta, é responsável pelo aumento das dimensões das câmaras cardíacas esquerdas e por hipertrofia ventricular esquerda.
A magnitude do shunt esquerdo-direito é determinada pela resistência oferecida pelo canal arterial (comprimento, diâmetro e trajecto) quando o canal é pequeno, e pela resistência vascular pulmonar quando o canal é grande. O aumento de volume de sangue ejectado pelo ventrículo esquerdo e o desvio de sangue da aorta para a artéria pulmonar são responsáveis pela elevada amplitude de pulso.
Manifestações clínicas
Nos casos de canal arterial de pequenas dimensões e shunt pequeno os doentes são assintomáticos e o diagnóstico é suspeitado pela detecção de sopro cardíaco em observação de rotina. Os casos com shunt grande manifestam-se por um quadro de insuficiência cardíaca, geralmente depois das 4 semanas de vida, traduzido por polipneia, diaforese, recusa alimentar e perda ponderal entre a terceira e a sexta semana de vida, por diminuição da resistência vascular pulmonar. A onda de pulso é geralmente ampla e o impulso apical está desviado para a esquerda. O componente pulmonar do segundo ruído cardíaco tem intensidade aumentada. Ausculta-se sopro contínuo, que é mais audível no segundo espaço intercostal esquerdo, e se inicia pouco depois do primeiro ruído, atingindo a máxima intensidade na região do segundo ruído (ruído de “maquinaria”). Por vezes pode auscultar-se um sopro diastólico apical devido ao aumento de débito através da válvula mitral (rodado de débito).
Nos recém-nascidos pré-termo, a permeabilidade do canal arterial de grande calibre pode apresentar-se com sinais de insuficiência cardíaca congestiva e edema pulmonar entre as 2 e as 4 semanas de vida. O sopro é habitualmente sistólico, rude e mais pronunciado no bordo esquerdo do esterno. Traduz-se clinicamente por taquicardia, deterioração respiratória com necessidade de ventilação mecânica para além do tempo esperado e aumento da amplitude dos pulsos periféricos. O grande shunt esquerdo-direito causa fuga significativa durante todo o ciclo cardíaco e baixo débito sistémico, que no grande prematuro concorre para aumentar o risco de isquémia mesentérica e insuficiência renal. Está documentada uma incidência aumentada de displasia broncopulmonar, hemorragia intraventricular e enterocolite necrosante, pelo défice de perfusão destes órgãos no contexto de shunt esquerdo-direito através do canal. (Parte Perinatologia/Neonatologia)
Em doentes com canal arterial moderado a grande, não diagnosticado, o aumento mantido do débito pulmonar pode gerar doença vascular pulmonar obstrutiva irreversível.
Exames complementares
O diagnóstico é fundamentado nos sinais clínicos e num conjunto de exames complementares descritos a seguir.
Radiografia do tórax
No canal arterial pequeno, a radiografia do tórax não apresenta sinais de alterações. Nos casos de canal moderado ou grande, observa-se proeminência dos arcos da artéria pulmonar, aumento do índice cardiotorácico (por dilatação da aurícula e ventrículo esquerdos), e aumento da vascularização pulmonar (Figura 1). Com a progressão para doença pulmonar vascular obstrutiva, as dimensões do coração normalizam, verificando-se dilatação do tronco e ramos hilares da artéria pulmonar juntamente com diminuição de calibre dos seus ramos periféricos (padrão em “árvore de inverno”).
Ecocardiograma
O ecocardiograma é fundamental no estudo da morfologia e dimensões do canal arterial, permitindo: aferir a necessidade terapêutica e a adequação de um eventual encerramento percutâneo; e excluir patologia associada.
As dimensões das cavidades esquerdas fornecem sinais indirectos sobre a magnitude do shunt e o estudo com Döppler pulsado e codificado em cor permite detectar e quantificar o shunt através do canal arterial. A relação entre as dimensões da aurícula esquerda e a raiz da aorta fornece importantes indicações quanto à dilatação auricular esquerda e magnitude do shunt: £ 1.2 é normal em crianças; > 1.2 denota dilatação da aurícula esquerda; e > 1.5 traduz shunt esquerdo-direito significativo. A presença de um fluxo por cor que atinge a válvula pulmonar e de largo diâmetro também indica a presença de canal hemodinamicamente significativo.
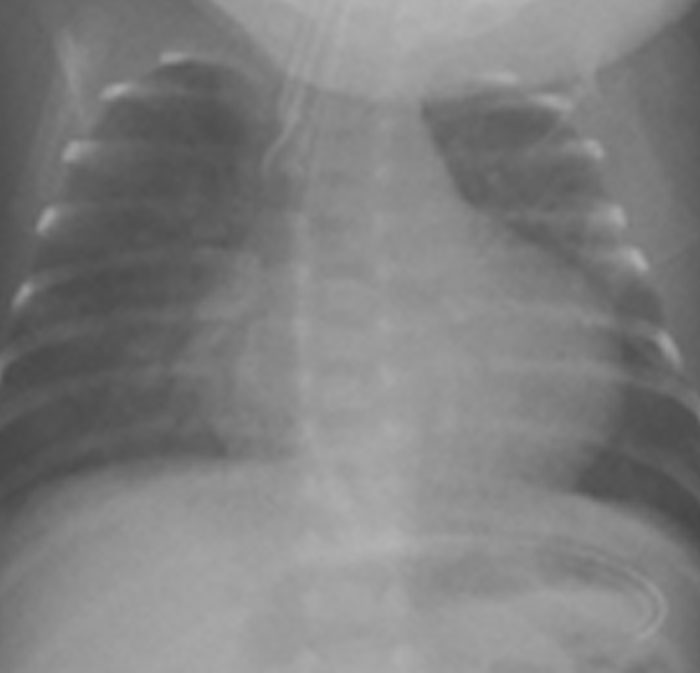
FIGURA 1. Radiografia do tórax de recém-nascido com canal arterial grande em ventilação artificial
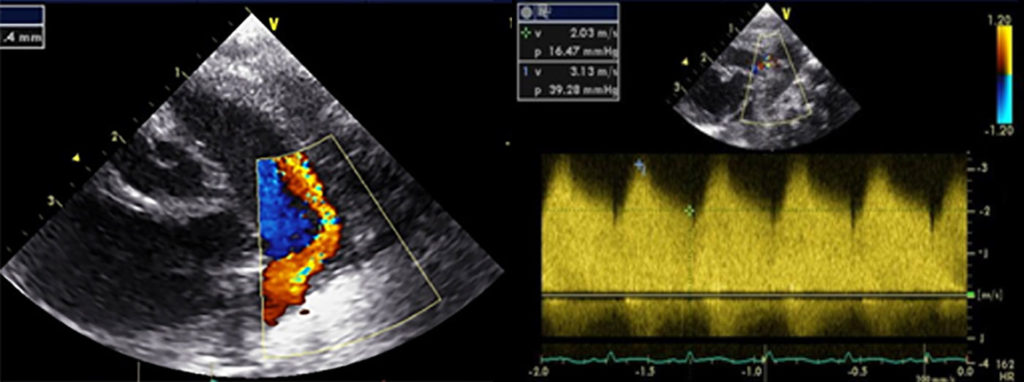
FIGURA 2. Imagens de ecocardiografia de canal arterial persistente, visualizando-se à esquerda o fluxo a laranja do shunt esquerdo-direito entre a aorta e a artéria pulmonar e, à direita, o fluxo contínuo detectado pelo Döppler contínuo
Complicações
A insuficiência cardíaca congestiva ocorre principalmente nos lactentes com shunt significativo depois das primeiras semanas de vida (entre as 2 e as 4 semanas).
A doença pulmonar vascular obstrutiva, com resistência vascular pulmonar fixa e disfunção cardíaca direita, pode ocorrer como complicações tardias nos casos de canal arterial de grande débito não tratado.
A endarterite bacteriana e o aneurisma do canal arterial (ocorrendo após endarterite ou cirurgia) são raros. Por este motivo, as mais recentes recomendações internacionais não advogam a profilaxia antibiótica de endocardite bacteriana nos casos de canal arterial patente isolado.
Diagnóstico diferencial
O diagnóstico diferencial faz-se com situações que cursam com sopro contínuo e se podem apresentar com insuficiência cardíaca: não patológicas (como zumbido venoso) e patológicas (como “janela” aorto-pulmonar, fístula artério-venosa, truncus arteriosus com insuficiência da válvula truncal, fístula do seio de Valsava aórtico para o ventrículo direito, comunicação interventricular com regurgitação aórtica, e colaterais sistémico-pulmonares).
Lesões cardíacas associadas
A persistência de canal arterial associa-se mais frequentemente a comunicação interventricular e interauricular; no entanto, pode ocorrer em associação a muitas outras cardiopatias. Pode agravar a apresentação clínica de outros shunts esquerdo-direito (por exemplo, comunicação interventricular, comunicação interauricular) e de obstáculos à entrada ou saída do ventrículo esquerdo.
Existem anomalias cardíacas em que a persistência de canal arterial é necessária à sobrevivência (patologias canal-dependente) como: obstáculos graves à saída do ventrículo direito (por exemplo atrésia da pulmonar, atrésia da tricúspide) em que o fluxo pulmonar depende do canal arterial; e obstáculos graves à saída do ventrículo esquerdo (por exemplo coração esquerdo hipoplásico, coarctação da aorta) em que o fluxo sistémico depende do canal arterial. Nestes casos, no período neonatal recorre-se à administração de prostaglandina E1 ou E2 para a manutenção da permeabilidade do canal arterial enquanto se aguarda pelo tratamento cirúrgico.
Tratamento
Tratamento médico
As crianças que apresentam sinais de insuficiência cardíaca, geralmente têm uma boa resposta à terapêutica anticongestiva e podem ser mantidas neste regime até à idade conveniente para encerramento percutâneo.
Nos recém-nascidos pré-termo, o encerramento espontâneo é a regra, sendo muitas vezes necessário utilizar medidas terapêuticas como restrição hídrica, diuréticos, transfusão sanguínea e/ou ventilação assistida com pressão positiva. Nos casos em que não seja possível controlar a insuficiência cardíaca recorre-se à terapêutica médica com ibuprofeno. Este inibidor da cicloxigenase favorece o encerramento do canal arterial por redução da produção de prostaglandinas. É administrado durante 5 dias, na dose de 5 mg/Kg/dia. O ciclo pode ser repetido no caso de insucesso ou recorrência. Actualmente também se tem utilizado com bom resultado e menos efeitos secundários o paracetamol endovenoso. As contraindicações da utilização do ibuprofeno são: hipersensibilidade conhecida, sépsis, enterocolite necrosante, hemorragia gastrintestinal, coagulopatia, trombocitopénia < 50.000/mm3 e insuficiência renal. Nos doentes que apresentam contraindicação para tratamento médico deve avançar-se para cirurgia. Como complicações possíveis da terapêutica, estão descritas: hemorragia intraventricular, insuficiência renal, trombocitopénia, leucopénia e hiperbilirrubinémia.
Cateterismo cardíaco terapêutico
O encerramento do canal arterial está indicado em crianças sintomáticas e, na ausência de sintomas, no contexto de shunt esquerdo-direito significativo. O encerramento de um canal arterial pequeno, na ausência de semiologia auscultatória (“canal silencioso”) e de dilatação de cavidades esquerdas é controverso e, na opinião dos autores, não está indicado.
O encerramento do canal arterial por via percutânea é o tratamento de eleição nas crianças com peso > 5 Kg; em casos bem seleccionados (anatomia favorável) pode ser efectuado em crianças de peso inferior. Alguns autores têm utilizado esta técnica para encerramento em prematuros com anatomia favorável e peso superior a 1 kg.
O procedimento pode ser efectuado com filamentos helicoidais de libertação controlada (“detachable coils” e Nit-Occlud®) e dispositivos de malha metálica em forma cónica de Amplatzer®. As taxas de sucesso são próximas de 99% com eficácia muito elevada e taxa de complicações reduzida. As complicações potenciais são: persistência de shunt residual (5-10%), embolização do dispositivo, lesão vascular, hemólise e trombose das veias femorais. As vantagens relativamente ao tratamento cirúrgico são o menor tempo de hospitalização e de convalescença, e a evicção de cicatriz de toracotomia.
O encerramento do canal arterial está contraindicado em contexto de hipertensão pulmonar fixa.
Tratamento cirúrgico
As indicações para o tratamento cirúrgico estão restritas aos lactentes com peso inferior a 5 kg, portadores de canal arterial de grande calibre ou com morfologia incompatível com o encerramento percutâneo, e insuficiência cardíaca refractária à terapêutica médica. Nos recém-nascidos pré-termo recorre-se à cirurgia nos casos em que existe contraindicação ou falência da terapêutica médica.
Nos primeiros 5 dias de vida em RN pré-termo, a determinação sérica seriada do BNP (péptido natriurético do tipo B) constitui um biomarcador útil para definir a estratégia terapêutica nas situações de canal arterial hemodinamicamente significativo. Determinados centros utilizam os seguintes critérios – “picos” pelas 24-48 horas de vida: ~250 pg/mL <> tratamento médico; ~2.000 pg/mL <> laqueação cirúrgica.
As complicações (lesão dos nervos laríngeos recorrente ou frénico, lesão do canal torácico, hemorragia, atelectasia e derrame pleural) são raras. A taxa de persistência de shunt residual descrita na literatura situa-se entre 0,4-3%.
Seguimento
Os doentes com canal arterial não tratado devem ter seguimento permanente, para avaliar a evolução e as potenciais complicações que surjam.
Na ausência de hipertensão pulmonar ou complicações cirúrgicas, os doentes com canal arterial encerrado cirurgicamente apenas necessitam de seguimento durante seis meses após a terapêutica.
Nos casos em que foi efectuado encerramento percutâneo do canal arterial, o seguimento é mais prolongado para avaliar potenciais complicações da implantação dos dispositivos/coils utilizados. Estas, em geral, são pouco frequentes, sendo de referir a possibilidade de ocorrer estenose do ramo esquerdo da artéria pulmonar ou eventual restrição do lume aórtico. Na ausência de shunt residual não está indicada a profilaxia da endocardite bacteriana, para além de seis meses após a implantação dos dispositivos/coils.
BIBLIOGRAFIA
Alagarsamy S, Chhabra M, Gudavalli M, et al. Comparison of clinical criteria with echocardiographic findings in diagnosing PDA in preterm infants. J Perinat Med 2005; 33: 161-164
Cooke RWI. Persistent arterial duct in the preterm infant. In Anderson RH, Baker EJ, Macartney FJ, Rigby ML, Shinebourne EA, Tynan M, (eds). Paediatric Cardiology. London: Churchill Livingstone 2002; 713-720
Cruz E, Ivy D, Jaggers J (eds). Pediatric and Congenital Cardiology, Cardiac Surgery and Intensive Care. London: Springer-Verlag, 2014
Ferreira AC, Nogueira G, Kaku S. Persistência do canal arterial. In Soares-Costa JTS e Kaku S (eds). Cardiopatias Congénitas. Lisboa: Permanyer Portugal, 2005; 31-36
Hossain J, MKH. Oral paracetamol versus intravenous paracetamol in the closure of patent ductus arteriosus: a proportion meta-analysis. J Clin Neonatol 2018; 7: 121-124
Kaku S, Pinto F, Ferreira R, Trigo C, Walsh K. Oclusão do canal arterial por via percutânea com filamentos helicoidais de separação controlável. Rev Port Cardiol 1996; 15: 913-916
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Lee C-H, Chen H-N, Tsao L-Y, et al. Oral ibuprofen versus intravenous indomethacin for closure of patent ductus arteriosus in very low birth weight infants. Pediatrics and Neonatology 2012; 53: 346-353
Lewis TR, Shelton EL, Van Driest SL, et al. Genetics of the patent ductus arteriosus (PDA) and pharmacogenetics of PDA treatment. Semin Fetal & Neonatal Med 2018; 23: 232e-e238
Mine K, Ohashi A, Tsuji S, et al. B-type natriuretic peptide for assessment of haemodynamically significant patent ductus arteriosus in premature infants. Acta Paediatrica 2013; 102: e347- e352