Importância do problema
A tiroideia (ou tiróide) e as hormonas tiroideias (HT) têm um papel crucial no metabolismo energético, na mielinização do sistema nervoso central (SNC), na regulação do crescimento e na função de múltiplos órgãos. Importa recordar, a propósito, o papel da hormona segregada pelo lobo anterior da hipófise estimulando a produção de hormonas tiroideias; trata-se da TSH hipofisária (thyroid stimulating hormone/tirotrofina, tirotropina ou tirostimulina).*
As crianças, em especial o recém-nascido (RN) e o lactente, são extremamente vulneráveis às alterações da função tiroideia. O diagnóstico e tratamento precoces são, nestas idades, essenciais para prevenir consequências irreversíveis tais como a lesão permanente do SNC com impacte negativo no neurodesenvolvimento.
As doenças da tiroideia representam, sem dúvida, as afecções endócrinas mais frequentes na idade pediátrica, sendo a sua etiologia e apresentação clínica muito diferentes das do adulto, o que implica idealmente uma abordagem, pelo pediatra com experiência em endocrinologia.
*Para facilitar a compreensão deste processo de interacção bidireccional SNC-tiróide, recorda-se igualmente o significado de certas siglas: GH (growth hormone), hormona de crescimento ou somatotrópica, somatotrofina, ou somatotropina; GH-RIH (growth hormon release inhibiting hormone), hormona inibidora da libertação da GH ou somatostatina; SRH (somatotropin releasing hormone), hormona de estimulação da libertação da somatotropina; SRIF (somatotropin release inhibiting hormone), somatostatina ou factor de inibição da libertação da somatotropina). |
Anatomia e histologia
A tiroideia é uma das glândulas endócrinas de maiores dimensões, pesando cerca de 15 gramas no adulto. É constituída por dois lobos com cerca de 2,5 cm de maior diâmetro e 4 cm de comprimento, unidos por uma fina banda, o istmo. Ocasionalmente e especialmente se a glândula se encontrar aumentada de volume, um terceiro lobo piramidal surge, em forma de “dedo” projectado para cima a partir do istmo.
A glândula é constituída por unidades esféricas justapostas, denominadas folículos, envolvidas por uma rede capilar densa. O interior dos folículos está preenchido por um colóide proteico claro que é o maior constituinte da glândula. A tiróide contém também as células parafoliculares ou células C, produtoras de calcitonina que se diferenciam das células foliculares por nunca se situarem no bordo do lume folicular.
Ontogénese e fisiologia
O tecido tiroideu confina-se e está presente em todos os vertebrados. A associação filogenética com o tracto gastrintestinal é evidente numa série de funções, nomeadamente na capacidade de metabolizar o iodo e incorporá-lo em diferentes compostos orgânicos.
No ser humano, o primeiro esboço embrionário da glândula tiroideia surge pelo vigésimo dia de gestação como um espessamento endodérmico da linha média. A partir desta fase, a glândula vai progredindo por migração caudal até à sua posição final, pré-traqueal.
Simultaneamente, enquanto a migração da glândula tiroideia embrionária ocorre, as células foliculares e parafoliculares vão-se diferenciando. A síntese de HT requer a correcta expressão de genes relacionados com proteínas específicas da célula tiroideia. Para além da tiroglobulina (Tg) e tiroperoxidase (TPO), o receptor da TSH (TSHR) é também fundamental para a transdução do efeito extracelular da tirotrofina (TSH), necessário para uma síntese hormonal eficaz. Para além da TSH, existem factores de transcrição, incluindo NKX2-1 (TTF-1), PAX8, FOXE1 (TTF-2) e FOXM1 (HNF-3) essenciais para conseguir a normal diferenciação das células foliculares tiroideias e dar início à hormonogénese. O iodo é um elemento fundamental para a síntese de HT, sendo o sódio utilizado como instrumento para as bombas de sódio geradoras de energia que é necessária para a entrada do iodo. Este processo de importação simultânea de iodo e sódio do meio extracelular (sangue) para o meio intracelular, é realizado por uma proteína de membrana das células foliculares, a natrium – iodine symporter – NIS, codificada pelo gene SLC5A5.
Eis algumas etapas fundamentais do desenvolvimento tiroideu:
- – pela 8ª semana, inicia-se a síntese de Tg;
- – a captação de iodo e formação de colóide e tiroxina (T4) verifica-se pela 12ª semana de gestação, traduzindo maturação e funcionamento da tiroide fetal a partir 2º trimestre.
A normal morfogénese e migração da glândula tiroideia são TSH-independentes, uma vez que o eixo hipotálamo-hipofisário só inicia a produção de TSH fetal pelas 14 semanas. Provavelmente como resultado da maturação hipotalâmica e aumento da secreção da tyrotropin-releasing hormone (TRH), cerca das 20 semanas, os valores de TSH elevam-se na circulação fetal e mantêm-se superiores aos níveis de TSH materna. Estes níveis mais elevados parecem reflectir um “set-point” mais elevado do feed-back negativo durante a vida fetal.
Devido à elevada actividade da tiroxina-deionidase tipo III (D3) na unidade útero-feto-placentária, a T3 e T4 são inactivadas, levando a níveis de rT3 fetal elevados nos 1º e 2º trimestre, mantendo-se os níveis de T4 e T3 fetais adequados. Por outro lado, durante o 1º trimestre, as HT maternas são transferidas de forma maciça para o feto, assegurando os níveis de HT necessárias ao desenvolvimento fetal, diminuindo progressivamente até ao final da gravidez.
Assim se compreende que na gravidez a síntese de HT maternas aumente entre 20-40%. Este aumento deve-se ao aumento do volume plasmático, ao aumento de thyroxine-binding globulin (TBG) provocado pelo aumento dos estrogénios, com diminuição relativa das fracções livres e à elevada actividade da D3. Como resultado, as necessidades de iodo também aumentam associadas ao facto de surgir uma elevação da taxa de filtração glomerular renal com aumento da depuração urinária de iodo durante este período. Por esta razão, é obrigatório proceder a suplementação de iodo na gravidez. A não suplementação pode induzir hipotiroidismo na grávida e no feto, como se verificou em áreas de défice de iodo endémico ou com suplementação insuficiente.
Após o nascimento, observa-se a seguinte evolução: A TSH sobe 2-4 horas após o parto (resultado do estresse e arrefecimento) até valores de 60-80 mU/mL. Esta elevação de TSH é seguida por um marcado aumento da T3 e T4, as quais atingem valores de hipertiroidismo às 24 horas de vida (T4 : 15-19 mcg/dL) – “Hipertiroidismo fisiológico”. Como consequência, e através de mecanismo de retrocontrolo negativo, a TSH diminui ao fim de aproximadamente 48 horas para valores de 8 mU/mL.
No pré-termo, o eixo hipotálamo-hipófise-tiróide está imaturo, o que se traduz por TSH, T4 e T3 diminuídas. Os níveis de TBG, T4 total e T4 livre correlacionam-se com a idade gestacional. Também no parto, a subida de TSH não é tão evidente como nos RN de termo, e em caso de estresse respiratório ou défice nutricional, a TSH está ainda mais reduzida, podendo a T4 e especialmente a T3 caírem para níveis inferiores ao normal.
É pois fundamental ter em consideração estas variações hormonais perinatais na avaliação da função tiroideia, tanto em RN de termo como pré-termo. Uma interpretação errada dos valores pode induzir falsos diagnósticos de hipertiroidismo ou falha na detecção do hipotiroidismo. Os valores de referência para as HT estabelecidos de acordo com a idade e sexo, são valiosos instrumentos na abordagem clínica da função tiroideia da criança e adolescente.
Neste capítulo são abordadas sucintamente as afecções tiroideias com as quais o pediatra e o clínico geral mais frequentemente se defrontam.
1. HIPOTIROIDISMO
Definição e etiopatogénese
O hipotiroidismo é uma entidade clínica resultante da síntese ou acção inadequadas de HT para as necessidades dos tecidos e sistemas orgânicos.
A síntese de HT requer uma glândula tiroideia com desenvolvimento normal, um eixo hipotálamo-hipofisário funcionante e uma captação de iodo adequada.
A TRH e a somatostatina* hipotalâmicas controlam a libertação de tirotrofina hipofisária (TSH). Esta, ligando-se ao receptor da TSH na glândula tiroideia, estimula a produção e libertação de L-tiroxina (T4) e em menor quantidade de tri-iodotironina (T3). A T4 é convertida perifericamente em T3, sendo esta a forma mais activa e a responsável pela maioria dos efeitos fisiológicos. Níveis séricos elevados de HT, inibem a secreção de TRH e TSH e, consequentemente, de HT através do sistema de retrocontrolo negativo.
Dependendo da localização da lesão, o hipotiroidismo pode ser primário (causa tiroideia) ou secundário (causa central), podendo também ser congénito ou adquirido; e transitório ou permanente (Quadro 1). A causa mais frequente de hipotiroidismo congénito é a agenésia da glândula. A causa mais comum de hipotiroidismo adquirido é a doença auto-imune da tiroideia designada por “tiroidite de Hashimoto”. A resistência periférica às HT é rara, correspondendo, na maior parte das vezes, a mutações nos genes dos receptores periféricos da T3. Neste caso, o eixo está intacto (provas de TRH e TSH estão normais), e os valores de HT estão muitas vezes normais.
* A somatostatina ou SRIF – Somatotropin release inhibiting factor – diminui a concentração plasmática da hormona do crescimento (GH) ou somatotrofina, e suprime a libertação de TSH. |
Relativamente ao hipotiroidismo primário, de causa congénita, em 90% dos casos deve-se a disgenésias da tiroide (agenésia, hemiagenésia ou ectopia) que correspondem a situações esporádicas. As restantes causas são raras e incluem: – os erros da síntese hormonal (disormonogénese); – as formas transitórias que ocorrem durante a gravidez, devido a anti-corpos maternos ou a fármacos que atravessam a placenta. Está demonstrado que alguns casos de disgenésia da tiroideia estão associados a mutações em genes envolvidos no desenvolvimento da tiroideia (TTF1, TTF2, PAX 8 e o gene do receptor da TSH). O modo de transmissão pode ser autossómico dominante ou autossómico recessivo; ou ainda tratar-se de haploinsuficiência.
Os defeitos da hormonogénese são situações de transmissão hereditária autossómica recessiva. A causa mais frequente deve-se a uma mutação no gene da tiroide-peroxidase, responsável pela oxidação do iodo necessária para a síntese de HT. A síndroma de Pendred (surdez congénita e bócio por defeito da organificação do iodo), uma das situações associadas a defeito da hormonogénese mais estudadas, está associada a uma mutação do gene SLC26A4, codificador da pendrina, proteína transportadora de aniões.
O hipotiroidismo primário, de causa adquirida, surge mais tarde ao longo da infância e adolescência. A sua etiologia é variada, sendo as causas mais importantes o défice de ingestão de iodo, e nas regiões do globo em que o iodo na dieta é suficiente, a tiroidite crónica auto-imune ou doença de Hashimoto (Quadro 1). Esta última surge habitualmente durante a adolescência podendo, no entanto, ter início aos 6-9 meses de idade com sintomas mais subtis.
QUADRO 1 – Classificação e alterações bioquímicas do hipotiroidismo em idade pediátrica
| HIPOTIROIDISMO | T4 L | T3 L | TSH | CAUSAS |
| Primário congénito | ||||
| Disgenésia | ↓ | ↓ | ↑ | Total ou parcial ausência da glândula |
| Disormonogénese | ↓ | ↓ | ↑ | Defeito na síntese da HT |
| Transitório | ↓ | ↓ | ↑ | Factores maternos |
| Primário adquirido | ||||
| Tiroidite de Hashimoto | ↓ | ↓ | ↑ | Tiroidite crónica auto-imune |
| Anticorpos receptor TSH | ↓ | ↓ | ↑ | Anticorpos receptor da TSH |
| Défice de iodo | ↓ | ↓ | ↑ | Diminuição da síntese de T4 e T3 |
| Drogas | ↓ | ↓ | ↓/N | Inibição da libertação/síntese de TRH, TSH, T4 e T3 |
| Ablação | ↓ | ↓ | ↑ | Tiroidectomia, I131 |
| Secundário/central congénito | ||||
| Hipopituitarismo | ↓ | ↓ | ↓/N | Alterações no desenvolvimento do hipotálamo/hipófise |
| Défice isolado de TSH | ↓ | ↓ | ↓ | Mutação da subunidade β da TSH ou do receptor TRH |
| Secundário/central adquirido | ||||
| Hipopituitarismo | ↓ | ↓ | ↓/N | LOE, traumatismos, infecção, doenças infiltrativas |
É mais frequente no sexo feminino e em crianças com outras doenças auto-imunes, nomeadamente diabetes mellitus, síndroma poliglandular auto-imune, cromossomopatias (síndroma de Down, síndroma de Klinfelter, síndroma de Turner) e doenças metabólicas. Está demonstrado que os indivíduos portadores dos genótipos do human leucocyte antigen (HLA) DR3, 4 e 5 apresentam uma maior susceptibilidade para a doença. A patogénese da tiroidite de Hashimoto está associada à destruição de células da tiroideia mediada por células linfocitárias T citotóxicas e libertação de citocinas inflamatórias. A imunidade humoral, mediada por auto-anticorpos antiroideus tem um papel secundário na patogénese, sendo insuficiente para causar alterações clínicas. Os sintomas de hipotiroidismo só surgem quando 90% da glândula se encontra destruída. O défice de ingestão de iodo é muito frequente nas regiões montanhosas do globo (Alpes, Andes, Himalaias etc.), onde o solo é muito pobre em iodo.
O termo bócio endémico está reservado para o bócio causado por défice de iodo que afecte 10% da população. O défice de ingestão de iodo raramente causa hipotiroidismo, sendo o bócio a única manifestação clínica da doença. Determinadas drogas podem causar hipotiroidismo por inibição da TRH, TSH ou da síntese de HT. Os glucocorticóides e a dopamina inibem a TRH, e o lítio bloqueia a síntese de HT. A amiodarona interefere com a função tiroideia a diferentes níveis: pode actuar como agonista dos receptores da TSH na glândula tiroideia diminuindo a síntese de T3 e T4 e pode ter efeito nos tecidos periféricos inibindo a entrada de T4 e T3.
O hipotiroidismo secundário (ou central) de causa congénita ocorre por défice de TSH ou TRH, na maioria das vezes, num contexto de hipopituitarismo, em que outras hormonas hipofisárias estão deficitárias (ex: hormona do crescimento e gonadotrofinas). O défice isolado de TSH ou TRH é muito raro e resulta de mutações no gene da TRH, do seu receptor, ou no gene codificafor da subunidade β da TSH. As mutações do gene PIT1 e PROP1 levam a defeitos na organogénese da hipófise e consequente pan-hipopituitarismo. O hipotiroidismo central isolado pode observar-se em RN prematuros com hipotiroxinemia transitória por imaturidade do eixo HH-tiroideu.
O hipotiroidismo secundário (ou central) de causa adquirida, resulta habitualmente de doenças hipotalâmicas e/ou hipofisárias. Associam-se a outros défices hormonais causados por tumores cranianos, enfarte, irradiação, trauma, infecção ou inflamação. Uma vez que a glândula tiroideia tem capacidade para sintetizar HT na ausência de TSH, o hipotiroidismo central não é tão grave como o hipotiroidismo de causa primária.
Aspectos epidemiológicos
O hipotiroidismo congénito tem uma incidência variável de acordo com a área geográfica, estimando-se em média 1/3.500, sendo 2 vezes mais frequente no sexo feminino. As causas de hipotiroidismo congénito são na grande maioria primárias: disgenésia da tiroideia na proporção de 1/4.000; disormonogénese ~1/30.000 e hipotiroidismo transitório ~1/40.000. Apenas 5-10% dos casos de hipotiroidismo congénito são secundários a uma causa central. A tiroidite de Hashimoto é mais frequente no sexo feminino, numa proporção de 4/1. Quanto ao défice de iodo, estima-se que esta situação afecte cerca de 200 milhões de pessoas ao nível do globo.
Manifestações clínicas
O hipotiroidismo pode afectar todos os órgãos e sistemas. As manifestações clínicas são independentes da causa subjacente mas dependentes da idade de aparecimento e do grau do défice hormonal. A existência ou não de história familiar de doença tiroideia ou da hipófise é importante para o diagnóstico. Os sinais e sintomas podem ser subtis (estão descritos casos assintomáticos) nos primeiros 2 meses de vida e incluem a má progressão estaturo-ponderal, dificuldades alimentares, icterícia, hipotonia, macroglossia, fácies grosseiro, hernia umbilical e defeitos cardíacos congénitos. Se não tratado nos primeiros 3 anos de vida, o hipotiroidismo deixa marcas irreversíveis no desenvolvimento do sistema nervoso central (SNC) – com défices cognitivos graves. Por isso o rastreio do hipotiroidismo congénito faz parte dos programas de rastreio no período neonatal em quase todo o mundo, sendo fundamental para o diagnóstico precoce (identificação da doença antes do início de qualquer sintomatologia) desta doença.
Em Portugal, o diagnóstico precoce do hipotiroidismo congénito neonatal, associado ao rastreio da fenilcetonúria e doutras doenças hereditárias metabólicas, é o único programa de rastreio de doenças infantis realmente eficaz. Também conhecido pelo teste do “pézinho”, é realizado entre o 3º e o 6º dia de vida e consiste no doseamento de TSH (análise de sangue capilar feita actualmente no Instituto Nacioinal de Saúde Doutor Ricardo Jorge-Porto). Em caso de dúvida ou suspeita, doseia-se a T4. É importante referir que mesmo em RN com TSH e T4 normais, poderá vir a desenvolver-se hipotiroidismo nas primeiras semanas ou nos primeiros meses de vida. Assim, um segundo teste de diagnóstico precoce deve ser realizado nos seguintes casos: quando a colheita ocorre antes do 3º dia de vida, nos RN pré-termo com < 37 semanas, nos RN de baixo peso, em gémeos, em RN em estado crítico, e nos submetidos a transfusões e/ou medicados com agentes tópicos com iodo ou com fármacos com interferência na função tiroideia (dopamina, glucocorticóides, etc.). A Figura 1 exibe fácies de lactente com quadro clínico hipotiroidismo na era pré-rastreio neonatal no nosso país.
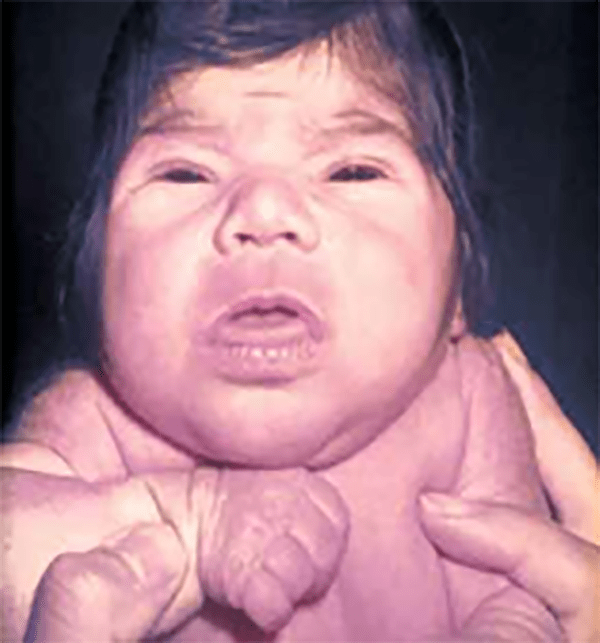
FIGURA 1. Fácies inexpressiva de lactente com hipotiroidismo congénito
Na criança mais velha, os sinais predominantes podem ser atraso do desenvolvimento psicomotor, baixa estatura, atraso na maturação óssea e na dentição, miopatia e hipertrofia muscular, cansaço, hipotonia, pele seca e atraso pubertário. O bócio, é um sinal frequente na tiroidite de Hashimoto.
Em casos raros, o hipotiroidismo primário grave pode levar a aumento da glândula mamária na rapariga e a aumento do volume testicular no rapaz. O mecanismo exacto é ainda desconhecido mas uma das teorias é a de que a TSH em excesso estimula o receptor da follicle stimulating hormone (FSH) a nível das gónadas. Estas crianças, apresentam desaceleração do crescimento e atraso da maturação óssea, contrariamente ao tipicamente encontrado na puberdade precoce. A estimulação das células produtoras de prolactina pela TSH em excesso leva por vezes ao aparecimento de galactorreia. A presença de prolactina em circulação vai inibir por retrocontrolo negativo a LH, mas não a FSH.
No pré-termo é frequente encontrar hipotiroxinémia com valores de TSH normais. Trata-se de uma alteração transitória que desaparece aos 2 meses de vida. O cretinismo é um termo histórico, que se refere à constelação de défices cognitivos e físicos consequentes do hipotiroidismo não tratado na criança. Devem fazer parte do diagnóstico diferencial de hipotiroidismo neonatal com a glândula tiroideia “in situ”, a síndroma de Down, a síndroma de Pendred com ou sem bócio, e o pseudo-hipoparatiroidismo.
Exames complementares
O diagnóstico de hipotiroidismo baseia-se na clínica e, sobretudo, na avaliação laboratorial da função tiroideia: determinação de TSH, T3 e T4 livres (L) ou totais, e detecção de anticorpos antitiroideus.
O doseamento de Tg, a proteína da matriz hormonal tiroideia cuja síntese depende da TSH, reflecte a síntese hormonal intratiroideia e permite avaliar a adequação terapêutica, bem como erros de síntese hormonal.
O hipotiroidismo primário confirma-se pelo aumento de TSH com diminuição de T4L, independentemente da T3. O doseamento de TSH é sem dúvida o parâmetro diagnóstico mais sensível, pelo que o seu doseamento é muitas vezes utilizado para detecção de doença tiroideia.
Quando se observa uma elevação da TSH isolada, sem alterações da T4 ou T3, trata-se de um hipotiroidismo subclínico que não está associado a alterações clínicas habitualmente. A tiroidite de Hashimoto caracteriza-se pela elevação da TSH, diminuição da T4L e anticorpos antitiroideus positivos. Em 90% dos casos, é o anticorpo contra a tireoperoxidase (TPO) que está elevado, associado ou não ao aumento do anticorpo anti-tiroglobulina (anti-Tg). Este último, encontra-se elevado em 15% da população saudável, e isoladamente não é considerado patológico.
O hipotiroidismo secundário, devido a défice de TRH ou de TSH, caracteriza-se pela diminuição de T4L com TSH normal ou diminuída.
Na resistência periférica às HT, todos os valores, HT e TSH encontram-se normais ou elevados.
A síndroma da doença eutiroideia ou síndroma da T3 baixa é uma disfunção transitória da tiroideia que surge em doença grave ou após intervenções cirúrgicas complexas, muito frequente em contexto de cuidados intensivos. O perfil laboratorial assemelha-se ao do hipotiroidismo secundário em que a TSH está normal ou diminuída, e a T3 diminuída; no entanto, a T4 está normal e a rT3 está normal ou elevada.
A ecografia é um exame bastante sensível para a localização e avaliação da glândula, mesmo em lactentes.
A cintigrafia com I123 ou Tc99 é importante para o diagnóstico das disgenésias da tiroideia (agenésia, hemiagenésia, ectopia), mas não deve ser utilizada como exame de rotina no hipotiroidismo congénito.
Tratamento
O tratamento do hipotiroidismo requere a substituição de HT, independentemente da causa. A levotiroxina, forma sintética da tiroxina (T4) é a droga de eleição no tratamento do hipotiroidismo da criança e adolescente.
No hipotiroidismo congénito o tratamento deve ser iniciado o mais cedo possível, antes das 2 semanas de vida com 10-15 µg/kg via oral (aprox. 50 µg no RN de termo). Os valores de TSH vão descendo até aos 15 dias, sendo desejável manter os valores de T3 e T4 nos limites superiores do normal para a idade. O comprimido, em toma única e diária, deve ser dado em jejum (30 minutos antes da refeição). No dia do controlo, a colheita de sangue deve ser feita pelo menos 4 horas após a última toma. Em RN com hipotiroidismo grave, deve iniciar-se a terapêutica com dose máxima, uma vez que os efeitos adversos na criança são mínimos e o risco de lesões irreversíveis por hipotiroidismo grave deve ser diminuído o mais rapidamente possível. O seguimento inicial deve ser quinzenal até à normalização da TSH, depois de 3 em 3 meses até aos 3 anos e, a partir daí, semestralmente até terminar o crescimento. Com a idade, a dose de L-tiroxina vai diminuindo, “por kg de peso”, sendo de 1-3 mcg/ kg/dia a partir dos 12 anos ou de 100 mcg/m2.
Nas crianças com hipotiroidismo primário, a dose é ajustada pela TSH. No hipotiroidismo secundário a dose é ajustada pela T4, sendo o objectivo obter valores de T4 inferiores aos valores alvo no hipotiroidismo primário. Nos casos em que não tenha sido possível confirmar o diagnóstico e em que se tenha iniciado a terapêutica, esta deve ser mantida até aos 2 anos de idade, quando a maturação do SNC está praticamente completa. A interrupção terapêutica deve ser feita 4 semanas antes da avaliação da função tiroideia.
No seguimento do hipotiroidismo congénito são aconselháveis testes de audição e avaliação do neurodesenvolvimento. A administração de T3 tem efeitos benéficos em casos de doença não tiroideia grave, designadamente no que respeita à função miocárdica.
2. HIPERTIROIDISMO/TIREOTOXICOSE
Definição e etiopatogénese
Tireotoxicose é o termo que designa o conjunto de manifestações clínicas resultantes do excesso de HT nos tecidos periféricos. O termo hipertiroidismo refere-se ao estado de tireotoxicose em que a causa é a hiperprodução de HT pela glândula tiroideia. A causa mais frequente de hipertiroidismo é a doença de Graves (ou doença de von Basedow) também denominada por hipertiroidismo auto-imune. Na criança, a tireotoxicose é rara, sendo a doença de Graves a causa mais frequente (95% dos casos). (ver Glossário)
A doença de Graves resulta da produção anormal de autoanticorpos estimulantes do receptor da TSH (Thyrotropin Receptor Antibodies ou TRAbs). Os TRAbs ligam-se ao domínio extracelular do receptor da TSH, estimulando a função e crescimento da célula folicular da tiroideia e a secreção excessiva de HT. Para além de anticorpos (Ac) estimulantes (os TRAbs), são detectáveis outros Ac no hipertiroidismo auto-imune, tais como Ac bloqueantes do receptor TSH (TRAbs bloqueadores), Ac antitiroperoxidase (TPO) e antitiroglobulina. A doença de Graves é uma doença com forte componente hereditário, evidenciado pelo aumento de incidência de doenças auto-imunes em familiares tais como, a doença de Hashimoto, diabetes mellitus tipo 1, doença celíaca e doenças reumatológicas.
Em 60% dos doentes com doença de Graves existe história familiar de doença auto-imune da tiroideia. A tendência para anticorpos antitiroideus parece ser um traço autossómico dominante associado ao gene do cytotoxic T-lymphocyte antigen 4 (CTLA4), codificador da modulação do 2º sinal das células T. No entanto, estudos genéticos comprovaram tratar-se de uma doença poligenética, em que a maioria dos genes implicados é ainda desconhecida.
A maior frequência dos haplótipos HLA DR3 e DQA10501 da região do HLA (Human Leucocyte Antigen), contribui apenas para 5% da susceptibilidade genética para a doença de Graves. Para além dos genes do HLA e CTLA4, outros genes relacionados com a imuno-regulação contribuem para a susceptibilidade para esta doença, nomeadamente o gene da lymphoid tyrosine phosphatase (PTPN22), o gene da molécula sinalizadora CD40, e do receptor da IL-2. A doença de Graves é mais prevalente no sexo feminino, após a puberdade. O estresse nos 12 meses precedentes, bem como o contacto com substâncias iodadas ou drogas contendo iodo (ex: amiodarona) podem ser factores precipitantes.
A tireotoxicose neonatal é também de causa auto-imune (doença de Graves neonatal). Surge em 5% dos RN de mães com doença de Graves quando o valor dos TRAbs é muito elevado. Consequência da passagem de TRAbs maternos através da placenta, o hipertiroidismo neonatal regride espontaneamente ao fim de 3 semanas a 5 meses de vida, uma vez que os anticorpos (Ac) maternos têm uma semi-vida de 3 meses.
Outras causas de tireotoxicose por hipertiroidismo são: o nódulo autónomo funcionante da tiroideia que, sendo independente do controlo normal do eixo hipotálamo-hipofisário, leva à produção excessiva de HT circulantes. Na criança pode tratar-se de um adenoma tóxico cuja patogénese tem por base mutações somáticas “com ganho de função” na via de sinalização do receptor da TSH.
A síndroma de McCune Albright pode ocorrer com hipertiroidismo, associado a um ou vários nódulos funcionantes. Na sua base está uma mutação activadora não hereditária do gene GNAS1. O carcinoma folicular ou papilar funcionante é raro. O bócio multinodular tóxico é uma causa de hipertiroidismo mais frequente em adultos.
O hipertiroidismo por excesso de TSH é habitualmente devido a adenoma hipofisário ou, muito raramente, à resistência hipofisária às HT. Surge igualmente no sexo feminino e masculino e em ambos os casos pode ocorrer de forma esporádica ou familiar.
A tireotoxicose pode surgir numa fase inicial da tiroidite de Hashimoto, resultante da inflamação da glândula e da destruição maciça auto-imune de folículos tiroideus, levando à libertação de HT armazenadas. Também os processos de tiroidite subaguda pós-infecção vírica, ou tiroidites infecciosas, podem causar tireotoxicose, devido à inflamação glandular com destruição folicular e consequente libertação de HT. A ingestão de iodo em excesso e de HT iatrogénica, são também causas raras de tireotoxicose transitória.
Pelo facto de a hormona gonadotrópica coriónica humana ou human chorionic gonadotropin (hCG ou gonadotrofina) apresentar também afinidade para o receptor da TSH (estimulando a glândula tiroideia, mas com menor intensidade do que a TSH), em raríssimos casos de tumores do trofoblasto pode surgir hipertiroidismo. São exemplos a mola hidatiforme e o coriocarcinoma que, obviamente, só ocorrem em adolescentes ou jovens em idade fértil (Quadro 2).
QUADRO 2 – Classificação e alterações bioquímicas da tireotoxicose na criança e adolescente
| TIREOTOXICOSE | T4 L | T3 L | TSH | CAUSAS |
| Hipertiroidismo | ||||
| Doença de Graves juvenil | ↑ | ↑ | ↓ | Anticorpos estimulantes do receptor de TSH (TRAbs) |
| Doença de Graves neonatal | ↑ | ↑ | ↓ | Passagem transplacentária de TRAbs |
| Adenoma tóxico | ↑ | ↑ | ↓ | Mutação activadora do receptor da TSH |
| Síndroma de McCune Albright | ↑ | ↓ | Mutação activadora da proteína Gα | |
| Adenoma hipofisário | ↑ | ↑ | ↓ | Aumento da secreção de TSH |
| Tumores do trofoblasto (mola hidatiforme; coriocarcinoma) | ↑ | ↑ | ↓ | Tumor placentário produtor de hCG (agonista do receptor da TSH) |
| Tiroidite | Inflamação da glândula | |||
| Hashimoto | N | ↑/N | Auto-imune, exacerbação aguda inicial | |
| Pós-infecção vírica – subaguda (de Quervain) | ↑ | ↑ | ↓/N | Viral |
| Infecciosa | ↑ | ↑ | ↓/N | Bacteriana |
| Por drogas (lítio, amiodarona e interferão) | ↑ | ↑ | ↓/N/↑ | Estimulação da libertação/síntese de T4 e T3 |
| Drogas (ex. amiodarona) Ingestão de iodo | ↑ | ↑ | ↓/N/↑ | Estimulação da libertação/síntese de T4 e T3 |
| HT exógenas | ↑ | ↑ | ↓ | Ingestão de levotiroxina |
Aspectos epidemiológicos
Em áreas com abundância de iodo, a doença de Graves, uma das doenças mais frequentes da tiroideia, corresponde a cerca de 50-80% dos casos de tireotoxicose. Na criança, a incidência da doença de Graves é muito inferior à do adulto, mas continua a ser a causa mais frequente de tireotoxicose na criança (96% dos casos). A prevalência desta doença é de 0,02 por cento (1:5000), na maioria entre os 11-15 anos de idade. As raparigas são mais afectadas que os rapazes (5:1), e a prevalência vai aumentando com a idade atingindo um pico na adolescência, sugerindo a existência de uma influência dos estrogénios na ocorrência da doença de Graves.
Manifestações clínicas
As manifestações clínicas da tireotoxicose são comuns a todos os estados tireotóxicos, independentemente da etiologia. Os sinais e sintomas estão relacionados com as quatro funções nucleares das HT a nível dos órgãos e sistemas: aumento do metabolismo basal, alterações cardiovasculares, estimulação do sistema nervoso simpático e alteração do crescimento e maturação dos tecidos (Quadro 3).
QUADRO 3 – Clínica de tireotoxicose na criança e adolescente
| GERAIS |
| Ansiedade Hipersudorese Intolerância ao calor Irritabilidade Insónia Perda de peso |
| CARDIOVASCULARES |
| Taquicárdia Hipertensão arterial Arritmias |
| HEMATOLÓGICA |
| Anemia normocítica |
| NEUROLÓGICAS |
| Hiperreflexia osteotendinosa Tremores das extremidades |
| OFTALMOLÓGICAS |
| Protusão do globo ocular (proptose/exoftalmia) Atraso no movimento das pálpebras Olhar extasiado |
| APARELHO REPRODUTOR |
| Irregularidades menstruais |
Do quadro clínico da doença de Graves, fazem parte os sinais e sintomas clássicos de tireotoxicose e as manifestações específicas da doença. É característico o aumento difuso e simétrico da glândula (2-3 vezes o normal), com consistência firme e elástica que pode ser acompanhada por um sopro arterial ou frémito. Para além do “olhar extasiado” e atraso no movimento das pálpebras, característicos da tireotoxicose, a proptose ou exoftalmia são manifestações oculares únicas da doença de Graves. Resulta do crescimento dos tecidos retro-orbitários secundário a inflamação, deposição de glicosaminoglicanos e fibrose, com deslocamento anterior da órbita. Acompanha-se muitas vezes de edema periorbitário e hiperémia conjuntival, e mais raramente de quemose, diplopia e dor ocular.
A evolução clínica da doença é bastante insidiosa (meses). Na criança, os primeiros sintomas são frequentemente alterações do comportamento e diminuição do rendimento escolar, seguidos de irritabilidade, hiperactividade e insónia. Por outro lado, pode surgir fadiga, letargia e nictúria.
A oftalmopatia surge em apenas 50% das crianças com doença de Graves e é habitualmente uma forma ligeira (Figura 2). A dermopatia ou mixedema pré-tibial é extremamente rara na criança e está associada a oftalmopatia severa.

FIGURA 2. Fácies de hipertiroidismo: protusão dos globos oculares
O RN com tireotoxicose congénita apresenta características específicas salientando-se: prematuridade ou baixo peso, irritabilidade, má progressão ponderal ou excessiva perda de peso (apesar do apetite muitas vezes voraz), e dificuldade em adormecer. Existe também taquicárdia, febrícula, e hipersudorese. O aumento de volume da glândula tiroideia é visível, provocando muitas vezes dificuldade respiratória por compressão traqueal. Se a causa for a doença de Graves neonatal, pode existir protusão ocular. Quando o diagnóstico não é feito atempadamente na primeira infância, pode surgir craniossinostose prematura, situação grave que obriga a intervenção cirúrgica correctiva.
Exames complementares
Na presença de manifestações clínicas de tireotoxicose, tipicamente, a concentração de TSH é < 0,1mU/L (indoseável) e de T4L está elevada. Se a causa da tireotoxicose for o hipertiroidismo de Graves, a T3L está mais elevada do que a T4L. Numa fase inicial, após excluir a ingestão iatrogénica de HT ou de outras substâncias tireomiméticas, é importante distinguir se a tireotoxicose é devida a hipertiroidismo ou tiroidite. Nesta última, observa-se um aumento da velocidade de sedimentação. A associação de TSH elevada, com T3L e T4L também elevadas, é rara e sugere a existência de um adenoma da hipófise, produtor de TSH.
A quantificação de TRAbs, permitindo confirmar o diagnóstico clínico de doença de Graves, é utilizada como indicador prognóstico da doença. Nos doentes tratados com antitiroideus, a persistência de níveis elevados de TRAbs é preditiva de recidivas após ter cessado o tratamento. Por outro lado, a não detecção de TRAbs não exclui a doença de Graves.
Os Ac antitiroideus (anti-TPO e anti-Tg) são característicos da tiroidite de Hashimoto, mas podem encontrar-se também na doença de Graves.
Suspeitando-se de doença de Graves neonatal aquando do nascimento, os doseamentos das HT, TSH e Ac devem ser feitos a partir de sangue do cordão umbilical.
No hipertiroidismo, a ecografia revela um aumento difuso da glândula com ecogenecidade não homogénea e sinais de perfusão aumentada na modalidade de Doppler.
A cintigrafia da tiroideia com I123 ou Tc99m deve realizar-se em doentes com nódulos detectados através da ecografia, para detecção de nódulos funcionantes. É também considerada o exame mais fidedigno para o diagnóstico diferencial entre a tireotoxicose devida a hipertiroidismo ou tiroidite. Na primeira, a captação de I123 ou Tc99m encontra-se difusamente aumentada, e na segunda está diminuída.
Tratamento
O tratamento da doença de Graves é obrigatório uma vez que esta doença raramente regride espontaneamente. As opções terapêuticas incluem o tratamento médico com antitiroideus de síntese (AT), a ablação por iodo radioactivo e a excisão cirúrgica. Qualquer destas modalidades não é dirigida à fisiopatologia da doença e acarreta riscos e benefícios que devem ser considerados em qualquer idade, e principalmente no tratamento de crianças.
Os antitiroideus, utilizados na abordagem inicial do hipertiroidismo, incluem 3 tipos de tionamidas- o propiltiuracilo, o carbimazol e o seu metabólito, o metimazol. Todos actuam a nível da síntese de HT, inibindo a enzima tireoperoxidase, responsável pela iodinização da tirosina e tiroglobulina. O propiltiuracilo é o único que actua também perifericamente, inibindo a conversão de T4 em T3, mas é 10-20 vezes menos potente do que o carbimazol ou metimazol, e tem uma semi-vida mais curta. Habitualmente, são necessárias 6-8 semanas para resolver a tireotoxicose e normalizar a função tiroideia. Uma vantagem das tionamidas é a monitorização do seu efeito por simples colheita de sangue. Todos os AT podem provocar efeitos secundários ligeiros, nomeadamente exantema, urticária, artralgias e síndroma simile lúpus.
A granulocitopénia e a hepatite são efeitos mais raros. Actualmente, apenas o metimazol ou carbimazol estão indicados para o tratamento médico do hipertiroidismo abaixo dos 18 anos. Isto deve-se à elevada hepatotoxicidade do propiltiuracilo, revelada por casos de hepatite fulminante com falência hepática irreversível, obrigando em geral a transplante hepático.
A dose de metimazol e carbimazol varia entre 0,5 a 1 mg/kg/dia e pode ser prescrito em toma única.
As soluções contendo iodo (ex. solução de Lugol) inibem a libertação de HT de forma muito rápida, sendo a opção ideal para o tratamento inicial da tirotoxicose grave, frequente na doença de Graves neonatal.
Os beta-bloqueantes – propranolol (1 mg/kg/dia), bem como a dexametasona, podem ser utilizados no início da terapêutica, para alívio dos sintomas do sistema nervoso autónomo e para promover o bloqueio periférico da conversão de T4 em T3, enquanto os antitiroideus ainda não tenham originado efeito.
Nas crianças tratadas com AT ocorre remissão ao fim de 2 anos de tratamento em apenas 25% dos casos, sendo a frequência de recidivas em rapazes e raparigas de 30%. Estudos recentes concluíram que o tratamento mais prolongado (máximo 10 anos), aumenta para 50% a frequência de remissões. A puberdade é um factor que influencia a possibilidade de remissão; crianças pubertárias entram mais facilmente em remissão do que crianças pré-pubertárias. Glândulas de maiores dimensões e níveis de TRAbs mais elevados, são preditivos de taxas de remissão mais reduzidas.
Para um tratamento definitivo, a ablação com iodo radioactivo ou excisão cirúrgica são os procedimentos mais indicados. O tratamento com I131 é largamente utilizado nos Estados Unidos, mesmo em crianças. O seu índice de cura é ~ 90%, sendo o menos dispendioso para o tratamento da doença de Graves. O tecido tiroideu da criança é mais sensível à ablação com o iodo do que o do adulto. No entanto, glândulas de grandes dimensões, apresentam menores taxas de sucesso terapêutico com I131. Cada vez mais utilizada, esta opção terapêutica deve ser evitada em crianças pequenas, e deve ser ponderada em caso de oftalmopatia grave por risco de agravamento desta última. Trata-se de uma boa opção terapêutica em casos de tireotoxicose por nódulo funcionante da tiroideia. Apesar dos conhecidos efeitos adversos a longo prazo do iodo radioactivo, estudos de seguimento prolongados não comprovaram o potencial risco carcinogénico (tiroideu e extratiroideu) em crianças tratadas com doses de I131 > 150 uCi por gm. Por outro lado, não se observou maior número de defeitos genéticos em filhos de indivíduos tratados com I131 durante a infância ou adolescência.
A tiroidectomia total permite níveis de cura de cerca de 90%, levando ao hipotiroidismo na quase totalidade dos casos. Implica um processo cirúrgico complexo que pode resultar em hipoparatiroidismo ou disfonia devido à lesão do nervo recorrente. Está indicada em crianças com menos de 5 anos, sempre que se pretende um tratamento definitivo, em crianças pequenas com recidivas ou complicações importantes do tratamento médico, nódulos funcionantes, e em RN com hipertiroidismo congénito não familiar, grave.
3. BÓCIO
Definição e etiopatogénese
O bócio ou tiromegália define-se como o aumento de volume da glândula tiroideia para além dos limites normais para a idade, independentemente da etiologia e da função tiroideia. Pode ser difuso ou nodular e a síntese de HT estar normal, diminuída ou aumentada.
As causas de bócio na criança e no adulto são semelhantes, variando de forma significativa a suas frequências relativas: nos EUA, a tiroidite crónica auto-imune é a causa de bócio mais frequente na criança, sendo o bócio nodular não tóxico a causa predominante no adulto. A nível mundial, o bócio endémico (por défice de iodo) é o mais frequente, afectando 200 milhões de pessoas, sendo as regiões montanhosas da América do Sul e Ásia Central, as de maior prevalência.
Os factores etiológicos de bócio na infância são múltiplos (Quadro 4). O bócio pode estar presente ao nascer- congénito, ou detectar-se mais tarde, em qualquer idade- adquirido. Os erros genéticos da hormonogénese estão descritos em qualquer passo da síntese de HT, são de transmissão autossómica recessiva e correspondem a 15% dos hipotiroidismos congénitos, podendo ou não causar bócio. A passagem transplacentária de Ac maternos em filhos de mãe com tiroidite auto-imune crónica ou doença de Graves podem alterar a função tiroideia com aparecimento de bócio fetal e neonatal.
O aumento da glândula pode ocorrer como consequência de mecanismos de estimulação, de inflamação ou infiltração.
QUADRO 4 – Causas de bócio
| Bócio congénito | Bócio adquirido |
| Passagem transplacentar de Acs maternos | Tiroidite de Hashimoto (Tiroidite crónica auto-imune) |
| Ingestão de drogas bociogénicas ou hormonas tiroideias (raramente causa bócio) | Bócio colóide |
| Erros de hormonogénese | Bócio por défice de iodo |
| Mutação activadora do receptor de TSH | Ingestão de substâncias bociogénicas |
| Mutação activadora da subunidade alfa da proteína G (S. McCune Albright) | Bócio por tiroidite não auto-imune
|
| Hemiagenésia | Doença infiltrativa |
| Tumor | Bócios por hipertiroidismo
|
| Quisto do canal tireoglosso, quisto tiroideu | |
| Adenomas e carcinomas da tiroide |
A estimulação ocorre no início como resultado do excesso de TSH – por défice de iodo ou hipotiroidismo, ou devida a Ac anti-receptor da TSH, na doença de Graves. Os bociogénicos são substâncias químicas, drogas ou alimentos que ao interferirem com a síntese de HT, aumentam a estimulação da glândula pela TSH, podendo levar ao aparecimento de bócio.
Os bociogénicos mais comuns incluem os antitiroideus, os iodetos e o lítio. Certos alimentos contendo tiocianatos tais como as couves, couve-flor, couves de Bruxelas, batata doce, mandioca e soja, contêm substâncias bociogénicas, mas quando consumidos isoladamente raramente tal acontece. Nas crianças, os bociogénicos mais comummente ingeridos são os expectorantes contendo iodo e o lítio.
Mais raramente, o bócio por excesso de TSH é resultado de secreção hipotalâmica ou hipofisária aumentadas (ex. adenoma da hipófise ou resistência hipofisária às HT).
A inflamação por agentes infecciosos (bactérias, vírus ou fungos) pode causar tiroidite aguda ou subaguda granulomatosa, com bócio. Esta última, causada por vírus é também conhecida por doença de “de Quervain”. No entanto, a infecção da glândula tiroideia é uma situação extremamente rara na criança. A causa mais frequente de inflamação é a tiroidite crónica auto-imune, ou tiroidite de Hashimoto. Esta endocrinopatia é considerada a mais frequente causa de bócio na criança fora das regiões de bócio endémico. O aumento de volume da tiroideia é causado pela infiltração linfocítica (que pode ser difusa e posteriormente nodular) levando, neste último caso, a dificuldades no diagnóstico diferencial com tumores da tiroideia.
O bócio por infiltração deve-se a doenças como a histiocitose X ou cistinose, responsáveis por infiltração histiocítica ou deposição de cristais de cistina respectivamente; nas formas mais severas poderá daí resultar hipotiroidismo.
Outros processos que podem ser causa de bócio, são as neoplasias (adenoma ou carcinoma) ou processos não neoplásicos (quisto, adenopatia ou quisto do canal tireoglosso). Na criança e adolescente, a neoplasia da tiroideia surge como nódulo único isolado.
Manifestações clínicas
O bócio cursa habitualmente com eutiroidismo e, raramente, com hipotiroidismo. Em regra, o bócio começa por ser difuso, evoluindo posteriormente para nodular. Pode haver complicações quando comprime estruturas adjacentes, nomeadamente: as vias respiratórias, causando dificuldade respiratória; o nervo recorrente levando a rouquidão; ou o esófago, provocando disfagia.
O bócio colóide simples, é de etiologia desconhecida. Podendo ser familiar, de transmissão autossómica dominante, ocorre sobretudo em raparigas adolescentes. Nestas doentes não há história de ingestão de bociogénicos ou de défice de iodo; verifica-se aumento difuso da tiróide, que muitas vezes se torna nodular e assimétrica. O bócio não é doloroso à palpação e apresenta uma consistência firme, lisa ou discretamente nodular. Por vezes, podem estar presentes gânglios linfáticos regionais, não dolorosos (Figura 3). O bócio colóide é assintomático e não causa alterações da função tiroideia. Pode diminuir de dimensões com a idade (bócio da puberdade), e o tratamento com T4 não altera o curso da doença.
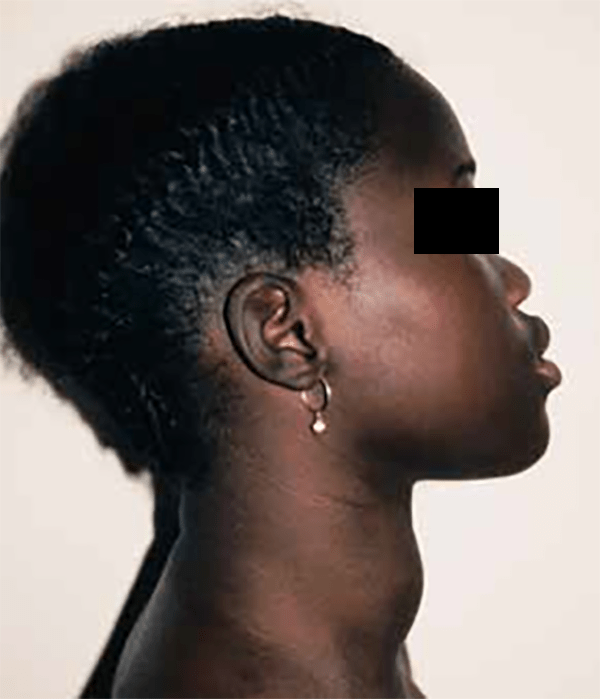
FIGURA 3. Bócio observado de perfil
Sempre que surge bócio doloroso à deglutição ou palpação, deve suspeitar-se de tiroidite infecciosa aguda ou subaguda. Inicialmente pode existir febre e sintomatologia de tireotoxicose por libertação maciça de HT. Segue-se uma fase de eutiroidismo, depois de hipotiroidismo, com posterior recuperação.
A maioria das crianças e adolescentes com tiroidite de Hashimoto apresenta-se com bócio assintomático, referindo por vezes dor ou “sensação de preenchimento” nesta região. Na maioria das vezes, são detectados num exame de rotina ou por existência de um nódulo notado pelos pais. Encontram-se geralmente em eutiroidismo, mas podem apresentar hipotiroidismo subclínico ou hipotiroidismo franco. Neste último caso, manifesta-se por restrição de crescimento, diminuição da velocidade de crescimento e atraso pubertário. Ocasionalmente, ocorre uma fase inicial tireotóxica, como resultado da libertação maciça de HT, devido à inflamação e consequente destruição das células foliculares da tiroideia. Nestes casos, deve fazer-se o diagnóstico diferencial com a doença de Graves; podem raramente coexistir ambas as doenças no mesmo paciente (Hashitoxicose). Nalguns casos de tiroidite de Hashimoto, em vez de bócio, pode surgir atrofia da glândula (tiroidite atrófica).
A tiroidite de Hashimoto, surgindo frequentemente em crianças com síndroma de Turner, trissomia 21 e síndroma de Klinefelter, é parte integrante de síndromas poliglandulares auto-imunes.
Exames complementares
Na suspeita de bócio por carência de iodo, a excreção urinária de iodo (IU) é o exame de eleição para o diagnóstico (que só tem interesse a nível populacional). Valores de excreção de IU < 100 mcg/L revelam deficiência moderada de iodo; IU < 50 mcg/L, uma deficiência acentuada; e IU < 20 mcg/L, uma deficiência severa. No bócio por défice de iodo, a ecografia da tiroideia revela aumento de volume da glândula com ecogenicidade heterogénea.
Na presença de um bócio, o doseamento de Ac (TPO e Tg) para a detecção de doença auto-imune da tiroideia é uma regra. No bócio colóide simples, o doseamento de Ac anti-TPO é negativo. Cerca de 40% a 70% destes pacientes apresentam Ac anti-Tg positivos, cujo significado não está ainda esclarecido.
O diagnóstico de tiroidite crónica auto-imune é feito pela detecção de níveis elevados de Ac anti-tiroglobulina (Tg) e/ou Ac anti-tiroperoxidase (TPO), e pela avaliação funcional da tiroideia. A ecografia da tiroideia revela sinais de glândula aumentada de volume com zonas de ecogenicidade heterogénea. Tem indicação em pacientes com Ac negativos ou com um nódulo palpável, mas raramente é necessária.
Tratamento
As necessidades diárias de iodo são cerca de 100 a 150 µg. O tratamento do défice de iodo faz-se com suplemento de iodo. Nas crianças até aos 5 anos: cerca de 90 µg/dia; nas crianças dos 6-12 anos: cerca de 120 µg/dia; e nos adolescentes: 150 µg/dia. Sempre que o volume da glândula não se reduz com o suplemento em iodo, em bócios pequenos, difusos e recentes, deve iniciar-se o tratamento com L-tiroxina.
O tratamento da tiroidite auto-imune depende da função tiroideia. Na maioria dos casos, crianças e adolescentes encontram-se em eutiroidismo. Em casos de hipotiroidismo franco (TSH > 10 mU/L e T4 e T3 livres diminuídas) deve iniciar-se L-tiroxina, em dose variável (50-100 µg/dia), de modo a que o valor da TSH volte ao normal. Se o hipotiroidismo é severo e prolongado, a correcção com L-tiroxina deve ser gradual para evitar efeitos adversos.
O tratamento do hipotiroidismo subclínico é controverso. No entanto, sempre que as T4 e T3 livres evidenciam valores normais, mas TSH > 10 mU/L, deve iniciar-se L-tiroxina. Se a tiroidite decorrer com elevação de HT, não está indicada a terapêutica com antitiroideus, uma vez que a glândula habitualmente retorna ao estado de eutiroidismo ao fim de 1 a 2 meses, podendo mesmo surgir hipotiroidismo. O propranolol pode aliviar os sintomas na fase de hipertiroidismo por bloqueio do sistema simpático.
Evolução
O seguimento destas crianças faz-se com doseamentos de HT e TSH trimestral ou semestralmente. Nos doentes em tratamento com L-tiroxina, alguns autores preconizam a sua suspensão na puberdade, uma vez que num número significativo de casos se observa remissão completa da tiroidite de Hashimoto. De referir que cerca de 10% dos doentes com tiroidite auto-imune em eutiroidismo evoluem secundariamente para hipotiroidismo, razão pela qual anualmente se deve proceder a uma avaliação funcional da tiroideia. Nestes casos a doença tem um carácter permanente e não transitório.
4. NÓDULOS ISOLADOS DA TIROIDEIA
Importância do problema
Os nódulos isolados da tiroideia são raros na criança. No entanto, são mais frequentemente malignos na criança do que no adulto. Estima-se que em ~25% dos casos de nódulos isolados tiroideus na criança exista malignidade, em comparação com o que se passa no adulto (~ 5%). Portanto, sempre que os mesmos sejam detectados, devem ser cuidadosamente sujeitos a exames que permitam o diagnóstico diferencial entre nódulos do bócio, quistos, tumores benignos ou malignos.
Aspectos epidemiológicos
Os carcinomas da tiroideia na criança são raros, constituindo 0,5-3% de todos os tumores malignos em crianças com idade inferior a quinze anos, com uma frequência ligeiramente superior no sexo feminino. Na população pediátrica, os tumores da tiroideia são geralmente bem diferenciados, sendo os carcinomas papilares os mais frequentes (80-95%), seguindo-se os foliculares, e raramente os medulares. Os tumores benignos correspondem a 10% do total dos tumores da tiroideia, sendo os quistos e o adenoma tóxico (também designado de doença de Plummer), os mais frequentemente encontrados. Doenças benignas, tal como a tiroidite crónica auto-imune, podem também cursar com nódulos (habitualmente benignos).
Factores de risco e patogénese
A incidência e o risco de carcinoma aumentam: – com a exposição a radiações localizadas à cabeça e pescoço, sobretudo antes dos cinco anos de idade; – quando existe história anterior de doença da tiroideia (ex. hipotiroidismo congénito devido a erros de hormonogénese, quistos do canal tireoglosso, ectopias); e – história familiar de carcinoma da tiroideia.
Outros factores considerados de risco são: – o défice marcado de iodo; e – a presença de nódulos de dimensões superiores a 1 cm em contexto de tiroidite crónica auto-imune (tiroidite de Hashimoto). O risco de carcinoma da tiroideia está aumentado até 20 anos após radioterapia em baixas doses (< 30 Gy) utilizada para o tratamento de outras malignidades na criança.
Radiação em doses elevadas, devida à destruição celular, comporta um risco menor. A quimioterapia realizada na infância é actualmente considerada um factor de risco para carcinoma papilar.
Estudos moleculares revelaram que os carcinomas papilares da tiroideia na criança estão associados a alterações genéticas (mutações e rearranjos) no proto-oncogene RET/TRK. As mutações do BRAF são menos frequentes na criança. Os tumores foliculares estão relacionados com translocações no PAX8- PPAR gama ou mutações no gene RAS. Ambos estes carcinomas têm origem nas células foliculares da tiroideia e são secretores de tiroglobulina (Tg).
Os tumores medulares da tiroideia têm origem nas células parafoliculares da tiroideia e são secretores de calcitonina. Apresentam uma ocorrência familiar aumentada (25% dos casos) e podem surgir isoladamente ou fazer parte de síndromas neoplásicas multiendócrinas – multiple endocrine neoplasia (MEN) associadas a feocromocitomas (MEN2). Em 95% dos casos famililares, detecta-se uma mutação activadora do proto-oncogene RET. Outras doenças com maior risco para o aparecimento de neoplasias da tiroideia são as poliposes intestinais, nomeadamente a síndroma de Peutz- Jäghers e a síndroma de Gardner; a síndroma de McCune Albright caracteriza-se por múltiplas neoplasias endócrinas e não endócrinas; deve-se a uma mutação pós-zigótica activadora no gene GNAS.
Manifestações clínicas
Os nódulos tiroideus na criança são mais facilmente palpáveis do que no adulto. Na sua maioria, são assintomáticos e benignos. Sempre que o nódulo é de consistência dura e está fixo, deve suspeitar-se de malignidade. Neste caso, o exame clínico deve ser orientado no sentido de detectar adenomegálias, sinais e sintomas de tireotoxicose, ou sintomas locais de compressão, nomeadamente, disfagia, disfonia, rouquidão ou dispneia. Na criança, a detecção de adenomegálias de consistência dura é fundamental, pois estão presentes em 79% dos casos, mais frequentemente do que em adultos. A avaliação auxológica é importante, bem como a detecção de sinais de dismorfias típicas de síndromas ou de outras doenças associadas a neoplasias da tiroideia, particularmente a síndroma de McCune Albright e MEN2.
Exames complementares
A ecografia confirma a presença de nódulo da tiroideia. Apesar de não permitir distinguir um nódulo benigno de maligno, pode dar indicações valiosas no sentido de suspeição de malignidade: hipoecogenicidade, microcalcificações, zonas de hipervascularização intranodular e características do nódulo linfático alteradas. A elastografia, recentemente introduzida no estudo da tiroideia, tem como objectivo distinguir nódulos malignos, com menor elasticidade, de nódulos benignos. Esta técnica é largamente utilizada no estudo de neoplasias da mama e do fígado.
O doseamento da TSH, T4L e T3L permitem determinar o estado funcional (do nódulo) da tiroide.
A TSH diminuída indica um estado de tireotoxicose. Nestes casos, a cintigrafia com Tc99 ou I123 são o próximo passo diagnóstico, revelando um nódulo quente (hiperfuncionante) que corresponde a um adenoma funcionante (adenoma tóxico). São raros nas crianças e, apenas ~1,5% dos casos são malignos. A situação mais frequentemente encontrada perante um nódulo é o eutiroidismo, com doseamentos de TSH, T4L e T3L normais, e por vezes o hipotiroidismo subclínico (TSH elevada e T4L normal). Ambas obrigam a realização de citologia aspirativa com agulha fina (CAF) sempre que o nódulo apresente dimensões ≥ 1 cm ou apresentar características suspeitas de malignidade, ou existam antecedentes de doença tiroideia ou exposição a rádio ou quimioterapia. Este exame é de importância-chave para determinação do tipo histológico do tumor (adenoma, carcinoma) e da necessidade de excisão cirúrgica. A CAF apresenta uma confiabilidade diagnóstica de 90%.
O doseamento da calcitonina, um marcador dos carcinomas medulares, deve ser realizado antes da tiroidectomia. A Tg plasmática, por sua vez, é um marcador importante dos tumores de origem folicular, e o seu doseamento é utilizado no estudo de seguimento destes tumores após tiroidectomia.
Marcadores histológicos como a galectina-3, HBME-1 e a cytokeratina-19 têm sido utilizados em adultos para discriminação de neoplasias da tiroideia em situações em que a CAF revela apenas uma citologia “suspeita” (20% dos casos). Não existem, no entanto, estudos de confiabilidade destes marcadores em crianças. (Figura 4)
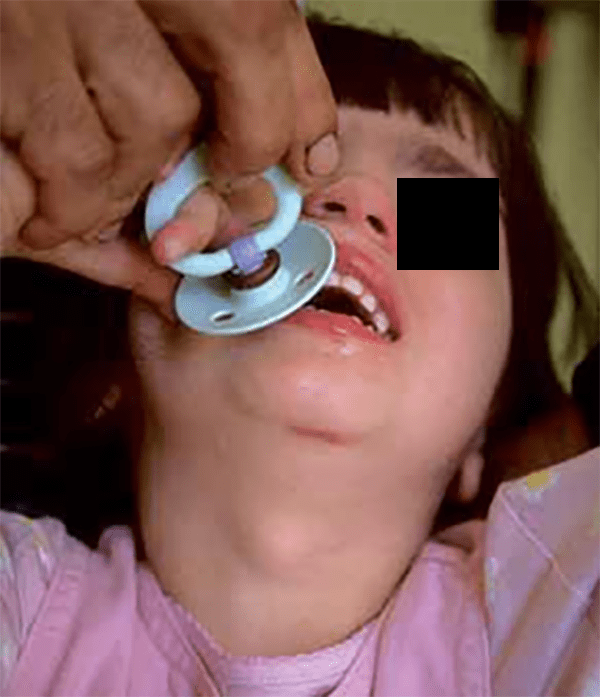
FIGURA 4. Quisto do canal tiroglosso associado a bócio nodular. (NIHDE)
Tratamento
O tratamento dos nódulos é distinto consoante se trate de nódulo quente, ou frio (hipofuncionante). Nos nódulos quentes, principalmente se decorrerem com hipertiroidismo, está indicada a excisão cirúrgica. Quanto aos nódulos frios, a abordagem terapêutica depende da citologia. Se o resultado citológico for o de nódulo de bócio, de tiroidite linfocítica, ou de hiperplasia folicular, deve adoptar-se uma atitude de vigilância. Se o resultado apontar para malignidade, nomeadamente carcinoma, está indicada a tiroidectomia total, eventualmente seguida de administração de I131, no caso de neoplasias de origem folicular (carcinomas papilares ou foliculares), com factores de risco que o justifiquem.
A sobrevivência nos casos de carcinoma diferenciado é superior a 90% aos 20 anos. As metástases, nomeadamente pulmonares, são mais frequentes nas idades mais jovens. Contrariamente à evolução no adulto, a cura é quase invariável com a administração de I131.
BIBLIOGRAFIA
Braverman LE, Utiger RD (eds). Werner & Ingbar’s The Thyroid: A Fundamental and Clinical Text. Philadelphia: Lippincott Williams & Wilkins, 2000
Cheetham T, Boal R. Graves’ disease. Paediatr Child Health 2019; 29: 316-320
Cooper DS. Antithyroid drugs. NEJM 2005; 352: 905-917
Cooper DS. Hyperthyroidism. Lancet 2003; 362: 459-468
Corrias A, Mussa A. Thyroid nodules in Pediatrics: which ones can be left alone, which ones must be investigated, when and how? J Clin Res Pediatr Endocrinol 2013; 5 (Suppl 1): 57-69
Cury AN, Meira VT, Monte O, et al. Clinical experience with radioactive iodine in the treatment of childhood and adolescence Grave’s disease. Endocr Connect 2013; 2: 32-37
De Felice M, Di Lauro F. The development of the thyroid gland: what we know and what we would like to know. Curr Opin Endocrinol Metab 2005; 12: 4
De Groot LJ. Dangerous dogmas in medicine: the nonthyroid illness syndrome. J Endocrinol Metab 1999; 84: 15-164
De Luca F, Santucci S, Corica D, et al. Hashimoto’s thyroiditis in childhood: presentation modes and evolution over time. Italian J Pediatr 2003; 39: 8 doi:10.1186/1824-7288-39-8
Direção Geral da Saúde. Suplementação de iodo na pré-concepção, gravidez e amamentação. Orientação Técnica nº 11 de 2013. Lisboa: Direcção Geral da Saúde, 2013
Felner EI, Umpierrez GE (eds). Endocrine Pathophysiology. Philadelphia: Lippincott & Wilkins, 2014
Gillam MP, Kopp P. Genetic defects in thyroid hormone synthesis. Curr Opin Pediatr 2001; 13: 354-372
Goldman L, Schafer AI (eds). Goldman-Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Haddad NG, Eugster EA (eds). Endocrinology: Adult and Pediatric. Philadelphia: Elsevier, 2016
Jeng W, Shan Z, Teng X, et al. Effect of iodine intake on thyroid diseases in China. NEJM 2006; 354: 2783-2792
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Koch CA, Sarlis NJ. The spectrum of thyroid disease in children and its evolution during transition to adulthood: natural history, diagnosis, differential diagnosis and management. J Endocrinol Invest 2001; 24: 659-675
Kratzsch J, Pulzer F. Thyroid gland development and defects. Best Pract
Res Clin Endocrinol Metab 2008; 22: 57-75
Léger J, Carel JC. Hyperthyroidism in childhood: causes, when and how to treat.
J Clin Res Pediatr Endocrinol 2013; 5 (Suppl 1): 50-56
Leung AKC, Leung AAC. Evaluation and management of the child with hypothyroidism. World J Pediatr 2019; 15: 124-134
Luton D, Le Gac I, Vuillard E, et al. Management of Graves’ disease during pregnancy: the key role of fetal thyroid gland monitoring. J Clin Endocrinol & Metab 2005; 90: 6093-6098
Madison LD, LA Franchi S. Screening for congenital hypothyroidism: Current controversies. Curr Opin Endocrinol Metab 2005; 12: 36-39
Melmed S, Polonsky KS (eds). Williams Textbook of Endocrinology. Philadelphia, Saunders, 2011
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Oyenusi EE, Ajayi EO, Akeredolu FD. Pattern of thyroid disorders in children and adolescents seen at the Lagos University Teaching Hospital, Nigeria, over a 10-year period. Niger Med J 2017; 58: 101-106. doi: 10.4103/nmj.NMJ_156_16
Radovick S, Misra M (eds). Pediatric Endocrinology. A Practical Clinical Guide. Berlin: Springer, 2018
Rosalind S. Brown. Autoimmune thyroiditis in childhood. J Clin Res Pediatr Endocrinol 2013; 5 (Suppl 1): 45-49
Selka KA, Harper A, Downs A, et al. Neurodevelopmental outcomes in congenital hypothyroidism: comparison of initial T4 dose and time to reach target T4 and TSH. J Pediatr 2005; 147: 775-780
Van Vliet G, Polak M (eds). Thyroid Gland Development and Function. Basel: Karger, 2007
Vaz Osório R, Vilarinho L. Programa Nacional de Diagnóstico Precoce. Relatório 2017. Lisboa: INSA, 2017
Williamson S, Greene SA. Incidence of thyrotoxicosis in childhood: a national population-based study in the UK and Ireland. Clin Endocrinol (Oxf) 2010; 72: 358-361