Definição e importância do problema
As infecções devidas ao microrganismo Streptococcus beta hemolítico do grupo A de Lancefield (SGA), também denominado Streptococcus pyogenes, integrando o conceito de doença estreptocócica, são dum modo geral benignas e de curta duração; no entanto, salienta-se a possibilidade, quer de formas clínicas muito graves, potencialmente letais, quer de complicações e sequelas não supuradas, tais como a febre reumática e a glomerulonefrite pós-estreptocócica.
Citam-se como exemplos de formas clínicas de doença estreptocócica (em > 90% dos casos provocadas pela espécie S. pyogenes): faringoamigdalite, escarlatina, impétigo, erisipela, bacteriémia, vaginite, dermatite perianal, pneumonia, e doença invasiva grave (como celulite e bacteriémia, fascite necrosante e síndroma de choque tóxico, etc.).
Neste capítulo, abordando aspectos globais da epidemiologia, etiopatogénese, prevenção e tratamento, é dada ênfase à entidade clínica Escarlatina tipificando historicamente uma forma clássica de infecção por Streptococcus pyogenes.
Por outro lado, faz-se referência sucinta aos critérios de diagnóstico da Síndroma de choque tóxico estreptocócico como modelo de doença invasiva; este tópico é abordado na Parte sobre Urgências e Emergências.
Outros tipos de infecções pelo agente infeccioso em causa SGA (por ex. fascite necrosante erisipela, etc.) são descritos no capítulo dedicado às infecções da pele e dos tecidos moles.
Aspectos epidemiológicos
A doença estreptocócica é uma doença endémica nas grandes cidades, sendo o ser humano, de qualquer idade, o reservatório natural de SGA, germe bacteriano muito transmissível. É mais comum nos meses de inverno e início da primavera, em crianças acima dos 3 anos de idade, particularmente entre os 5 e os 15 anos. A doença é rara em lactentes devido à transmissão de anticorpos maternos, embora possa ocorrer em situações de epidemia, nomeadamente em infantários.
O modo de transmissão da infecção faz-se principalmente através de gotículas de saliva ou secreções nasais por contacto directo com um doente, pelo que é mais frequente em meios de maior densidade populacional, como escolas, grupos de desportos de contacto e instituições militares. Durante os meses de inverno, cerca de 15% a 25% das crianças são portadores assintomáticas de SGA na faringe, mas o risco de transmissão é baixo porque a bactéria perde virulência na faringe do portador. As razões imunológicas para a persistência da bactéria nas vias respiratórias superiores ainda não estão completamente explicadas.
A transmissão pode também fazer-se indirectamente por objectos ou alimentos contaminados pelas mãos de doentes. Foram descritas epidemias de amigdalofaringite provocada por ingestão de alimentos contaminados preparados, ou refrigerados, em más condições de higiene.
O epitélio estratificado da orofaringe e a pele são as principais barreiras contra a doença invasiva por SGA, mas a faringe é o ponto de partida mais frequente em situações de bacteriémia. Por vezes a porta de entrada pode ser uma ferida, uma queimadura ou outra lesão cutânea.
Etiopatogénese
O género Streptococcus constitui um grupo heterogéneo de bactérias responsáveis por quadros clínicos diferentes dependendo de vários factores: 1 – características próprias do tipo de Streptococcus responsável; 2 – porta de entrada; 3 – características do hospedeiro, como a sua idade e situação imunitária.
Estão descritos três esquemas de classificação deste microrganismo (coco gram-positivo que se apresenta em cadeias ou pares) de acordo com:
I – propriedades serológicas – consoante o grupo de polissacáridos da parede celular, com propriedades antigénicas específicas, a bactéria classifica-se em grupos de Lancefield, discriminados de A a V.
II – características hemolíticas – de acordo com o tipo de hemólise produzida por colónias da bactéria a crescer em placas de agar. O SGA, beta-hemolítico, produz uma hemólise completa no meio de cultura.
III – propriedades bioquímicas e fisiológicas – responsáveis pela virulência da bactéria.
Na parede celular encontram-se os factores responsáveis pela gravidade do quadro clínico.
A estrutura antigénica do Streptococcus pyogenes (SGA) baseia-se na camada de peptidoglicano da parede celular. A cápsula propriamente dita não é imunogénica, mas protege a bactéria da fagocitose pelo hospedeiro. Este agente pode ser subdividido em mais do que 220 serótipos com base no antigénio designado por proteína M localizada na superfície celular e nas fímbrias que se projectam da superfície externa da parede celular da bactéria; tal proteína promove a adesão da bactéria às células epiteliais do hospedeiro, contribuindo para a resistência da bactéria à fagocitose. É a proteína associada à maior virulência do agente SGA: estirpes ricas em proteína M resistem à fagocitose e fixam-se mais facilmente às células epiteliais faríngeas e à pele, ao contrário de estirpes sem a referida proteína.
A serotipagem M – com base em técnicas moleculares através de PCR, sequenciação ADN, etc. – tem grande valor em estudos epidemiológicos; com efeito, certas doenças específicas causadas por SGA estão associadas a certos tipos de proteína M. Os tipos 1, 12, 28, 4, 3 e 2 (por esta ordem) são causa frequente de faringite não complicada e raramente associados a infecções cutâneas. Algumas estirpes infectando a faringe (por ex. M tipo 12), estão associadas a glomerulonefrite, enquanto maior número de estirpes infectando a pele (por ex, M tipos 49, 55, 57, e 60) são consideradas nefritogénicas. Vários serótipos associados a infecção da faringe, mas não da pele (por ex. M tipos 1, 3, 5, 18, 29) estão associados a febre reumática aguda.
O agente SGA/S. pyogenes produz uma variedade de enzimas, incluindo as toxinas eritrogénicas (hoje conhecidas por exotoxinas pirogénicas estreptocócicas, – no total em número de 12); as designadas pelas letras A, B e C são responsáveis pelo exantema da escarlatina. Estas últimas 3 exotoxinas estimulam a formação de anticorpos/antitoxinas que conferem imunidade contra o exantema escarlatiniforme, mas não contra outras infecções estreptocócicas. Como os anticorpos formados são específicos da toxina, um doente poderá ter mais de um episódio de exantema.
Determinadas exotoxinas estão relacionadas com a patogénese da síndroma de choque tóxico estreptocócico.
Seguidamente são descritos outros dos componentes da bactéria, dando ênfase a certas funções específicas dos mesmos.
- proteínas simile M, e outras proteínas da superfície celular, responsáveis pela inibição da protease.
- proteínas F, responsáveis pela adesão da bactéria às células epiteliais do hospedeiro.
- estreptolisina S, uma hemolisina que contribui para a lise dos leucócitos, plaquetas e eritrócitos.
- estreptolisina O, estimulando a libertação de enzimas hidrolíticas pelos lisossomas e contribuindo para a lise dos leucócitos.
- estreptoquinase, facilitando a invasão tecidual da bactéria.
- hialuronidase.
- DNAases – desoxirribonucleases despolimerizando o ADN livre no pus, reduzindo a viscosidade do material abcedado e facilitando a disseminação da bactéria.
- C5a peptidase, componente do complemento mediando a inflamação e activando as células fagocitárias.
- exotoxinas piogénicas (SPE) – A, C, e F, funcionando como superantigénios provocando síndroma de choque tóxico.
Formas clínicas
Nesta alínea é dada ênfase a amigdalofaringite, escarlatina (mais pormenorizadamente como paradigma por razões históricas e didácticas) e síndroma de choque tóxico estreptocócico tendo em conta que outras formas clínicas como a erisipela, o impétigo a celulite e a fascite necrosante integram o capítulo seguinte. (Infecções da pele e dos tecidos moles)
Amigdalofaringite
Em complemento do que foi referido na Parte sobre Otorrinolaringologia, cabe salientar que a colonização da faringe por S. pyogenes pode produzir estado de portador assintomático ou infecção aguda. A proteína M é responsável pela virulência, já que condiciona a resistência do microrganismo à fagocitose pelos polimorfonucleares.
Como dados clínicos sugestivos de faringite estreptocócica citam-se: odinofagia de início súbito, febre, cefaleia, vómitos, eritema faríngeo acompanhado ou não de exsudado e adenopatias cervicais. Ocasionalmente pode surgir tumefacção da úvula, petéquias no palato mole e exantema escarlatiniforme.
Escarlatina
Etiopatogénese e manifestações clínicas
Na sequência do que foi descrito na alínea Etiopatogénese, para que uma infecção estreptocócica se expresse clinicamente como escarlatina há que atender aos seguintes critérios: – Streptococcus infectante (dos tipos A- mais frequentemente, B ou C) produtor de exotoxina pirogénica; – ocorrência em indivíduos sem imunidade humoral antitoxina e antibacteriana.
Uma vez que a exposição a cada tipo de exotoxina somente gera imunidade específica, tal pressupõe que um paciente possa apresentar escarlatina em três ocasiões diferentes/até três vezes.
A escarlatina é actualmente menos frequente e, sobretudo com manifestações mais ligeiras do que no passado, mas tem uma incidência cíclica, dependente da prevalência das estirpes produtoras de toxina e do estado imunitário da população. A porta de entrada do Streptococcus pyogenes pode ser uma ferida na pele.
Após período de incubação de 2-4 dias, nos casos típicos a doença manifesta-se de forma aguda pela tríade: 1 – febre; 2 – faringite ou amigdalite eritemato-pultácea aguda; e 3 – exantema máculo-papular ou punctiforme, muito fino de aspecto granitado e áspero (tipo lixa) confluente, diminuindo de intensidade quando se faz pressão com o dedo.
A febre alta, máxima pelo 2º dia, persiste durante 3 a 5 dias, acompanhada de cefaleias, vómitos, odinofagia, dor abdominal e taquicardia desproporcionada em relação com a temperatura. Nos casos graves, a temperatura elevada pode ser mais prolongada e, nalguns casos, é baixa e poderá mesmo não se verificar.
Cerca de 24 a 48 horas depois do início da febre, surgindo o exantema descrito, o mesmo progride rapidamente a partir do pescoço para o tronco e extremidades (Figuras 1 e 2). É mais acentuado (por vezes associado a petéquias e hiperpigmentação) nas pregas de flexão, como as axilas, pregas do cotovelo e região inguinal (sinal de Pastia) (Figura 3). Na face, a região malar pode apresentar-se eritematosa, mas verifica-se ausência de rubor ou “palidez” relativa (sinal designado por “triângulo perioral de Pilatov”). A prova de Rumpel-Leed é positiva.
Em 4 a 8 dias, a erupção regride, surgindo descamação da pele atingida, a qual pode durar entre 1-3 semanas (intensidade e duração proporcionais à intensidade do exantema). Começa pela face em flocos finos, estendendo-se depois para o tronco e, finalmente, para as extremidades, tornando-se generalizada pela 3ª semana. No tronco faz-se em grandes lâminas, sendo visível nas mãos e pés, em geral pela 2ª-3ª semana. Os topos dos dedos mostram uma descamação característica na margem livre das unhas; a mesma descamação atinge a palma das mãos e plantas dos pés.
Na boca, observa-se um enantema com petéquias na úvula, véu do paladar e pilares anteriores das amígdalas. Para além do aspecto inflamado da faringe e amígdalas, verifica-se um exsudado amigdalino branco nacarado, mucopurulento desde o 2º dia de doença (amigdalite eritemato-pultácea). A língua tem inicialmente um aspecto saburroso, adquirindo posteriormente o aspecto típico de “língua de framboesa branca” devido à cor (inicialmente rósea e depois vermelha) e ao ingurgitamento das papilas (Figura 4). É habitual a coexistência de gânglios cervicais anteriores aumentados de volume e dolorosos, assim como de vómitos.
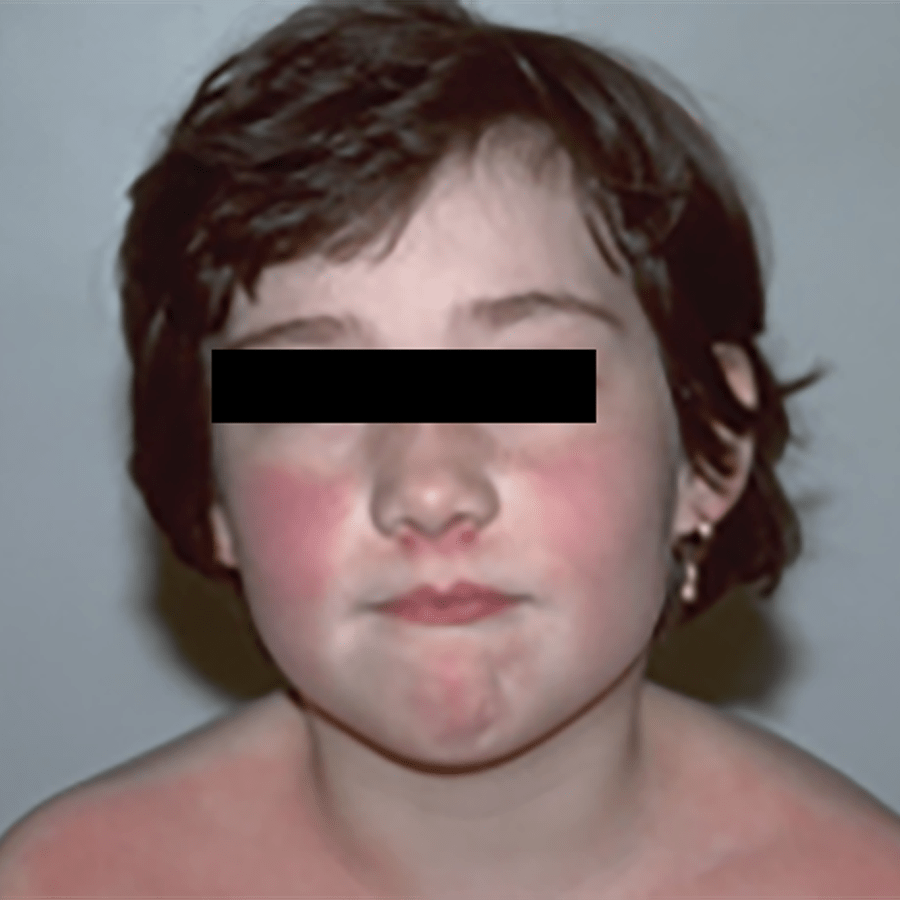
FIGURA 1. Escarlatina: exantema notório na face e tronco, sendo menos acentuado na região peribucal (sinal de Pilatov). (NIHDE)
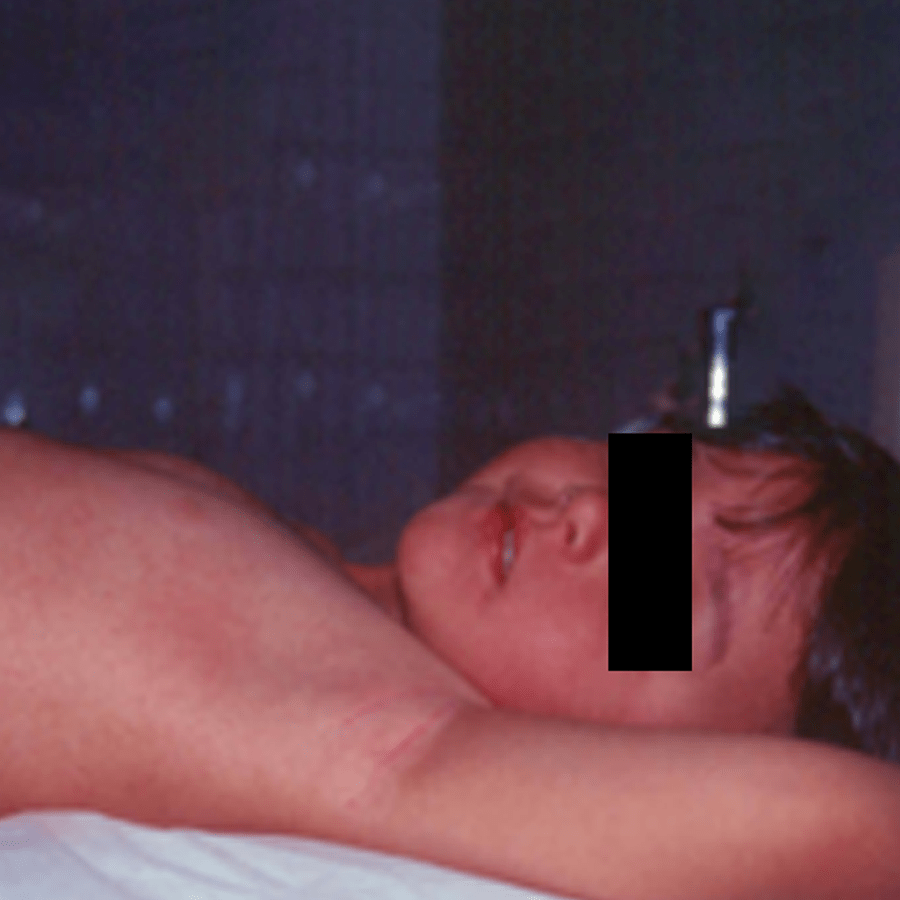
FIGURA 2. Escarlatina: exantema na face e tronco. (NIHDE)
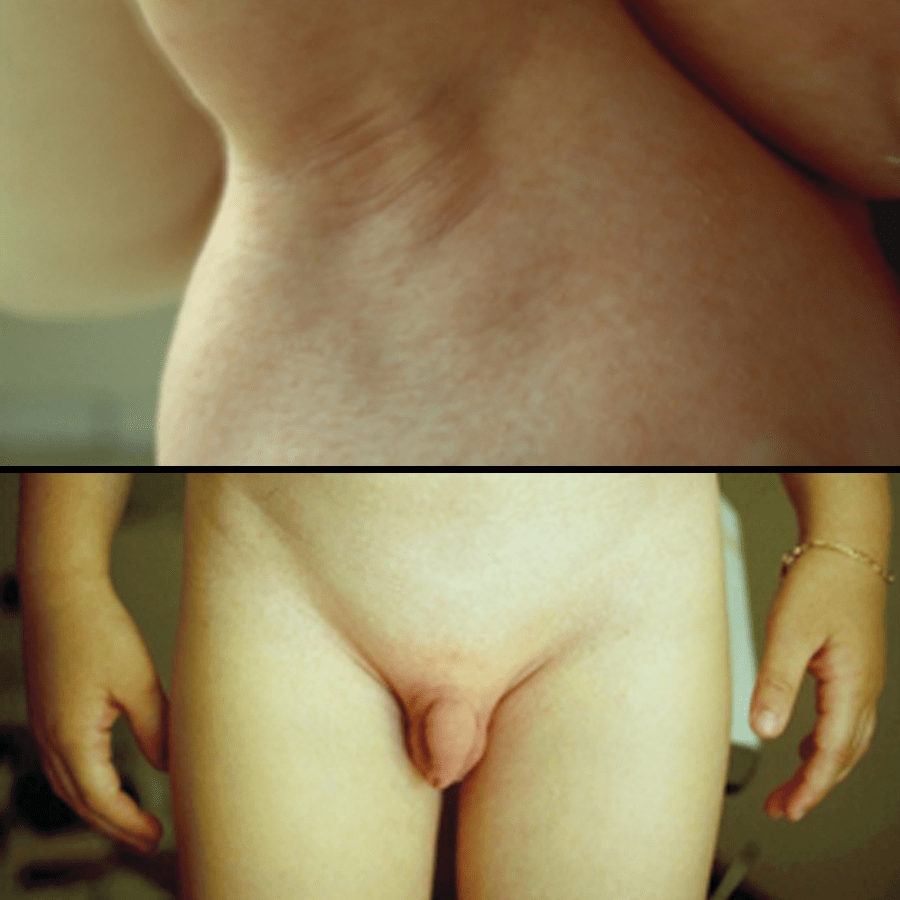
FIGURA 3. Escarlatina: sinal de Pastia. (NIHDE)
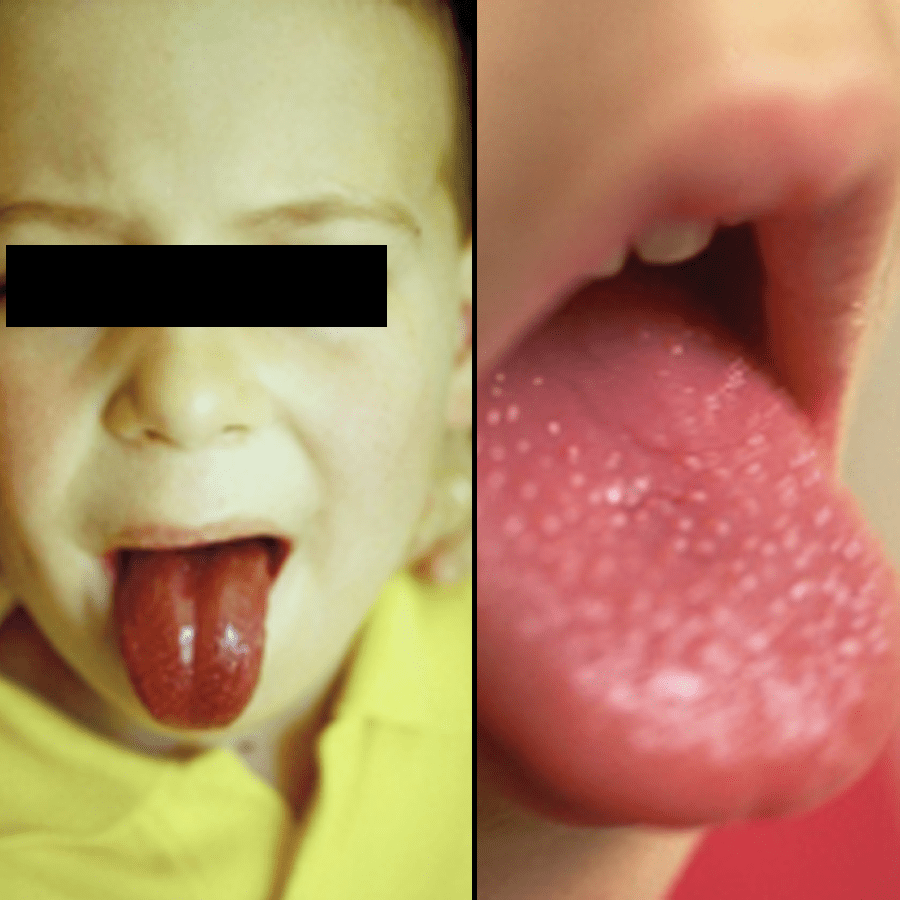
FIGURA 4. Escarlatina: língua de framboesa. (NIHDE)
Depois de um intervalo livre de 10 ou 15 dias, podem surgir como complicações, respectivamente, uma glomerulonefrite aguda ou febre reumática. A terapêutica correcta não anula o risco de complicações, mas diminui-o de forma significativa. O risco de contrair febre reumática após uma infecção estreptocócica é inferior a 1%, enquanto o risco de contrair glomerulonefrite é de cerca de 10% se a estirpe for nefritogénica.
Complicações
As complicações supurativas, ocorrem geralmente no final da primeira semana de doença e são: adenite cervical supurada, abcessos retrofaríngeo e/ou periamigdalino. Estas complicações, resultantes da extensão da infecção a estruturas vizinhas, são actualmente raras devido ao diagnóstico atempado e ao uso correcto de terapêutica antibiótica. As complicações não supurativas, detectadas após um intervalo livre de 2 a 3 semanas, são a glomerulonefrite aguda (GNA) e a febre reumática (FR). Salienta-se que a GNA pode ocorrer após infecção por SGA das vias respiratórias ou da pele, enquanto a FR ocorre somente após infecção das vias respiratórias superiores.
Duas outras entidades nosológicas foram descritas como possível complicação de infecção por SGA:
- Artrite reactiva pós-estreptocócica – Cerca de 10 dias após infecção aguda por SGA podem ocorrer manifestações de artrite sem critérios clínicos ou laboratoriais que preencham os critérios de Jones para o diagnóstico de FR. A artrite, tipicamente não migratória, ao contrário da FR, envolve geralmente as grandes articulações, mas também as pequenas articulações. Também, ao invés do que acontece na FR, a resposta aos AINE não é boa. A relação entre esta artrite reactiva e a FR não é clara. Todavia, como um número muito reduzido destes doentes desenvolveu mais tarde doença valvular cardíaca, recomenda-se o seu seguimento durante um a dois anos para exclusão de cardite. Alguns investigadores recomendam a profilaxia secundária de FR nestes doentes.
- PANDAS (Pediatric Autoimmune Neuropsychiatric Disorders Associated with Streptococcus pyogenes) – Esta situação clínica, conhecida pela sigla, integra um conjunto de perturbações do foro neuropsiquiátrico (particularmente alterações obsessivas-compulsivas, tiques e síndroma de Tourette). Tais sintomas podem também surgir em doentes com coreia de Sydenham no contexto de FR. Tem sido admitida uma relação entre infecção prévia por SGA e manifestações de PANDAS por produção de autoanticorpos que atravessam a barreira hematoencefálica, mas ainda não foi provada qualquer relação causal.
Diagnóstico
No âmbito da anamnese deve ser inquirido eventual contacto com um caso bem documentado, embora a tríade atrás descrita (febre, amigdalofaringite exsudativa e exantema) sugira o diagnóstico.
Admitindo a hipótese clínica de escarlatina, a confirmação do diagnóstico por exame cultural do exsudado faríngeo, após colheita apropriada, mantém-se como prova-padrão, embora tenha a desvantagem de demorar, pelo menos, 48 horas. As provas de detecção de antigénios, igualmente realizadas por zaragatoa, constituem uma alternativa rápida e adequada. Estes testes, se a técnica de execução for correcta, têm uma especificidade superior a 95%, pelo que resultados falsos positivos são raros; a sua sensibilidade é de cerca de 80% a 90%, variando com os reagentes utilizados pelos diversos fabricantes.
A infecção estreptocócica também pode ser diagnosticada de forma retrospectiva pela determinação do título de antiestreptolisina O (TASO), ou pelo título anti-DNAase. O TASO não é específico da infecção pelo SGA, podendo ser negativo nas infecções cutâneas. O título anti-DNAase é positivo tanto nas infecções respiratórias como nas infecções da pele. Os títulos de anticorpos anti-estreptocócicos começam a aumentar 7 a 24 dias após o início da infecção, atingindo o pico sérico às 3 a 6 semanas, pelo que o seu interesse resume-se a confirmar uma infecção passada.
Diagnóstico diferencial
O exantema da escarlatina pode ser confundido com infecção estafilocócica, (escarlatina estafilocócica), toxidermias, doença de Kawasaki ou exantemas de causa vírica. Na síndroma de choque tóxico por estafilococo, verifica-se exantema semelhante ao da escarlatina estreptocócica, com a particularidade de ser mais grave nas palmas das mãos e plantas dos pés, para além de se detectar o foco de infecção estafilocócica.
Nos casos raros em que não há amigdalofaringite, uma ferida cutânea infectada, ou a coexistência de impétigo, e o exantema característico sugerem o diagnóstico, o qual deve ser confirmado por exame bacteriológico.
Nota importante: O agente Staphylococcus aureus dos grupos C e G, produzindo toxinas eritrogénicas e epidermolíticas, pode originar um quadro clínico, do qual faz parte exantema semelhante ao provocado por S. pyogenes; é a chamada “escarlatina estafilocócica”. |
Prognóstico
O prognóstico da escarlatina e das infecções estreptocócicas agudas em geral, correcta e atempadamente tratadas, é excelente. Se o tratamento for levado a cabo dentro de 9 dias após o início da doença, a FR é quase sempre prevenida. Contudo, não está provado que a GNA possa ser prevenida, designadamente no contexto de infecção por estirpe de SGA nefritogénica.
Em situações especiais de síndromas de imunodeficiência de etiopatogénese diversa, ou de infecção por estirpes de grande virulência, poderá verificar-se evolução para doença invasiva, nomeadamente síndroma de choque tóxico.
Síndroma de choque tóxico estreptocócico
Definição
Um quadro clínico grave compatível com choque e exantema máculo-papular ou punctiforme de tipo escarlatiniforme, no contexto de provável etiologia infecciosa, levará a admitir a possibilidade de síndroma de choque tóxico por S. pyogenes ou por S. aureus.
Etiopatogénese e manifestações clínicas
A síndroma de choque tóxico estreptocócico é um quadro clínico grave e raro em idade pediátrica. Define-se como doença aguda gerando resposta inflamatória sistémica toxinas do microrganismo por estimulação dos linfócitos T. Em mais de metade dos casos surge em crianças com menos de 5 anos, embora ultimamente tenham sido descritos casos em idades mais baixas. De acordo com dados da literatura, a percentagem de hemoculturas positivas pode atingir 60%. A mortalidade situa-se entre 30% e 70%
O Quadro 1 resume os critérios de diagnóstico da síndroma em epígrafe.
QUADRO 1 – Critérios de diagnóstico da síndroma de choque tóxico por Streptococcus do Grupo A (SGA).
Diagnóstico definitivo: parâmetros 1+3+4 presentes |
Diagnóstico diferencial
O Quadro 2 sintetiza os critérios de diagnóstico da síndroma de choque tóxico por S. aureus, o qual permite comparação com os critérios para a síndroma de choque tóxico por S. pyogenes (Quadro 1), para diagnóstico diferencial.
QUADRO 2 – Critérios de diagnóstico da síndroma de choque tóxico por S. aureus.
Critérios clínicos
Diagnóstico provável: 5 de 6 critérios clínicos |
Tratamento das infecções por Streptococcus pyogenes
A comprovação da etiologia estreptocócica no contexto da tríade clássica referida a propósito das manifestações clínicas da escarlatina constitui indicação formal para início imediato de terapêutica antibiótica.
O agente Streptococcus pyogenes é muito sensível à penicilina, não estando descritas estirpes resistentes. Uma dose única via IM de penicilina benzatínica é adequada. Nas crianças com peso até 27 kg devem ser administradas 600.000 Unidades e nas crianças com 27 kg, ou mais, a dose apropriada é 1.200.000 Unidades. Este é o esquema posológico internacionalmente recomendado.
Todavia, há quem prefira ajustar a dose ao peso e prescrever 50.000 U/kg, até à dose máxima de 1.200.000 U.
Esta forma de tratamento tem a vantagem de evitar insucessos terapêuticos por incumprimento da medicação, embora com a desvantagem de ser doloroso. A dor desta administração pode ser minorada se a penicilina não estiver a baixa temperatura.
Se se optar por prescrever antibiótico por via oral, e uma vez que em Portugal não existe penicilina oral, a amoxicilina é a terapêutica preconizada na dose de 50 mg/kg/dia (máximo 1 g/dia) administrada de 12 em 12 horas durante 10 dias. Em caso de alergia à penicilina por reacção de hipersensibilidade tipo 1, deve-se prescrever um macrólido nas doses habituais: claritromicina – 15 mg/kg/dia (máximo 500 mg/dia) de 12/12 horas durante 10 dias; azitromicina 12 mg/kg/dia (máximo 500 mg/dia) de 24 em 24 horas durante 5 dias. Refira-se que em Portugal a resistência do Streptococcus do grupo A aos macrólidos diminuiu de 10% em 2007 para 1% em 2013. Em caso de alergia à penicilina por reacção de hipersensibilidade não tipo 1 pode prescrever-se uma cefalosporina de 1ª ou 2ª geração nas doses habituais e durante 10 dias.
No tratamento das infecções invasivas graves utiliza-se a clindamicina associada à penicilina porque numa pequena proporção se verifica resitência de S. pyogenes àquele antibiótico: associação de penicilina e clindamicina por via IV (penicilina G aquosa em perfusão lenta /20 minutos, 6 a 8 vezes/dia: 25.000-500.000U/kg/dia; clindamicina em perfusão rápida, 4 vezes/dia: 30-40 mg/kg/dia) com a duração de 10 ou mais dias, em função do contexto clínico e evolução.
Para além da antibioticoterapia, estão indicadas todas as medidas de reanimação e suporte hemodinâmico descritas no âmbito da sépsis e choque. A este respeito, sugere-se a consulta do capítulo sobre sépsis e choque (Parte XXVIII).
Prevenção
Não existe actualmente prevenção primária da infecção por Streptococcus do grupo A, nomeadamente vacina ou método de erradicar a bactéria do hospedeiro. Algumas vacinas recombinantes utilizando 30 serótipos de proteína M estão em estado inicial de desenvolvimento. Contudo, dada a existência de número superior a 130 de tipos M e respectivos serótipos, com larga distribuição geográfica, existe o risco de produção de anticorpos com reacção cruzada frente aos tecidos humanos, o que comporta o risco de doenças autoimunes.
O período de evicção escolar das crianças doentes é de apenas 24 horas após o início da terapêutica antibiótica, desde que a criança esteja apirética.
De salientar que:
- não está indicada a pesquisa de Streptococcus aos coabitantes assintomáticos de crianças doentes, excepto se os familiares tiverem risco elevado de patologia na sequência de infecção por SGA, como GNA ou FR.
- não está indicada a pesquisa de Streptococcus em qualquer contacto escolar assintomático da criança doente. O risco de transmissão da infecção por um portador é mínimo, bem como é mínimo o risco de um portador desenvolver complicações, pelo que estes portadores não devem ser tratados com antibiótico.
A erradicação do SGA da orofaringe de portadores assintomáticos, apenas está indicada nas situações seguintes:
- pessoas com diagnóstico de FR ou GNA
- doentes com história familiar de FR
- surtos epidémicos de FR ou GNA
- surtos epidémicos de faringite a SGA numa comunidade fechada ou semi-fechada
- episódios múltiplos intrafamiliares de faringite sintomática por SGA, apesar de antibioticoterapia apropriada.
O agente SGA pode ser dificil de erradicar da orofaringe de alguns portadores. A clindamicina na dose de 30 mg/kg dia (máximo 900mg) de 8 em 8 horas durante 10 dias é a terapêutica mais eficaz.
Nota: A escarlatina não é uma doença de notificação obrigatória.
BIBLIOGRAFIA
Bergelson JM, Shah SS, Zaoutis TE. Pediatric Infectious Diseases. The Requisites in Pediatrics. Philadelphia: Mosby Elsevier, 2008
Feigin RD, Cherry JD, Demmler GL, Kaplan SL (eds). Textbook of Pediatric Infectious Diseases. Philadelphia: Saunders, 2014
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Goldman L, Schafer AI (eds). Goldman-Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Kimberlain D, Brady M, Jackson M, Long S (eds). Red Book. American Academy of Pediatrics, 2015: 732-744
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Langlois, DM, Andreae, M. Group A Streptococcal infections. Pediatr Rev 2011; 32: 423-430
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Sharland M, Cant A, Shingadia D (eds). Manual of Childhood Infections: The Blue Book (Oxford Specialist Handbooks in Paediatrics). ESPID 2011; 106: 721-729
Silva-Costa S, Ramirez M, Melo-Cristino J, on behalf of the Portuguese Group for the Study of Streptococcal Infections. Declining macrolide resistance in Streptococcus pyogenes in Portugal (2007–13) was accompanied by continuous clonal changes. J Antimicrob Chemother 2015; 70:1-5
Simões AP, Martins F, Aidos A, Noronha FT, Palminha JM, Diagnóstico de amigdalo-faringite por Streptococcus pyogenes: comparação entre dois métodos de detecção de antigénio e o exame cultural. Resistência da bactéria aos antibióticos. Acta Pediatr Port 2000;31:431-437