Definição e importância do problema
O termo genérico cárie significa degradação do tecido ósseo, com amolecimento e destruição. Cárie dentária é a destruição localizada e progressiva dos dentes.
A cárie dentária atinge primeiramente o esmalte (1º grau), em seguida a dentina (ou marfim) que é atacada pelas bactérias (2º grau), podendo chegar-se ao 3º grau que corresponde à necrose da polpa dentária. O resultado final é a formação de cavidades.
A cárie dentária continua a ser a doença mais frequente do globo. A sua incidência tem vindo a reduzir-se nos países industrializados que – desde meados dos anos 50 – puseram em prática a fluoretação da água, leite e/ou sal das cozinhas, a suplementação de flúor, em gotas ou comprimidos, e a intensificação da higiene oral. O paradigma é constituído pelos escandinavos.
O índice CPO de um indivíduo constitui o somatório do seu número de dentes Cariados (C), número de dentes Perdidos por cárie (P) e número de dentes Obturados (O). Corresponde ao inglês DMFT (Decayed, Missing, Filled Teeth). Tal índice, todavia, continua a aumentar nos países de menor nível socioeconómico, de acordo com a Organização Mundial de Saúde. Esta tinha considerado desejável um índice inferior a 3 aos 12 anos no ano 2000, e deseja atingir um índice inferior a 1,5 no ano 2015. Consideradas as Regiões de Saúde de Portugal e o ano de 2000, o Índice CPO, aos 12 anos, era 2,9 e 4,7 aos 15 anos.
De acordo com um Estudo Nacional de Saúde Oral em 2005, a percentagem de indivíduos sem cárie era: aos 6 anos → 50,9; aos 12 → 43,8; e aos 15 → 28,1.
Conceptualmente, em suma, trata-se de uma doença, quase-infecciosa, de origem bacteriana, que atinge inicialmente os tecidos duros do dente e que, na sua evolução natural, dá origem a uma cavidade.
ETIOPATOGÉNESE
Admite-se desde 1892 com W. D. Miller (teoria químico-parasitária ou acidogénica), que a cárie se deve sobretudo à desmineralização dos tecidos inorgânicos do dente por ácidos (láctico, acético, pirúvico) elaborados por flora bacteriana específica (acidogénica), a partir de glicólise do substrato dietético (hidratos de carbono).
Assim, considera-se um modelo etiopatogénico ainda adequado o da conjugação simultânea de três factores: microbiota patogénica ou factor agente; substrato (regime alimentar) ou factor ambiente; e dente susceptível ou factor hospedeiro. (Figura 1)
As bactérias começam por fixar-se na película exógena, adquirida, de proteínas salivares, produzindo polissacáridos extracelulares que incorporam; estrutura-se, assim, uma camada, placa ou “biofilme” de bactérias capazes de colonizar as superfícies dentárias.
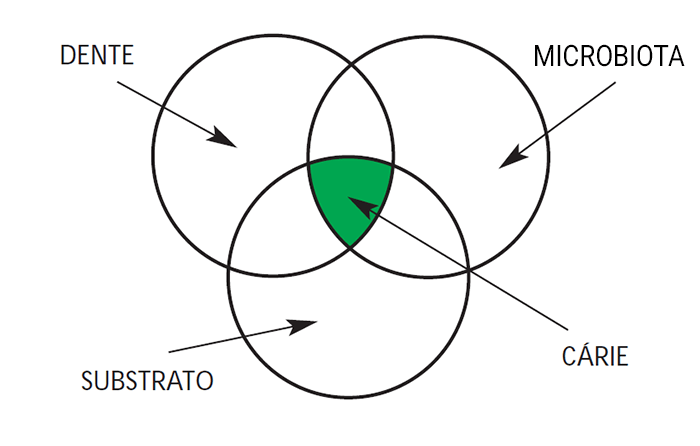
FIGURA 1. Relação dente, microbiota, substrato e cárie
A cárie dentária traduz, pois, a desmineralização ácida dos tecidos calcificados dos dentes (fracção apatítica), induzida pelos ácidos orgânicos resultantes da fermentação dos açúcares do regime alimentar, produzida pelos agentes da placa bacteriana.
No âmbito da etiopatogénese são abordados com mais pormenor aspectos específicos em relação com o modelo anteriormente esboçado, o que permite compreender melhor a intervenção profiláctica e terapêutica.
De salientar que durante o período de maturação dentária verifica-se incorporação do flúor (F) em duas fases, uma pré-eruptiva e outra pós-eruptiva.
Na fase pré-eruptiva a incorporação de F na estrutura mineral do dente realiza-se por dois mecanismos:
- por precipitação de fluorapatite sobre a matriz dentária, substituindo a hidroxiapatite, sendo a referida incorporação de fluorapatite responsável pela sua presença no esmalte dentário;
- por reacção da hidroxiapatite do esmalte já formado com iões de F presentes em líquidos internos, “banhando” a superfície dentária e formando uma camada superficial de fluor-hidroxiapatite.
Esmalte e junção esmalte-dentina
Na prática, a maioria dos aspectos relacionados com a cárie é abordada com respeito à cárie do esmalte, pois é a este nível que a atitude profiláctica é exequível.
Vale a pena lembrar que, em peso, 96% do esmalte é constituído por fosfato de cálcio, sob a forma de cristais de hidroxiapatite, estruturalmente organizados em prismas; só 3% da sua estrutura é água e apenas 1% corresponde a matriz proteica. Em caso de lesão, não sofre restitutio ad integrum, por não possuir células reparadoras.
O esmalte une-se à dentina, na chamada junção amelo-dentinária, e ao cimento radicular nos colos dentários.
A cárie do esmalte é um processo dinâmico, não vital, de desmineralização/remineralização, na fase inicial. A sua extensão à dentina decorre de forma macroscopicamente distinta, nas superfícies lisas e nas fissuras.
Nas superfícies lisas, a lesão tende a evoluir segundo a forma de um cone de vértice interno, situado na junção amelo-dentinária; nas fissuras, o cone mantém o vértice externo enquanto se vai alargando a base, na zona de junção. (Figuras 2 e 3)
É, assim, possível explicar que uma cárie aparentemente pequena – ou mesmo punctiforme – de uma superfície oclusal (superfície de mastigação), se revele de notória profundidade no esmalte, e de grande extensão na dentina, conforme se caminha do vértice externo, para a base interna.
Muitas vezes, pela deterioração progressiva e silenciosa da dentina, sob esmalte aparentemente íntegro, se assiste a perda de estrutura suficiente para o esmalte não suportado se fracturar, podendo ficar exposta uma cavidade de grandes dimensões. Ou seja, a deterioração da dentina pode preceder durante certo tempo a fractura do esmalte até aí intacto.
De referir que as lesões do esmalte são assintomáticas.
FIGURA 2. Imagem de cárie da superfície lisa e da fissura
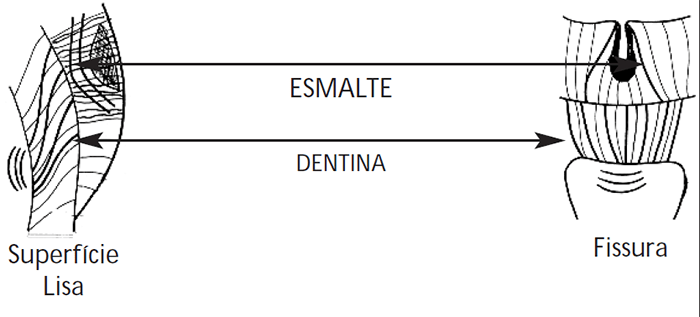
FIGURA 3. Progressão da cárie: lesão do esmalte e extensão à dentina
Complexo dentino-pulpar
A dentina e a polpa dentária formam um complexo biológico indissociável, vital; é este complexo que constitui a interface entre doença dentária, ponto de partida de doença sistémica, e zona de recepção de estímulos. (Figura 4).
A polpa é uma “ilha” de tecido conjuntivo laxo, rodeada de dentina – uma loca inextensível – ocupando o centro do dente. É nutrida por um sistema arterial do tipo terminal, isto é, por uma pequena e única artéria que a atinge através da extremidade da raiz (ou ápex), subdividindo-se no seu espaço central.
Estando enclausurada em paredes rígidas, a polpa é incapaz de aumentar de volume, durante um processo inflamatório.
O tecido conjuntivo pulpar distingue-se de outros tecidos conjuntivos laxos por, à sua periferia, se alinharem os odontoblastos, células tróficas produtoras de dentina. Os seus corpos celulares alongam-se nos processos odontoblásticos, no interior dos canalículos dentinários preenchidos por um fluido intersticial. (Figura 5)
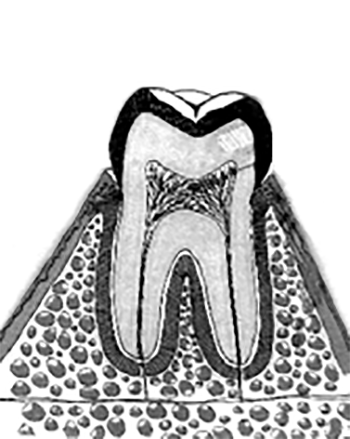
FIGURA 4. Complexo dentino-pulpar
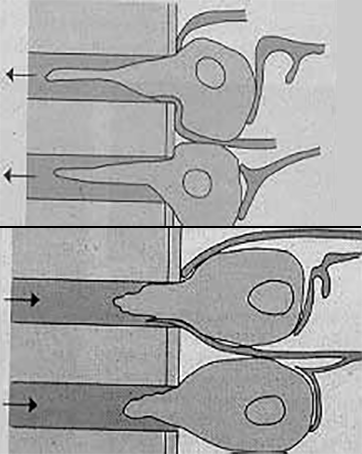
FIGURA 5. Odontoblastos e túbulos dentinários
Tudo se passa como se os odontoblastos e seus prolongamentos tivessem conexões com fibras nervosas simples, do tipo C; essas fibras são estimuladas com o alongar e encurtar dos prolongamentos, com origem nas variações dimensionais induzidas pelo calor e pelo frio no líquido intersticial (teoria hidrodinâmica de Brannstrom).
Estas fibras são destituídas de capacidade proprioceptiva; apenas então preparadas para a sensibilidade dolorosa, sendo os estímulos habituais o frio e o doce.
As variações dimensionais descritas podem também ser desencadeadas pelos solutos hiperosmolares, como os açúcares e alguns ácidos, que induzem movimento do líquido intersticial “para fora”, tentando restabelecer a isotonia.
Microbiota
Está provado que o grupo dos microrganismos Streptococcus mutans e S. sobrinus é essencial para o início da cárie, especialmente a das superfícies lisas dos dentes.
Com efeito, tais germes microbianos têm a capacidade de aderir ao esmalte, produzir compostos ácidos e de sobreviver em meio de pH baixo. Contudo, as diferentes espécies não são idênticas na capacidade de fermentação ácida dos açúcares (glicólise), nem na diminuição do pH que induzem, pelo que não apresentam o mesmo potencial cariogénico.
O agente bacteriano S. mutans tem também uma capacidade de recolonização rápida e possui especial virulência, quer pela aptidão colonizadora (adesinas), quer pelas características de persistência (agressinas, toxinas, impedinas, etc.), quer ainda pela eficácia de destruição celular (actividade proteásica e pró-inflamatória). Assim, as respectivas taxas de colonização na cavidade oral possuem valor preditivo e permitem reconhecimento diagnóstico da população de alto risco.
A estagnação de restos alimentares é importante no desenvolvimento da placa bacteriana e respectiva cariogenicidade. A placa torna-se visível ao fim de 12-24 horas de se deixar de proceder a escovagem, sendo facilmente demonstrável pelos “corantes de placa”, como os solutos de eritrosina, disponíveis em quase todas as marcas de produtos de higiene dentária.
Os corantes também permitem a verificação pedagógica e simples de que o atrito da mastigação não é suficiente para a respectiva remoção, só eficazmente obtida por escovagem.
Colonização oral
A criança recém-nascida tem a boca isenta de bactérias. A colonização estabelecer-se-á por contaminação a partir da saliva do cuidador, a mãe geralmente; mães com níveis salivares altos de S. mutans tendem a ter crianças também com níveis altos deste agente microbiano.
S. mutans não é detectável antes da erupção dentária; sabe-se da sua pouca apetência para os epitélios nessa fase da vida e que os picos reprodutivos são largamente compensados no bebé pela grande frequência de deglutição. Pode, contudo, colonizar dispositivos ortodônticos, (acrílicos com superfícies duras, não descamativas).
As colónias aumentam com a idade e a infecção ocorre, preferencialmente, com a erupção dos primeiros molares decíduos; o seu número é tanto mais elevado quanto maior a susceptibilidade à cárie, como acontece nas cáries precoces da infância.
Substrato e regime alimentar
A sucrose (ou sacarose), um dissacárido, é o mais cariogénico dos açúcares e o mais utilizado, no regime alimentar; a glucose e a frutose, monossacáridos, têm, também, potenciais relativamente elevados.
O seu efeito é meramente local, dependendo da respectiva fermentação pelas bactérias da placa, geradoras de ácidos orgânicos que induzem a descida do pH abaixo do ponto crítico de 5.7, o qual é suficiente para a dissolução dos cristais de hidroapatite do esmalte.
Um regime rico em sucrose, fornecido por sonda nasogástrica, não induz cárie no animal susceptível.
Saliente-se que a sucrose favorece – de forma especial – a produção dos polissacáridos insolúveis, de características adesivas, na placa bacteriana; sabe-se que facilita a colonização por S. mutans e que a sua cariogenicidade aumenta com a frequência de ingestão, mais do que com a quantidade total ingerida.
Um veículo pegajoso (caramelo, bolacha), aderente às superfícies dos dentes, com libertação prolongada de sucrose, será mais deletério que a ingestão de sucrose numa bebida. Enquanto os açúcares da fruta, dos legumes e das bebidas, são eliminados da boca em aproximadamente 5 minutos, os veiculados pelas pastilhas-elásticas, rebuçados e bombons subsistem entre 20 e 40 minutos.
O efeito desmineralizante torna-se especialmente significativo quando o consumo é feito fora das refeições.
A lactose e a galactose têm cariogenicidade mais baixa; os polióis (xilitol, sorbitol, manitol), tal como outros edulcorantes (sacarina, aspartame, ciclamato), não são cariogénicos.
Saliva
É o meio ambiente dos dentes e placa bacteriana.
A importância do fluxo é grande, pois permite a diluição volumétrica dos alimentos, nomeadamente dos açúcares, e a sua evacuação, bem como a da placa bacteriana.
O seu poder tampão depende do sistema ácido carbónico/bicarbonatos, e do sistema dos fosfatos; os bicarbonatos participam no controlo do pH da placa bacteriana e a sua quantidade aumenta paralelamente ao aumento do débito. Por outro lado, a saliva contém F, estimando-se um teor de 0,02 ppm.
Os componentes orgânicos, também têm papel importante.
Das proteínas não imunoglobulínicas, quer a lisozima, quer a lactoferrina, revelam alguma capacidade de inibição das bactérias cariogénicas; o sistema peróxido (enzimas, tiocianato e peróxido de hidrogénio) é também antibacteriano para além de antimutagénico e anticarcinogénico; as mucinas modificam a adesão das bactérias à superfície dentária.
Das imunoglobulinas, a IgA revela alguma capacidade de neutralização, inibição ou antiaglutinação bacteriana.
A insuficiência do efeito de depuração e alcalinização (associada à escassa eficiência antibacteriana dos componentes orgânicos), permite-nos entender o aumento de incidência da cárie nas circunstâncias de xerostomia e de hipossialia: da diabetes à anorexia nervosa, do efeito dos antidepressivos à irradiação terapêutica da área da cabeça e pescoço.
Ao papel do F será dada ênfase adiante.
Cárie precoce da infância
Na dentição decídua, os incisivos inferiores são os dentes menos susceptíveis à cárie. A sequência natural parece ser: molares inferiores, molares superiores, incisivos e caninos superiores, caninos inferiores. As superfícies labiais (ou vestibulares) e as linguais (ou palatinas) raras vezes são atingidas.
As cáries precoces da infância, contudo, afastam-se desta norma. Rapidamente destrutivas e pouco diagnosticadas em tempo útil, atingem – na criança muito pequena – não os dentes ou as superfícies dentárias naturalmente mais susceptíveis, mas as mais expostas ao substrato.
Assumem três distribuições sugestivas e são, muitas vezes, na gíria, designadas pelo nome inglês: honey-dummy ou de chupeta, nursing bottle ou do biberão e at will ou dos comilões.
As cáries da chupeta são desencadeadas pelas chupetas impregnadas de substâncias açucaradas; iniciam-se pelas superfícies labiais dos incisivos superiores, atingindo progressivamente todas as superfícies de todos os dentes com erupção já completa. Correspondem às mais vastas destruições dentárias que são observadas na idade pediátrica.
Há que detectá-las em fase precoce, nomeadamente quando se apresentam na fase de mancha, em pequena meia-lua, branco opaco, justa-gengivais, alertando para a necessidade de correcção do hábito. É, pois, indispensável que a inspecção da boca, no exame objectivo sumário, as detecte.
As cáries do biberão não se relacionam com o consumo de açúcares acrescentados, mas com uma frequência muito elevada de ingestão de leite, por biberão e, também, com a sobreexposição que constitui o adormecer com o biberão na boca. Pela relação posicional e pelo deslizar para trás do leite, compreende-se que as lesões prefiram as superfícies linguais dos incisivos superiores e oclusais dos molares superiores, mesmo que também possam atingir os caninos superiores. Contrariamente às cáries da chupeta, salvo casos extremos, poupam os incisivos inferiores, protegidos pela projecção anterior da língua. Esta projecção favorece a aproximação das carúnculas dos canais de Wharton, relativamente às superfícies linguais, favorecendo a depuração e o tamponamento dos ácidos da placa bacteriana.
As cáries dos comilões dizem respeito às crianças alimentadas ao peito, com refeições muito frequentes, todas as que querem, e que, quase invariavelmente, dormem com as mães.
Dado o menor comprimento do mamilo, relativamente à média das tetinas, e a sua menor deformação succional, os molares tendem a não ser atingidos, sendo as superfícies labiais superiores dos incisivos menos destruídas.
As lesões são patognomónicas. Constam da destruição completa do esmalte da superfície palatina dos incisivos centrais e laterais superiores, progressivamente para labial, desenhando e “roubando” uma meia-lua de esmalte e dentina dos bordos incisais. A sua detecção precoce só é possível pela observação endoral cuidadosa das superfícies palatinas. De referir que a “mancha branca” é reversível com higiene (lavagem e escovagem correctas) e flúor tópico.
Prevenção
A prevenção deve iniciar-se no período pré-natal, pois demonstrou-se que nas mães em que foram aplicadas medidas preventivas, o risco de cárie no filho diminui. O tratamento feito em tal período não comporta risco para o feto.
O papel do flúor
Julgava-se que o efeito cariostático do ião flúor residia na sua capacidade de se incorporar na porção mineral do dente, isto é, de substituir o ião hidroxilo na hidroxiapatite dos cristais de esmalte, em período pré-eruptivo, transformando-a em fluorapatite, mais resistente à desmineralização.
Reconhece-se, hoje, que o seu efeito é tópico. É a sua presença na fase líquida do meio dentário (saliva, líquido da placa e espaços intercristais), por fornecimento continuado, que permite a inibição da dissolução ácida do esmalte e do cimento.
Em verdade, a sua integração no esmalte durante o desenvolvimento não parece inibir a respectiva desmineralização ácida, o que, porém, se verifica quando apenas envolve a superfície dos cristais.
O flúor não se limita a inibir a desmineralização do esmalte; potencia também a sua remineralização quando adsorvido pela superfície dos cristais submetidos à acção de ácido, para os quais atrai os iões cálcio e fosfato. Tem, por outro lado, efeito de inibição da actividade bacteriana, modesta actividade inibitória sobre os polissacáridos da placa, diminuindo a respectiva adesão e interfere no metabolismo da enolase, comprometendo a glicólise em condições de pH mais baixo.
Flúor sistémico
Mais de 275 milhões de pessoas consomem água fluoretada (3% da população mundial e 56% da população do Estados Unidos da América). Na Europa, só a Irlanda optou por esta relevante medida de Saúde Pública, tal como algumas cidades na Europa (Sevilha – Espanha, Basileia – Suíça).
Numerosos estudos demonstram que a presença de flúor na água potável, à razão de 1 parte por milhão (1ppm) (ou 1 mg de flúor por 1 litro de água pura), reduz em 50% a cárie dentária, na população pediátrica. Em Portugal Continental, os valores são em geral baixos, e as águas não estão sujeitas a fluorização artificial.
A suplementação do leite com flúor, também disponível, é uma alternativa de controlo mais complexa. O sal de mesa – fluoretado a 250 mg/Kg – é utilizado na Suíça, na Hungria e em França, bem como na Colômbia e no México.
A utilização de medicamentos contendo fluoretos, na forma de gotas orais e comprimidos, foi até há pouco recomendada pelos profissionais de saúde (pediatras, médicos de família, clínicos gerais, médicos estomatologistas, médicos dentistas), dos 6 meses até aos 16 anos. A compreensão actual do mecanismo de acção dos fluoretos na prevenção da cárie dentária e a demonstração do risco de fluorose relacionado com suprimento mais elevado de fluoreto em áreas geográficas com teor mais elevado em F na água de consumo legitimaram, de acordo com o Programa de Promoção de Saúde Oral/DGS e a Canadian Consensus Conference on the Appropriate use of Fluoride Supplements for the Prevention of Dental Caries in Children, a seguinte recomendação: a administração de suplemento de F em gotas ou comprimidos* só é recomendada (a partir dos 6 meses de idade) quando o teor de fluoretos na água de abastecimento público for inferior a 0,3 partes por milhão (ppm) e:
- a criança (ou quem cuida da criança) não escova os dentes com um dentífrico fluoretado duas vezes por dia; ou
- a criança (ou quem cuida da criança) escova os dentes com um dentífrico fluoretado duas vezes por dia, mas verifica-se situação de alto risco de cárie dentária.
Os suplementos deverão ser: idealmente consumidos ao deitar.
Transcreve-se, do Programa atrás referido, um quadro orientador dos critérios de risco a ponderar (Quadro 1), sugerindo-se a consulta do Capítulo sobre Nutrientes, Parte XI.
* À luz dos conhecimentos actuais, tendo em conta o papel efectivo do F tópico, a administração de suplementos por via oral (gotas ou comprimidos) não deve ser considerada medida de 1ª linha. Por outro lado, não existe consenso, quer quanto ao teor mínimo de F na água de consumo que legitima a suplementação (< 0,3 ppm ou 0,3-0,6 ppm), quer quanto à dose padrão: 0,25 mg/dia, ou superior: 0,25-1 mg/dia. Aliás, no nosso País não há dados generalizados sobre o teor em F das águas de consumo público, pelo que é sugerido que, em cada região, o clínico obtenha informação rigorosa sobre o assunto junto das autarquias. |
QUADRO 1 – Programa Nacional de Promoção da Saúde Oral
| Factores de Risco | Baixo Risco | Alto Risco |
| Evidência clínica de doença | Sem lesões de cárie. Nenhum dente perdido devido a cárie. Poucas ou nenhumas obturações. | Lesões activas de cárie. Extracções devidas a cárie. Duas ou mais obturações. Aparelho fixo de ortodôncia. |
| Análise dos hábitos alimentares | Ingestão pouco frequente de alimentos açucarados. | Ingestão frequente de alimentos açucarados, em particular entre as refeições. |
| Utilização de fluoretos | Uso regular de dentífrico fluoretado. | Não utilização regular de qualquer dentífrico fluoretado. |
| Controlo da placa bacteriana | Escovagem dos dentes duas ou mais vezes por dia. | Não escovagem dos dentes ou uma escovagem pouco eficaz. |
| Nível sócio-económico da família | Médio ou alto. | Baixo. |
| História clínica da criança | Sem problemas de saúde. Ausência de medicação crónica. | Portador de deficiência física ou mental. Ingestão prolongada de medicamentos cariogénicos. Doenças crónicas. Xerostomia (secura da boca por défice de secreção salivar). |
Flúor tópico
A auto-aplicação, através do recurso aos dentífricos fluoretados, justifica a redução da cárie nos países industrializados que não levaram a cabo programas colectivos. Os compostos mais utilizados são os de NaF, MFP (Na2PO3) e SnF2.
A regulamentação europeia preconiza um limite máximo de 1,5 mg F/g de dentífrico, seja 1500 ppm, considerando cosméticos os preparados com essas concentrações. Apesar da comercialização de pastas com concentrações diferentes, para várias idades, 1000-1500 ppm parecem universalmente adequadas, desde a erupção do primeiro dente, se a quantidade utilizada nas duas escovagens diárias não ultrapassar o tamanho da unha do 5º dedo da criança. A partir dos 6 anos, presume-se que a deglutição do dentífrico será perfeitamente esporádica, utilizando-se aproximadamente 1 cm de dentífrico, tendo em conta certa uniformização do tamanho das bisnagas.
No meio escolar prefere-se geralmente o recurso aos bochechos com soluções fluoretadas, em geral com NaF a 0,05% para uso diário ou, ainda mais simples, a 0,2% para uso semanal ou quinzenal.
O recurso às pastilhas-elásticas fluoretadas parece especialmente útil em situações de hipossialia (débito inferior a 0,7 ml/min), pois a mastigação aumenta o fluxo e, paralelamente, o pH salivar.
Existe uma grande variedade de compostos para uso profissional (soluções aquosas, pastas, gel ou vernizes), cuja indicação deve ser personalizada.
Como actuação preventiva os especialistas recomendam também um substituto do açúcar – o xilitol, que faz parte da família do poliol, incluindo sorbitol, manitol, e maltiol – incorporado em pastilhas elásticas para deixar derreter na boca.
O Quadro 2 especifica as recomendações técnico-normativas relacionadas com escovagem, dentífrico e eventual suplemento de flúor. (PPSOCA)
Fluorose
A fluorose clínica constitui o marcador biológico da intoxicação crónica pelo fluoreto, patente na perturbação pré-eruptiva da formação do esmalte.
Atinge aproximadamente 3,9% das crianças francesas, dos 6 aos 15 anos; nos Estados Unidos da América atinge 20%: ~16% de forma muito ligeira, 4% de forma ligeira e apenas 0,3% de forma grave.
Trata-se duma hipoplasia do esmalte, histologicamente caracterizada por hipomineralização da subsuperfície, associada a hipermineralização da superfície, e hidrólise da matriz proteica.
O seu risco máximo decorre entre os 18 meses e os 3 anos de idade. É muito menos frequente na dentição decídua que na definitiva.
Fora das zonas endémicas, a sua forma de apresentação mais frequente é a de muito discreta alteração estética do esmalte, por pequenas manchas ou linhas brancas, opacas, semelhantes à fase inicial, dita em mancha, da cárie dentária. Os defeitos estruturais, contudo, podem ser mais penalizantes.
Na dentição decídua, no entanto, pode ser especialmente difícil distinguir à inspecção defeitos estruturais resultantes da fluorose, de outros com etiopatogénese diversa
QUADRO 2 – Recomendações técnico-normativas do Programa de Promoção da Saúde Oral nas Crianças e Adolescentes (PPSOCA)
| Anos | Frequência da escovagem | Material utilizado | Realização da escovagem | Dentífrico fluoretado | Suplemento sistémico (fluoretos) |
0-3 anos | 2/dia | Gaze Dedeira Escova macia | Pais | 1000-1500 ppm (tamanho da unha do 5º dedo) | Não recomendado |
3-6 anos | 2/dia | Escova macia | Pais e/ou Criança | 1000-1500 ppm | Não recomendado Excepção alto risco de cárie dentária: 0,25 mg diário |
> de 6 anos | 2/dia | Escova macia ou média | Criança e/ou Pais | 1000-1500 ppm (quantidade aproximada de 1 centímetro) | Não recomendado Excepção alto risco de cárie dentária: 0,25 mg diário |
Advoga-se o não recurso a dentífricos de sabor a guloseimas, para não estimular a criança ao seu consumo dissimulado.
Como regra de segurança, ao longo do período de prevenção não deve ser ultrapassada a dose de 120 mg (total).
O risco de intoxicação aguda (doses > 5 mg/Kg) deve, porém, fazer com que a inacessibilidade das embalagens de dentífricos e afins obedeça às mesmas regras de segurança e protecção dos medicamentos.
Escovagem
Compreende-se, assim, que o controlo da placa bacteriana passa pela higienização pós-alimentar de todos os dentes, desde a sua erupção, a promover desde os primeiros meses de vida com compressa húmida ou dedeira espiculada, de borracha ou pequena escova macia, idealmente já com pequena porção de dentífrico fluoretado, entre 1000 e 1500 ppm.
A escovagem, que se deve executar desde o aparecimento do primeiro dente, estabelece o atrito que permite desalojar a placa bacteriana e os seus ácidos, sendo especialmente útil após as refeições e ao deitar, dada a diminuição do efeito tampão e de depuração salivares, próprios da hipossialia nocturna. A ausência de escovagem nocturna é, pois, muito penalizante.
A maioria das pastas com fluoreto apresenta-se com algum tipo de abrasivo, compatível com aquele; outros componentes químicos – como é o caso da clorexidina a 0,2%, um antisséptico de elevada eficácia antiplaca bacteriana, e do triclosan – são de utilização menos generalizada em pediatria.
A escovagem, também relevante no controlo da doença periodontal, deve decorrer na presença de adulto e justificar o apuramento técnico, “mãos na escova”, por parte deste, pelo menos até aos 6 anos de idade ou quando houver condições de autonomia a qual carece, ainda assim, de controlo esporádico.
O convite à escovagem simultânea, em família, pode ser interessante, nalguns grupos ou circunstâncias. Uma das escovagens diárias deve ser feita na escola, uma vez que na vida de muitas crianças essa pode ser a única oportunidade de informação adequadamente veiculada e controlada.
Os hidropulsores, com um ou vários jactos, já relativamente vulgarizados, são complementos muito úteis nas crianças e jovens com aparelhos de ortodôncia ou próteses.
Outros métodos, paralelos e mais ou menos diferenciados, estão fora do âmbito deste trabalho que não pretende relevar a importância do apoio profissionalizado. No que diz respeito às crianças com necessidades especiais, convida-se o leitor a consultar o Manual de Boas Práticas em Saúde Oral, disponível no sítio electrónico da Direcção Geral da Saúde (www.dgsaude.pt).
Selantes de fissuras
Os sulcos e fissuras são elementos anatómicos importantes dos molares e pré-molares, apesar de não serem exclusivos destes. Constituem zonas anfractuosas, morfologicamente vulneráveis (defeitos de coalescência do esmalte) e de difícil acesso aos pêlos da escova. (Figura 6)
Se a fluorização reduziu a prevalência da cárie das superfícies lisas dos dentes, não tem influenciado significativamente a respectiva incidência ao nível dos sulcos e fissuras.
Os sulcos e fissuras representam apenas 12% da superfície total do esmalte exposto, mas estão na origem de 50% das situações de cárie em idade escolar, podendo representar até 80% das lesões diagnosticáveis aos 12 anos.
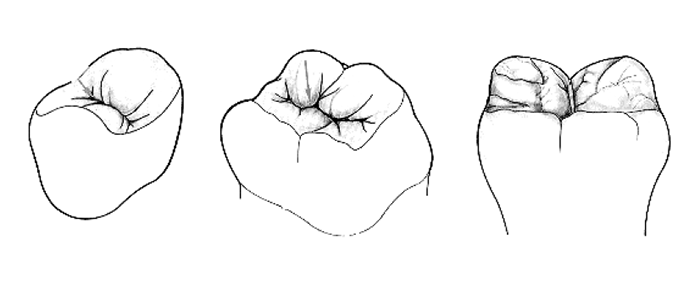
FIGURA 6. Sulcos e fissuras
Sabe-se, no entanto, que a maioria das cáries de fissura se inicia logo durante a fase de erupção dos pré-molares, relativamente rápida (1-2 meses), em comparação com a dos molares, que ronda 1 ano e meio. Assim, poderá haver já cárie com maior probabilidade após erupção completa dos molares. Os primeiros molares definitivos, sextos dentes ou dentes dos 6 anos são especialmente atingidos.
Os sulcos e fissuras são eficazmente protegidos pelos chamados selantes, se adequadamente aplicados; o método que se resume constitui, apenas, um exemplo*.
* O termo selagem em estomatologia e ortopedia significa no sentido genérico, “fixação de material”. |
O esmalte é pré-tratado pelo ácido fosfórico a 37%, durante 20 segundos, sofrendo uma desmineralização em superfície e lavado com água, a seguir, durante aproximadamente 30 segundos. Depois de seco, é-lhe aplicada uma resina tipo Bis-GMA que se projectará nas micro-retenções induzidas pelo ataque ácido, mas que deverá estender-se um pouco em superfície, para protecção completa.
Os selantes são esteticamente excelentes ou mesmo “invisíveis”, mas dependem muito – em efectividade – do rigor técnico da sua aplicação. O isolamento da saliva é fundamental.
Não está provada a sua utilidade nos sulcos dos molares decíduos.
O esmalte é pré-tratado pelo ácido fosfórico a 37%, durante 20 segundos, sofrendo uma desmineralização em superfície e lavado com água, a seguir, durante aproximadamente 30 segundos. Depois de seco, é-lhe aplicada uma resina tipo Bis-GMA que se projectará nas micro-retenções induzidas pelo ataque ácido, mas que deverá estender-se um pouco em superfície, para protecção completa.
Os selantes são esteticamente excelentes ou mesmo “invisíveis”, mas dependem muito – em efectividade – do rigor técnico da sua aplicação. O isolamento da saliva é fundamental.
Não está provada a sua utilidade nos sulcos dos molares decíduos.
BIBLIOGRAFIA
American Academy of Pediatrics. Section on Breastfeeding. Breastfeeding and the use of human milk. Pediatrics 2012; 129: e827-831
American Academy of Pediatrics. Section on Pediatric Dentistry and Oral Health. Preventive oral health intervention for pediatricians. Pediatrics 2008; 122: 1387-1391
American Academy of Pediatric Dentistry. Policy on oral and maxillofacial surgery for infants, children, and adolescents. Pediatr Dent 2003; 25: 116-119
American Academy of Pediatric Dentistry. Policy on prevention of sports-related orofacial injuries. Classifications, consequences and preventive strategies. Pediatr Dent 2003; 25: 37-41
Andreasen JO, Andreasen FM, Bakland LK et al: Traumatic Dental Injuries: AManual. Copenhagen: Munksgaard, 1999
Andreasen JO, Andreasen FM: Classification, etiology and epidemiology of traumatic injuries. In Andreasen JO, Andreasen FM (eds) Textbook and Color Atlas of Traumatic Injuries to the Teeth. Copenhagen: Munksgaard, 1993, 151-177
Areias C, Macho V, Bulhosa JF, et al. Saúde oral em Pediatria Acta Pediatr Port 2008; 39: 163-170
Berkovitz Rj. Etiology of nursing caries: a microbiological perspective. J Publ Health Dent 1996; 56: 51-55
Center for Disease Control and Prevention. Recommendations for using fluoride to prevent and control dental caries in the United States. MMWR 2001; 50 (RR14): 1-42
Clarke L, Stevens C. Preventing dental caries in children: why children’s oral health is everybody’s business. Paediatr Child Health 2019; 29: 536-542
DHHS. Oral health in America: A report of the Surgeon General. Rockville: National Institute of Dental and Craniofacial Research, 2000
Enlow DH, Hans MG. Essentials of facial growth. Philadelphia: Saunders, 1996.
Erikson PR, McClintock KL, Green N. Estimation of the cariesrelated risk associated with infant formulas. Pediatr Dent 1998; 20: 395-403
Goldman L, Schafer AI (eds). Goldman-Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Green M, Palfrey JS. Bright Futures: Guidelines for Health Supervision of Infants, Children and Adolescents. Arlington: National Center dor Education in Maternal and Child Health, 2000
Griffen Al (ed). Pediatric oral health. Pediatr Clin North Am 2000; 47
Hale KJ. AAP Section on Pediatric Dentistry. Oral health risk assessment timming and establishment of the dental home. Pediatrics 2003; 111: 1113-1116
Innes NPT, Robertson MD. Recent advances in the management of childhood dental caries. Arch Dis Child 2018; 103: 311-315
Jing D, Hao J, Shen, et al. Effect of fixed orthodontic treatment on oral microbiota and salivary proteins. Experimental and Therapeutic Medicine 2019; March 18, 2019: pgs 4237-4243.https://doi.org/10.3892/etm.2019.7401
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Levy, SM. An update on fluorides and fluorosis. J Canadian Dental Association 2003; 69: 286-291
Linn YTJ, Lu PW. Retrospective study of pediatric facial cellulitis of odontogenic origin. Pediatr Infect Dis J 2006; 25: 339-342
Moyer VA. US Preventive Services Task Force Statement: Prevntion of dental caries in children from birth through age 5 years. Pediatrics 2014; 133: 1102-1111
Naido S. A profile of the orofacial injuries in child physical abuse at a children’s hospital. Child Abuse Negl 2000; 24: 521-525
Neville JL et al. Oral & Maxillofacial Pathology. Philadelphia: Saunders, 2002
Nguyen PM, Kenny DJ, Barrett EJ. Socio-economic burden of permanent incisor replantation on children and parents. Dent Traumatol 2004; 20: 123-133
Pahel BT, Rowan-Legg A, Quinonez RB. A developmental approach to pediatric oral health. Pediatr Clin North Am. 2018; 65 :885-907. doi: 10.1016/j.pcl.2018.05.003
Papageorgiou SN, Xavier GM, Cobourne MT, Eliades T. Effect of orthodontic treatment on the subgingival microbiota: A systematic review and meta-analysis. Orthod Craniofac Res 2018;21:175-185. doi: 10.1111/ocr.12237
Proffit W R, Fields W. Early Stages of Development in Contemporary Orthodontics. St. Louis: Mosby, 2000.
Programa Nacional de Promoção da Saúde Oral. Acta Pediatr Port 2005; 36: 95-96
Ritter V, Catalanotto F, Lossius M. Pediatrics in the community: “Keep smiling!” ´the Florida Fluoride Project. Pediatr Rev 2010; 31: 30-31
Roda RP, Bagán JV, Bielsa JMS, Pastor EC. Antibiotic use in dental practice. A review. Med Oral Patol Oral Cir Bucal 2007;12: E186-E192
Rompante P. Mecanismos preventivos do flúor e cárie dentária. Acta Pediatr Port 2009; 40: 223-228
Scully C. Aphtous ulceration. NEJM 2006; 355: 165-172
Selwitz RH, Ismail AI, Pitts NB. Dental caries. Lancet 2007; 369: 51-58
Sonis A, Zaragoza S. Dental health for the pediatrician. Curr Opin Pediatr 2001; 13: 289-295
Ursi WJS. Crescimento e alterações nas relações mandibulares dos 6 aos 18 anos de idade. Ortodontia 1996; 29: 4-11
WHO. Guidelines for drinking-water quality conference (Berlin, 2007). Geneva: WHO, 2007