Definição e importância do problema
Na transposição completa das grandes artérias (TGA) a aurícula direita (AD) comunica com o ventrículo direito (VD) e este com a aorta (AO); e a aurícula esquerda (AE) está conectada ao ventrículo esquerdo (VE) que comunica com a artéria pulmonar (AP).
Este arranjo segmentar designa-se por concordância auriculoventricular (AD>VD e AE>VE) e discordância ventrículo arterial (VD>AO e VE>AP): desta forma, as circulações sistémica e a pulmonar encontram-se em circuitos paralelos (AD>VD>AO>AD… e AE>VE>AP>AE…), em vez da circulação em série normal. Esta anomalia anatómica coloca o primeiro grande problema: como fazer chegar sangue oxigenado aos tecidos. (Figura 1)
Apesar da baixa prevalência (5 a 10% das cardiopatias congénitas), a TGA é a mais frequente das cardiopatias cianóticas com manifestações clínicas no período neonatal. Predomina no sexo masculino; nas famílias destes doentes podem existir irmãos com tetralogia de Fallot e, raramente, com TGA. A etiologia é multifactorial havendo forte associação com delecção do cromossoma 22q11.
Esta cardiopatia, se não tratada, tem elevada mortalidade no período neonatal, sendo fatal na quase totalidade dos doentes até ao primeiro ano de vida.
Anatomia
Na TGA as câmaras de saída ventriculares são paralelas. Na ausência de anomalias associadas, a espessura do ventrículo direito (que à nascença é semelhante à do ventrículo esquerdo) aumenta rapidamente tornando-se muito maior que a do ventrículo esquerdo. A relação entre as grandes artérias está alterada, colocando-se o orifício aórtico adiante e à direita do orifício pulmonar. As anomalias de origem e divisão das artérias coronárias são frequentes. Cerca de metade dos doentes com TGA não tem qualquer outra anomalia associada excepto a manutenção da permeabilidade do foramen ovale e/ou do canal arterial.
FIGURA 1. Circulação na transposição completa das grandes artérias. AD: aurícula direita; VD: ventrículo direito; VE: ventrículo esquerdo; AP: artéria pulmonar; 1 – comunicação interauricular; 2 – comunicação interventricular; 3 – canal arterial. (adaptado de Neches, 1998)
Podendo associar-se outros defeitos, surge, nesta circunstância, a designação de transposição complexa das grandes artérias. Em cerca de 25% dos casos existe comunicação interventricular (CIV) e, mais raramente, coarctação da aorta ou interrupção do arco aórtico. Nos casos acompanhados de CIV podem existir obstáculos na câmara de saída do ventrículo esquerdo.
Fisiopatologia
Existindo circulações sistémica e pulmonar em paralelo, acontece que o retorno venoso sistémico é dirigido para a circulação arterial sistémica e o retorno venoso pulmonar é novamente dirigido para a circulação arterial pulmonar.
Desta forma, a característica fisiopatológica mais relevante desta anomalia é a presença de saturação em O2 – Hb (SpO2) de valor mais elevado no sangue da artéria pulmonar do que no da aorta. A sobrevivência depende, pois, da existência de comunicações entre as circulações sistémica e pulmonar (canal arterial, foramen ovale e septos interauricular ou interventricular).
A presença de CIV grande melhora a cianose, mas agrava a insuficiência cardíaca congestiva à medida que, nas primeiras semanas de vida, as resistências vasculares pulmonares diminuem. A persistência do canal arterial ou a associação de coarctação da aorta podem também ser causa de insuficiência cardíaca.
Na TGA com CIV ocorre frequentemente (80% dos casos) evolução para doença vascular pulmonar até aos 12 meses de vida se a anomalia não for tratada precocemente.
Mas, também pode ocorrer esta alteração vascular pulmonar em cerca de 20% das crianças com TGA e septo interventricular íntegro; tal evolução, acompanhada de cianose mais acentuada e evolução irreversível, associa-se raramente à presença de artérias colaterais sistémico-pulmonares, embora em geral a etiologia seja mal conhecida e provavelmente geneticamente determinada.
Por outro lado, se existir estenose pulmonar (subvalvular ou valvular) grave, o fluxo pulmonar diminui com agravamento da cianose e acidose metabólica.
Manifestações clínicas
Existem dois modos de apresentação predominantes: 1) cianose acentuada precoce nos casos com septo interventricular intacto ou quando existe CIV associada a estenose pulmonar importante; 2) insuficiência cardíaca nos casos com shunts importantes, sendo que a cianose pode ser muito ligeira e detectar-se apenas no fim do primeiro mês de vida.
Realça-se que, perante um recém-nascido com cianose, depois de excluída a causa pulmonar, deve sempre admitir-se a possibilidade de se tratar de transposição das grandes artérias, principalmente na ausência de sopros e de outros sinais de doença cardíaca.
A auscultação cardíaca evidencia aumento da intensidade do primeiro ruído, e o segundo ruído parecendo único. Na forma isolada não se auscultam sopros. Caso tal aconteça, os referidos sopros são representativos das lesões associadas.
Exames complementares
Gasometria
Perante um recém-nascido com cianose é fundamental excluir todas as causas não cardíacas desta situação, em particular, a patologia pulmonar, mais frequente, que condiciona sintomatologia idêntica à de causa cardíaca. A realização de gasometria arterial ou capilar pode ser esclarecedora: na TGA a pressão arterial do oxigénio (PaO2) raramente excede 40 a 50 mmHg. A administração de oxigénio (prova de hiperóxia – administração de O2 a 100% durante 10 minutos) não provoca alteração da SpO2 no sangue arterial, o que permite o diagnóstico diferencial com doenças pulmonares (nestas, a administração de O2 melhora a referida saturação). Também é importante notar que na TGA a hipoxemia se acompanha de pressão arterial do dióxido de carbono (PaCO2) normal ou diminuída, enquanto nos casos de cianose, causada por patologia pulmonar, existe habitualmente aumento da PaCO2.
Radiografia do tórax
Na radiografia do tórax em projecção póstero-anterior o índice cardiotorácico e a vascularização pulmonar são normais; a largura do mediastino superior está diminuída (devido à posição relativa da aorta e da artéria pulmonar, e à redução das dimensões do timo) apresentando a imagem cardíaca a forma de “ovo deitado”. (Figura 1)
Na presença de TGA com CIV geralmente existe cardiomegalia com silhueta cardíaca típica e aumento da vascularização pulmonar; nas situações com obstáculo pulmonar associado, a silhueta cardíaca é de dimensões normais, ovóide, e existe diminuição da vascularização pulmonar (oligoémia).
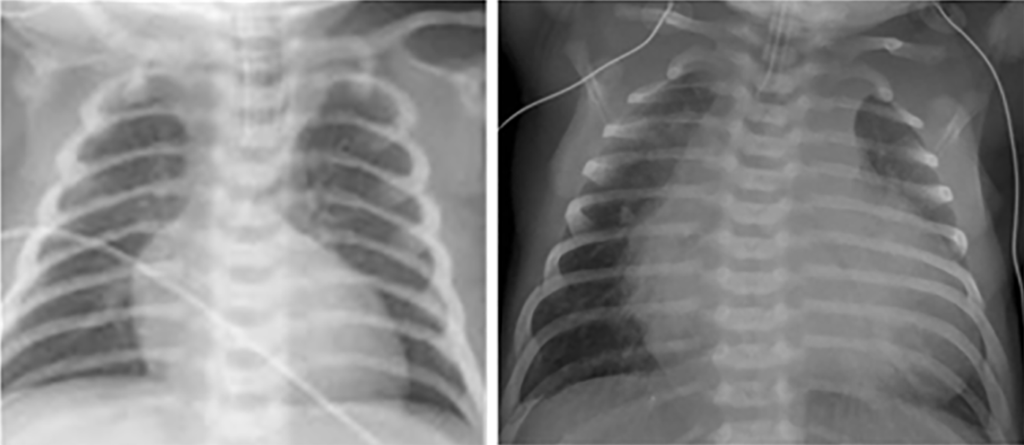
FIGURA 2. Radiografia do tórax de recém-nascido com TGA simples (imagem da esquerda), e com CIV (imagem da direita). Evidenciando-se na primeira a forma ovóide da silhueta cardíaca e a vascularização pulmonar normal, na segunda existe cardiomegalia, ainda com silhueta ovóide e aumento da vascularização pulmonar
Electrocardiograma
O electrocardiograma pode ser normal, apresentando o predomínio direito típico dos recém-nascidos nos primeiros dias, e evoluindo, depois, para hipertrofia ventricular direita. As perturbações da condução são frequentes e existem sinais de hipertrofia ventricular direita. Também pode ocorrer hipertrofia ventricular esquerda se houver obstrução da câmara de saída do ventrículo esquerdo e hipertrofia biventricular na presença de comunicação interventricular grande.
Ecocardiograma
O ecocardiograma permite estabelecer o diagnóstico e planear a terapêutica, nomeadamente esclarecendo a patologia associada e a morfologia dos shunts funcionais fundamentais (foramen ovale e canal arterial). Actualmente as capacidades de definição da imagem dos aparelhos de ecocardiografia permitem a identificação morfológica, localização e função das artérias coronárias, elementos fundamentais para o planeamento terapêutico. (Figura 3)
A ecocardiografia é ainda fundamental para a realização de atriosseptostomia de Rashkind. Este procedimento deve ser realizado em todos os recém-nascidos com transposição das grandes artérias, mesmo na presença de comunicação interventricular; exceptuam-se os casos em que coexiste comunicação interauricular grande, porque o shunt interauricular assegura melhor mistura dos fluxos durante todo o ciclo cardíaco, em comparação com o que acontece se existir interventricular. Esta manobra é realizada com apoio de ecocardiografia, na sala de hemodinâmica, ou, em caso de emergência, à cabeceira do doente, apenas com visualização por ecocardiografia.
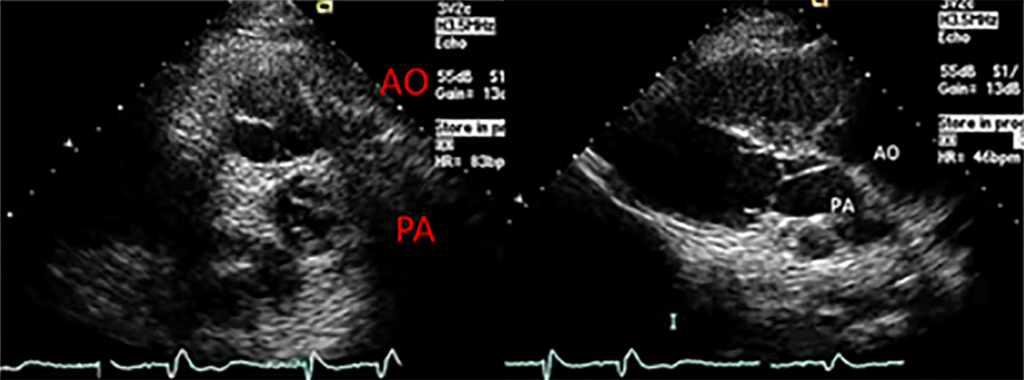
FIGURA 3. Ecocardiograma em caso de TGA, demonstrando em eixo curto (imagem da esquerda) a relação ântero-posterior da aorta (AO) e artéria pulmonar (PA) e, em eixo longo (imagem da direita), a saída paralela dos vasos, com a PA comunicando com o ventrículo esquerdo, posterior, e AO ao ventrículo direito, anterior
Cateterismo cardíaco
Este método diagnóstico não é imprescindível para o diagnóstico uma vez que, através da ecocardiografia, se consegue actualmente efectuar o diagnóstico morfológico e funcional com acuidade.
Contudo, utiliza-se para a realização de determinados procedimentos como a atriosseptostomia com balão de Rashkind e Miller, a qual pode ser necessária para a sobrevivência da criança nos primeiros dias de vida. Recorda-se que esta técnica consiste na passagem brusca, através do septo interauricular, dum cateter munido de um balão com soro, permitindo criar uma comunicação entre as duas aurículas.
Tratamento
Tratamento de suporte
Consiste na correcção da acidose metabólica e da hipoglicemia, administração de oxigénio e de prostaglandina E1 com o objetivo de manter a permeabilidade do canal arterial.
Qualquer recém-nascido com cianose e suspeita diagnóstica de TGA deve ser transportado em ambulância devidamente medicalizada do INEM para um centro médico-cirúrgico de cardiologia pediátrica.
A atriosseptostomia de Rashkind é também considerada uma manobra de suporte, pois permite estabilizar e melhorar as saturações do recém-nascido.
Tratamento cirúrgico
O tratamento da TGA é a correcção cirúrgica para restabelecimento da anatomia e funcionalidade normal das circulações.
A correcção anatómica (operação de Jaténe ou switch arterial) é a técnica utilizada. Consiste na secção da aorta e da artéria pulmonar acima do orifício valvular, sutura da aorta com o orifício valvular da pulmonar, e da pulmonar com o orifício valvular da aorta, e também transferência das artérias coronárias para a “nova” aorta. Deve ser realizada nas primeiras semanas de vida enquanto o ventrículo esquerdo mantém a capacidade de adaptação a pressões sistémicas.
Nos casos de apresentação tardia (idade superior a um mês), pode ser necessário fazer previamente banding da artéria pulmonar de modo a provocar hipertrofia do ventrículo esquerdo, e a preparar este para gerar pressões sistémicas após a correcção anatómica.
Nos casos acompanhados de doença vascular pulmonar irreversível, opta-se por fazer a correção anatómica mantendo a CIV aberta (ou criando uma CIV “de novo”).
Os resultados finais da técnica cirúrgica referida, comportando mortalidade inferior a 5%, dependem fundamentalmente da presença de lesões associadas, ou de anomalias das artérias coronárias, em particular na presença de coronária única.
Os problemas detectados no seguimento dos doentes operados de correcção anatómica (oclusão/estenose das artérias coronárias, estenose supravalvular e dos ramos das artérias pulmonares, e regurgitação da “nova” válvula aórtica) têm vindo a diminuir de incidência com o aperfeiçoamento da técnica cirúrgica. Contudo, requerem observações seriadas e planeamento de exames complementares para detecção de alterações e eventual tratamento ulterior.
Prognóstico
A mortalidade das crianças não tratadas atingia, em décadas anteriores, cerca de 90% no primeiro ano de vida. Actualmente, graças aos progressos das terapêuticas médica e cirúrgica, consegue-se uma sobrevivência superior a 90% até à idade adulta, com uma boa qualidade de vida.
Nota importante: Nos casos de TGA deve proceder-se a profilaxia da endocardite bacteriana.
BIBLIOGRAFIA
Garson AJr, Bricker JT, Fisher DJ, Neish SR (eds). The Science and Practice of Pediatric Cardiology. Baltimore: Williams & Wilkins, 1998
Kaku S. Circulação coronária na transposição completa das grandes artérias – avaliação anatómica e funcional antes e depois da operação de Jaténe. Dissertação de Doutoramento. Lisboa: Universidade Nova de Lisboa, 1998
Kaku S, Pacheco M. Transposição completa das grandes artérias. In Soares-Costa JTS e Kaku S (eds). Cardiopatias Congénitas. Lisboa: Permanyer Portugal, 2005; 91-96
Kharbanda RK, de Groot NMS. Prediction and prevention of sudden cardiac death in transposition of the great arteries: a step closer. Int J Cardiol 2019. pii: S0167-5273(19)31829-7. doi: 10.1016/j.ijcard.2019.04.040.
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Losay J, Hougen T J. Treatment of transposition of the great arteries. Curr Opin Cardiology 1997; 12: 84-90
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Park MK (ed). Park’s Pediatric Cardiology for practitioners. Philadelphia: Elsevier, 2014