Definição e importância do problema
Derrame pleural define-se como acumulação anormal de líquido no espaço pleural.
Os derrames pleurais em idade pediátrica são habitualmente secundários a outra patologia subjacente, surgindo, mais frequentemente, nos países desenvolvidos, como complicação da pneumonia bacteriana.
Estima-se que 2 a 12% das pneumonias se compliquem com esta patologia, sobretudo nos casos sujeitos a internamento, em que esta percentagem aumenta para 28%.
Outras causas mais raras são a insuficiência cardíaca, doenças autoimunes, síndroma nefrótica e neoplasias.
Neste capítulo são abordados apenas os derrames que surgem em concomitância ou como complicação de pneumonia.
Etiopatogénese e classificação
A sua base fisiopatológica consiste num desequilíbrio entre o processo de formação e de depuração/filtração do líquido na cavidade pleural (líquido com baixo teor proteico ~1 g/dL).
O movimento de líquido através dos capilares pleurais segue a lei de Starling, dependendo das pressões hidrostática e coloidosmótica.
São considerados dois tipos de derrame pleural, de acordo com o respectivo mecanismo de formação: transudados e exsudados.
Os transudados, em que não se verifica compromisso inflamatório da pleura, resultam de um desequilíbrio entre a pressão hidrostática e oncótica, podendo por isso estar associados a insuficiência cardíaca, síndroma nefrótica ou hipotiroidismo.
Os exsudados resultam de compromisso inflamatório da pleura (pleurisia), com consequente aumento da permeabilidade capilar e extravasão de proteínas para o espaço pleural.
O quadro 1 explicita os critérios de definição de transudado e de exsudado.
QUADRO 1 – Derrame pleural: transudado e exsudado
| Características | Transudado | Exsudado |
Abreviaturas: LP- líquido pleural; S- sérico; | ||
| Aspecto | Límpido | Turvo/purulento |
| Densidade | < 1.015 | > 1.015 |
| Células (/mm3) | < 1.000 | > 1.000 (predomínio de neutrófilos) |
| LDH (UI/L) | < 200 | > 250 |
| LDH (LP/S) | < 0,6 | > 0,6 |
| Proteínas (g/dL) | < 2,5 | > 3 |
| Proteínas (LP/S) | < 0,5 | > 0,5 |
| Glucose (mg/dL) | > 40 | < 40 |
| pH | 7,4-7,6 | < 7,2 |
| Coloração Gram | Negativa | Positiva em < 1/3 dos casos |
Na prática clínica são classicamente considerados os seguintes tipos de exsudados de causa infecciosa, sobre os quais recai a abordagem (vide Glossário e Quadro 2):
- Empiemas (líquido purulento e ou com germe identificado)
- Derrame parapneumónico não purulentos (geralmente serofibrinosos)
QUADRO 2 – Etiologia dos exsudados pleurais de causa infecciosa
| Empiemas | Derrames parapneumónicos não purulentos |
| S. pneumoniae | S. pneumoniae |
| S. aureus | Mycoplasma pneumoniae |
| Haemophilus influenzae tipo b | Outras bactérias |
| Vírus |
Manifestações clínicas
A sintomatologia depende predominantemente da data em que a criança é observada pela primeira vez e do tempo de evolução da doença.
Os sintomas mais comuns incluem febre alta, resistente aos antipiréticos, prostração, cianose, anorexia, tosse e dispneia. As crianças de maior idade podem queixar-se de dor pleurítica em pontada, exacerbada com a inspiração ou associada a tosse.
Verifica-se igualmente taquipneia e tosse seca desencadeada pelas mudanças de posição, submacicez à percussão e diminuição ou abolição das vibrações vocais e do murmúrio vesicular; raramente é detectado atrito pleural. Por vezes a criança adopta uma atitude escoliótica côncava para o lado do derrame.
O derrame pleural parapneumónico habitualmente surge como complicação de pneumonias causadas por Streptococcus pneumoniae, Staphylococcus aureus, Streptococcus do grupo A e Haemophilus influenzae.
Identifica-se uma causa bacteriana na generalidade dos casos, embora apenas seja possível isolar o microrganismo em 25-49% dos casos, seja por antibioticoerapia prévia ou pela presença de microrganismos fastidiosos como o Mycoplasma pneumoniae.
A formação do empiema segue três fases distintas:
- Exsudativa: derrame parapneumónico simples, não loculado, com concentrações de glucose e pH normais e contagem celular reduzida; esta fase dura 24 a 72 horas;
- Fibrinopurulenta: derrame pleural loculado pela formação de septos de fibrina, com concentração de glucose e pH reduzidos, e LDH elevada; esta fase dura 7 a 10 dias;
- Organizativa: resulta da organização de fibroblastos na superfície pleural visceral e parietal, resultando em padrão respiratório restritivo; esta fase ocorre 2 a 4 semanas após a formação do empiema.
Exames complementares
A base do diagnóstico assenta na clínica, na imagiologia, na toracocentese e na análise do líquido pleural (LP).
Para a confirmação da existência do derrame pleural já suspeitado clinicamente, é necessária a realização de radiografia de tórax em projecção póstero-anterior, perfil e decúbito lateral do lado do derrame, podendo verificar-se: preenchimento do fundo de saco nos derrames mínimos; hipotransparência da região inferior do pulmão, com apagamento da cúpula diafragmática e do fundo de saco costo-diafragmático, sendo o limite superior desta hipotransparência curvo e oblíquo para cima e para fora (linha de Ellis-Damoiseau), quando o derrame é medianamente abundante; hipotransparência de um hemitórax com desvio do mediastino para o lado oposto e alargamento dos espaços intercostais, no caso de derrame abundante. Na incidência póstero-anterior uma hipotransparência que ocupa entre ¼ e ½ do campo pulmonar é classificada como moderada, e uma hipotransparência que ocupa mais de metade do campo pulmonar é classificada como grande. (Figura 1)
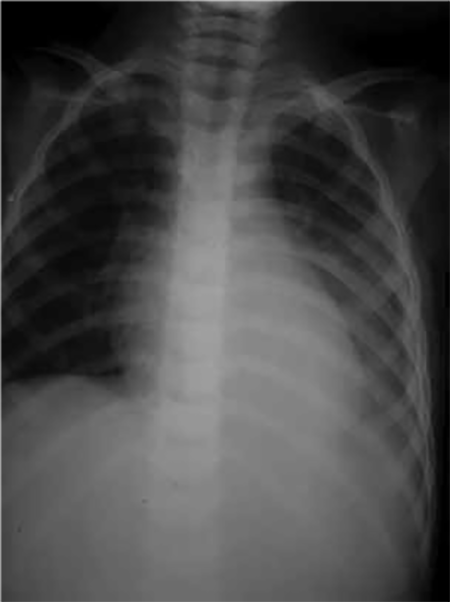
FIGURA 1. Radiografia do tórax PA: sinais de derrame pleural esquerdo (linha de Damoiseau). (NIHDE)
É ainda possível observar pela radiografia sinais de um foco de pneumonia, por vezes mascarado pelo derrame, pneumatocelos, pneumopatia intersticial e adenopatias.
A ecografia torácica completa os dados da radiografia do tórax, sendo de grande utilidade nos casos em que a radiografia identifica sinais de hemitórax opaco. É útil na confirmação da presença de líquido no espaço pleural, determinação da natureza do derrame, quantificação do derrame e identificação de locais ideais para punção para toracocentese ou colocação de drenos torácicos. Pode ainda detectar loculação, fornecendo informações úteis quanto às fases evolutivas do empiema.
A tomografia computorizada diferencia complicações pleurais de processos intraparenquimatosos e tem indicação na falência da aspiração de líquido pleural e falência de tratamento médico.
A toracocentese para análise do líquido pleural é um método seguro e determina a causa do derrame pleural. Quando se detecta pus (empiema) é necessário efectuar drenagem. Em crianças de maior idade o derrame pleural > 1 cm no decúbito lateral é considerado suficiente para tentar a realização de toracocentese.
A cultura do líquido pleural é positiva em 25 a 49% dos casos; técnicas que aumentam a capacidade de detecção de microrganismos incluem a aglutinação por látex to antigénio de S. pneumoniae, a PCR para S. pneumoniae e Streptococcus do grupo A e a detecção de antigénio de Streptococcus do grupo A.
Relativamente ao estudo das células, são relevantes os seguintes achados: contagem de leucócitos > 50.000/ mm3 são características de derrames parapneumónicos complicados/empiema (embora, numa fase inicial, as contagens possam ser 10.000-50.000/mm3); o predomínio de neutrófilos aponta para derrames parapneumónicos; predomínio de linfócitos para tuberculose, doença do tecido conjuntivo ou infecções fúngicas; predomínio de eosinófilos é a favor de infecções parasitárias.
A análise do LP permite ainda definir o estádio evolutivo do derrame. O metabolismo das bactérias e dos leucócitos no LP resultam numa diminuição do pH e da glucose e a destruição de neutrófilos e fagócitos resultam num aumento da LDH.
Considera-se que o derrame é complicado quando a extensão ultrapassa um hemitórax, o pH é inferior a 7,2, a concentração de glucose é inferior a 40 mg/dL e/ou a cultura é positiva.
A hemocultura deve ser sempre solicitada; é positiva em 10 a 22% dos derrames parapneumónicos complicados se a colheita de sangue for realizada antes do início da antibioticoterapia.
Tratamento
Medidas gerais
O tratamento dos derrames pleurais inclui as seguintes opções, para além das medidas gerais: antibióticos, toracocentese, drenagem pleural com ou sem agente antifibrinolítico, descorticação por toracoscopia vídeo-assistida (VATS), ou por toracotomia aberta.
Na maioria dos doentes com derrame pleural há necessidade de tratamento em regime de internamento, embora os doentes com derrames pequenos e resposta favorável ao tratamento possam ser tratados em regime de ambulatório.
As medidas gerais incluem suprimento adequado de fluidos, electrólitos e calorias, analgesia e utilização de antipiréticos.
A oxigenoterapia depende da observação de sinais de hipoxemia e fadiga muscular, A existência de insuficiência respiratória obriga a considerar a transferência para uma unidade de cuidados intensivos (UCI).
Antibioticoterapia
A presença de derrame pleural parapneumónico não altera a escolha empírica da antibioticoterapia dos doentes com pneumonia. A escolha inicial recai sobre os antibióticos que cubram os agentes patogénicos mais prevalentes de acordo com a idade da criança.
Quando se obtém isolamento do agente etiológico, pode estreitar-se o espectro, com base no resultado da coloração pelo Gram, provas de detecção de antigénios, ou culturas de LP.
Para a antibioticoterapia empírica mais recentemente sugerida para utilização em doentes internados utiliza-se ceftriaxona ou cefotaxima associadas a vancomicina ou clindamicina, se considerarmos a probabilidade de Staphylococcus aureus ou anaeróbios.
A pneumonia causada por estirpes de pneumococo de resistência intermédia à penicilina (CIM=0,1-1 mcg penicilina/mL) responde normalmente a penicilina em altas doses ou a uma cefalosporina de terceira geração. A pneumonia causada por estirpes resistentes (CIM ≥ 2 mcg penicilina/mL) tem resposta a cefalosporinas de 3ª geração e à vancomicina.
O empiema causado por Streptococcus do grupo A pode ser tratado com penicilina durante 10 dias. O empiema causado por Staphylococcus aureus pode ser tratado com penicilina sintética resistente às penicilinases ou com vancomicina com uma duração de, pelo menos, 21 dias. Se a etiologia do empiema for Haemophilus influenzae deve usar-se uma cefalosporina de terceira geração.
Na generalidade dos casos a antibioticoterapia deve durar, pelo menos, 10 dias após desaparecimento da febre. O tratamento pode ser completado por via oral, em regime de ambulatório, quando o doente se encontrar há 2-5 dias sem febre e sem dreno torácico.
Salienta-se que, de um modo geral, se aplicam neste âmbito as noções descritas a propósito da pneumonia.
Drenagem
Se a extensão da hipotransparência correspondente a derrame ocupar mais de 1 cm na radiografia em decúbito lateral é necessária realização de ecografia torácica, para determinar se o derrame é simples ou loculado.
No caso dos derrames simples pode ser efectuada uma drenagem inicial de 10-20 mL/kg seguida de antibioticoterapia intravenosa e, no caso de ausência de apirexia ao fim de 48 horas, será necessária inserção de dreno torácico. A inserção inicial de dreno torácico deve ocorrer nos casos em que existem sinais de dificuldade respiratória e nos derrames grandes.
No caso dos derrames complicados (loculados ou com características macroscópicas ou citoquímicas sugestivas de empiema) o tratamento passa pela fibrinólise com colocação de dreno torácico ou drenagem cirúrgica. O cateter deverá ter o maior diâmetro interno possível para drenar com maior facilidade áreas loculadas, sendo que poderá ser necessário colocar mais do que um dreno. As múltiplas toracocenteses evacuadoras deverão ser evitadas.
A resposta à drenagem deve ser monitorizada pela quantidade de LP que sai e pela temperatura corporal. Se o débito do LP for inferior a 10-15 mL/dia e houver melhoria clínica, deve retirar-se o cateter. A duração média da drenagem é de 5 a 10 dias. A drenagem máxima deverá ser de 500 mL/hora e o dreno deverá ser clampado se a drenagem exceder 10 mL/kg em uma hora.
Se se verificar manutenção do quadro febril e reacumulação de LP com sinais de dificuldade respiratória para além das 72 horas após o início de antibioticoterapia e toracostomia, está indicada a descorticação cirúrgica. Ressecam-se, deste modo, as aderências pleurais, o que contribuirá para uma drenagem efectiva do espaço pleural, encurtando a permanência no hospital.
A descorticação por toracotomia aberta está indicada nos casos em que haja formação de uma camada fibrosa que reduz a expansão pulmonar. Trata-se de uma técnica cirúrgica para remoção do tecido fibrinoso nos casos de empiema organizado ou fibrinopurulento que não respondam adequadamente aos procedimentos anteriormente descritos.
Agentes fibrinolíticos
A utilização de agentes fibrinolíticos para desfazer as aderências fibrosas nos derrames loculados está amplamente suportada pela literatura tanto nos adultos como nas crianças, embora não existam dados que fundamentem a utilização de uroquinase, alteplase ou estreptoquinase.
A utilização destes agentes está contraindicada em casos de fístula broncopleural ou evidência de ar ectópico pelo risco de fenómenos de anafilaxia ou hemorragia intrapleural.
Prognóstico
Os derrames pleurais parapneumónicos não complicados respondem à terapêutica conservadora com internamento hospitalar, em geral num período não superior a uma semana. Quando é necessário recorrer à drenagem, a duração média do internamento aumenta para duas semanas.
O seguimento a longo prazo revelou que menos de 10% das crianças têm sintomas residuais.
A mortalidade é de 3,3%, sendo superior em idades inferiores a 2 anos e em crianças com patologia pulmonar subjacente.
Prevenção
Quanto à prevenção volta a referir-se o que foi dito no capítulo das pneumonias. Efectivamente, a imunização sistemática na idade pediátrica permitiu tornar rara a pneumonia por Haemophilus influenzae, assim como as suas possíveis complicações.
A utilização da vacina anti-pneumocócica abrangendo 13 serótipos foi determinante no sentido de redução da prevalência da doença invasiva pneumocócica.
A vacinação contra o vírus da gripe permite evitar as respectivas complicações da gripe, designadamente infecções bacterianas das vias respiratórias inferiores.
A prevenção das complicações do derrame pleural diz respeito essencialmente à sua detecção precoce, e a medidas terapêuticas atempadas e correctas, de acordo com o que se referiu anteriormente.
GLOSSÁRIO
Derrame parapneumónico > derrame pleural associado a pneumonia que, numa fase inicial, é simples (i.e. sem septações/loculações) e estéril.
Empiema > presença de bactérias detectadas pela coloração de Gram ou líquido francamente purulento na cavidade pleural.
BIBLIOGRAFIA
Goldman L, Schafer AI (eds). Goldman-Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Jaffé A, Balfour-Lynn IM. Management of empyema in children. Pediatr Pulmonol 2005; 40:148-151
Mani CS, Murray DL. Acute pneumonia and its complications. In: Principles and Practice of Pediatric Infectious Diseases. Long SS, Pickering LK, Prober CG. (eds), Edinburgh: Elsevier Saunders, 2012
Osowicki J, Steer AC. International survey of paediatric infectious diseases consultants on the management of community-acquired pneumonia complicated by pleural empyema. J Paediatr Child Health 2019; 55: 66-73
Wheeler JG, Jacobs RF. Pleural effusions and empyema. In: Textbook of Pediatric Infectious Diseases. Feigin RD, Cherry JD, Demmler-Harrison GJ, Kaplan SL (eds). Philadelphia: Saunders, 2009
Wilmott R, Bush A, Deterding R, Ratjen F, Sly P, Zar H, Li A (eds). Kendig’s Disorders of the Respiratory Tract in Children. Philadelphia: Elsevier, 2019
The Rubik’s Cube is the perfect gift for any occasion. The famous 3D puzzle can easily be solved with the online solver, there’s no need to memorize algorithms.