Definição e importância do problema
A asma é uma doença heterogénea geralmente caracterizada pela existência de inflamação crónica das vias aéreas, sendo definida por uma história de sintomas respiratórios, como tosse, sibilância / pieira, dispneia e opressão torácica, que variam ao longo do tempo e em intensidade, em conjunto com uma limitação variável do fluxo aéreo expiratório. O cansaço, em repouso ou com o esforço, é igualmente um sintoma muito referido pelos asmáticos de todos os grupos etários.
Esta doença afecta cerca de 10% da população mundial, representando um importante problema de Saúde Pública, quer pela sua prevalência e gravidade, quer pelos custos sociais e económicos que acarreta. Associa-se ainda a outras doenças alérgicas, como a rinite alérgica e a dermatite atópica.
O impacte da doença na qualidade de vida das crianças é considerável, devido a todas as restrições físicas, emocionais e sociais que muitas vezes lhe estão associadas. Importa então conseguir um controlo mantido da doença a um custo sustentável, minimizando o seu efeito nas actividades quotidianas.
Os custos directos relacionados com o tratamento farmacológico, representam apenas uma pequena percentagem dos custos globais da doença, estes muito mais afectados pelos episódios de agudização, pelos internamentos, pelo absentismo escolar e laboral, bem como pela mortalidade associada. Os países desenvolvidos despendem com a asma até 2% das suas despesas em saúde. Mas os custos da doença não controlada são sempre superiores pelo que importa investir em medidas de prevenção.
No nosso país a abordagem da asma, particularmente nos seus aspectos relacionados com a monitorização e tratamento que permitem alcançar o controlo, é regulada pela Norma de Orientação Clínica: Monitorização e Tratamento Para o Controlo da Asma na Criança, no Adolescente e no Adulto (Direcção Geral da Saúde e Ordem dos Médicos).
Etiopatogénese
A asma é uma doença inflamatória crónica complexa, envolvendo múltiplas células (linfócitos, mastócitos, eosinófilos, entre outras) e mediadores celulares. As alterações inflamatórias presentes conduzem ao edema, à hipersecreção de muco, ao aumento da contractilidade das vias aéreas, à obstrução brônquica e à hiperreactividade ou hipersusceptibilidade das vias aéreas, quer a factores específicos (ex. alergénios), quer a inespecíficos (por ex. vírus, poluentes), levando ao aparecimento dos sinais e sintomas característicos. As consequências a longo prazo podem levar à obstrução fixa das vias aéreas e a outros fenómenos da remodelação, correspondente à cicatrização da inflamação crónica.
É esta uma doença multifactorial, dependente da interacção entre factores genéticos e ambientais, iniciando-se as manifestações clínicas na idade pediátrica na maioria dos casos. O aumento recente na prevalência e gravidade das doenças alérgicas em geral e particularmente da asma brônquica na criança, não poderá ser explicado apenas por factores genéticos. Reforça-se assim o papel do ambiente, nas suas componentes do interior e do exterior dos edifícios (Figura 1); por outro lado, diferentes prevalências em populações submetidas a condições ambientais semelhantes realçam a importância dos factores genéticos.
FIGURA 1. A transmissão genética da predisposição para asma, hiperreactividade brônquica e atopia ocorre de modo independente; chama-se a atenção para a influência ambiental marcada
História natural e factores de risco
A história natural da asma em idade pediátrica é uma preocupação significativa, quer para a família das crianças atingidas, quer para os próprios clínicos que as seguem: Passará a doença com a idade? Agravar-se-á? Melhorará? Qual será o efeito do tratamento? Poderão existir alterações irreversíveis da função respiratória em idade precoce?
Estas questões frequentemente formuladas, ficam habitualmente por responder, até porque continua a existir uma atitude pouco esclarecida na abordagem da doença asmática neste grupo etário, associando-a quase invariavelmente a um bom prognóstico clínico, o que frequentemente não se verifica, a curto e a longo prazo. A revisão de vários estudos prospectivos demonstra que os sintomas tendem a persistir durante a vida, particularmente quando está subjacente uma inflamação alérgica das vias aéreas, típica da asma pediátrica, apesar de serem previsíveis períodos assintomáticos de duração variável.
A taxa de internamento por esta doença nas últimas décadas tem-se mantido estável, continuando a atingir maioritariamente a idade pediátrica. Dados recentes mostram que no nosso país mais de metade dos internamentos por asma corresponde a casos pediátricos e que cerca de um terço das crianças asmáticas tem pelo menos um internamento devido à sua doença, situação que devemos considerar intolerável.
A assistência a crianças com doença grave em consultas diferenciadas, particularmente se já sujeitas a internamento ou a múltiplos recursos a serviços de urgência, justifica uma referenciação atempada. E existem experiências muito positivas que demonstram que é possível minimizar o número de internamentos quando se cumprem algumas condições, tal como aconteceu no Hospital de Dona Estefânia como demonstram os resultados alcançados: reduziu-se para 10% o número de internamentos no intervalo duma década: 1º) por existência de um protocolo para o tratamento das agudizações com recurso a broncodilatadores inalados e a corticóides sistémicos; 2º) por referência sistemática dos casos de mais difícil controlo observados nos serviços de urgência para consulta especializada e, finalmente; 3º) após a avaliação clínica em consulta, para além da programação de medidas de controlo ambiental, instituição precoce de terapêutica anti-inflamatória de controlo, nomeadamente com recurso a corticóides inalados e planeamento do tratamento da agudização asmática.
A existência de inflamação nas vias aéreas da criança asmática desde a idade pré-escolar leva a considerar a existência precoce de remodelação das vias aéreas, transversal a todo o espectro de gravidade, constituindo argumentos a favor do desenvolvimento de sequelas respiratórias e indicando uma terapêutica anti-inflamatória; efectivamente tem sido demonstrado que, mesmo em lactentes asmáticos não tratados, a função respiratória degrada-se, confirmando que a inflamação crónica é prejudicial desde os primeiros anos de vida.
Para além das influências genéticas, a epidemia de doença alérgica ocorrida nas últimas décadas, como é o caso da asma, da rinite alérgica, da dermatite atópica ou da alergia alimentar, o aumento recente da incidência das doenças auto-imunes, como é o caso da artrite reumatóide ou da diabetes, a eclosão de doenças inflamatórias intestinais, nomeadamente da doença de Crohn ou da colite ulcerosa, são algumas das doenças crónicas em que a modificação ou desequilíbrio do microbioma, directa ou indirectamente, está envolvido. Nas situações de obesidade, para citar outra patologia emergente, a composição da microbiota, nomeadamente intestinal, está significativamente alterada. E é bem sabida a relação entre obesidade e asma embora também se faça recentemente a reflexão sobre a ocorrência de uma taxa considerável de sobrediagnóstico de asma entre crianças com excesso de peso / obesas.
Como condicionantes do aumento de prevalência da asma brônquica, particularmente em idade pediátrica, estão bem documentados os efeitos de alguns alergénios (por ex. ácaros, pólenes), dos poluentes (por ex. tabagismo) e das infecções (por ex. redução de infestações parasitárias e de algumas infecções bacterianas), bem como dos factores socioeconómicos e genéticos. Estudos recentes têm identificado múltiplos genes associados à asma ou ao fenótipo atópico (por ex. IL4, IL13, CD14, ADRB2, HLA-DRB1, HLA-DQB1, TNF-LTA, FCERIB, IL4R, ADAM33, STAT6, GSDML) influenciando, quer a incidência da doença, quer as suas características clínicas.
Entre os factores de risco que têm sido identificados para a expressão da doença asmática na criança, alguns serão assim dificilmente susceptíveis de prevenção, nomeadamente os genéticos, contrastando com os ambientais (por ex. exposição alergénica, tabagismo e outros poluentes, infecções víricas, regime alimentar, obesidade, sedentarismo), de cuja modulação podem ser esperados ganhos significativos nomeadamente em termos de gravidade.
Mas é esta uma área em que o conhecimento evolui constantemente, e em que resultados controversos são encontrados. Como exemplo, podemos citar os resultados contraditórios que têm sido encontrados entre o aumento do risco de asma em filhos de gestantes com deficiência de vitamina D; de acordo com estudos aleatorizados e controlados recentes, não existe actualmente evidência científica que permita suportar a suplementação com vitamina D como forma de prevenir ou melhorar o controlo da asma pediátrica, nomeadamente reduzindo as agudizações.
Critérios de gravidade e classificação
Na classificação da gravidade devemos considerar diferentes níveis que se relacionam com os degraus terapêuticos que permitem obter o seu controlo. Ou seja, será esta uma classificação baseada nos sintomas e no resultado da avaliação funcional respiratória (espirometria), que habitualmente será efectuada retrospectivamente, embora possa ter a sua aplicação, quer em estudos clínicos, quer em rastreios epidemiológicos. Em centros diferenciados é possível determinar a fracção do óxido nítrico exalado (FENO), marcador da inflamação eosinófilica, que pode contribuir para aferir do efeito da medicação instituída; no entanto, a sobreposição e a variabilidade de resultados e a falta de limiares de positividade bem estabelecidos leva a que estas medições não estejam ainda suficientemente validadas e logo recomendadas em idade pediátrica.
A asma ligeira será a que corresponde ao indivíduo que apresenta sintomas ocasionais, não diários, ou sintomas nocturnos >2 vezes/mês mas <1 vez/semana e cuja função pulmonar (volume expiratório máximo no 1º segundo – FEV1) apresenta valores superiores a 80% do valor teórico previsto, correspondendo aos degrau 1 e 2 do tratamento; asma moderada, descreve-se quando os sintomas são diários, afectando a actividade diária, ou sintomas nocturnos >1 vez/semana, ou estando a função respiratória entre 60 e 80% do valor teórico previsto, e que corresponde ao degrau 3 do tratamento; asma grave, com sintomas contínuos e actividade física muito limitada, sendo os sintomas nocturnos também muito frequentes, encontrando-se a função respiratória com valores inferiores a 60% do previsto, sendo necessária a instituição de medicação dos degraus 4 e 5.
É de referir que a existência de, pelo menos, um critério de gravidade (sintomas diurnos, nocturnos ou função pulmonar) coloca o asmático nesse patamar de gravidade. No caso de existirem agudizações graves, mesmo que pouco frequentes, deverá ser a criança classificada como tendo o equivalente a uma asma persistente moderada, correspondendo à instituição de medicação de controlo do degrau 3.
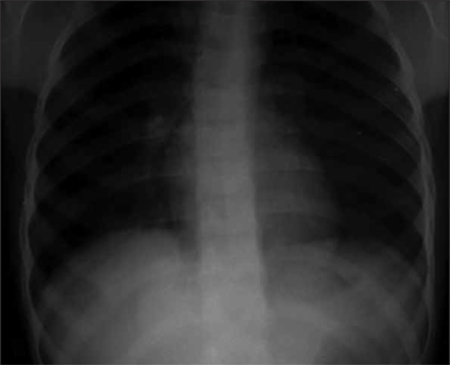
FIGURA 2. Padrão radiográfico do tórax (PA) de asma com enfisema (NIHDE)
Quanto à classificação dos episódios agudos de asma, caracteriza a crise ligeira a existência de tosse e pieira audível, mas sem diminuição da actividade física, sem aumento da frequência respiratória, sem cianose, permitindo pronunciar frases extensas e não interferindo na actividade escolar; função respiratória dentro da normalidade; melhoria espontânea ou com doses habituais de β2-agonistas; na crise moderada evidencia-se o uso dos músculos acessórios, um aumento da frequência respiratória, uma restrição da marcha, apenas permitindo pronunciar até cerca de 5 palavras seguidas; interferindo na frequência escolar; necessitando de maiores doses de β2-agonistas e, com frequência, também de corticóides orais; na crise grave a cianose está presente, tal como dificuldade respiratória marcada, por vezes já sem sibilos audíveis, só permitindo pronunciar até 3 palavras; existe incapacidade na marcha, com resposta débil aos β2-agonistas; é necessária a monitorização da saturação em oxigénio e oxigenoterapia, implicando cuidados hospitalares urgentes / emergentes.
A Figura 2 mostra uma radiografia do tórax (póstero-anterior) de uma criança de 8 anos com uma crise de asma: sinais de hiperinsuflação pulmonar, horizontalização das costelas, abaixamento do diafragma e acentuação do retículo peribrônquico.
Controlo da asma
A asma quando não está controlada perturba muito a qualidade de vida, quer da criança, quer dos seus cuidadores. Falta de controlo significa passar mal durante o dia e/ou dormir mal, não ter uma actividade física normal, necessitar regularmente de medicação de alívio, ter crises de dispneia, necessitar de recorrer a serviços de urgência ou a consultas não planeadas ou ficar internado.
Actualmente, a abordagem a longo prazo da asma deslocou-se da estimava da gravidade da asma, para a avaliação do controlo dos sintomas (Quadro 1), apostando em assegurar que o asmático, de todos os grupos etários, pode ter uma vida normal que não é influenciada pela doença. Compete ao clínico, em parceria com a criança e os seus cuidadores, definir a abordagem que permita alcançar o controlo total da doença, bem como a avaliação e redução do risco futuro relacionado com o prognóstico, dependente do risco de agudizações, da obstrução das vias aéreas e dos efeitos secundários potenciais das medicações (Quadro 2).
De acordo com os sintomas antes do tratamento, que classifica a gravidade da doença tal como foi referido, assim será definido o degrau terapêutico a instituir (Quadros 3, 4 e 5).
QUADRO 1 – Níveis de controlo dos sintomas de asma (adaptado de GINA / NOC 065/2011, revisão 2016). Qualquer agudização exige reavaliação do tratamento de controlo; por definição, uma agudização, em qualquer semana, identifica asma não controlada
| Crianças, adolescentes e adultos | |||||||||||||||||||||
| |||||||||||||||||||||
QUADRO 2 – Avaliação do risco futuro em crianças e adolescentes com diagnóstico de asma (adaptado de GINA / NOC 065/2011, revisão 2016)
| – Avaliação dos factores de risco à data do diagnóstico e periodicamente, particularmente asmáticos com agudizações recentes. – Avaliação da função pulmonar, nomeadamente por espirometria, de acordo com as especificidades etárias no início do tratamento e periodicamente para monitorização e avaliação do risco futuro. |
| Factores de risco para agudizações |
| Sintomas de asma não controlada Pelo menos uma agudização grave no último ano Início habitual das agudizações de forma sazonal (outono/inverno/primavera) Uso excessivo de beta-2 agonistas de acção curta (numa base quase diária) Terapêutica inadequada com corticóide inalado: não prescrito, adesão deficiente, técnica inalatória incorrecta Redução do FEV1 particularmente se < 60% do valor teórico previsto Factores psicológicos ou socioeconómicos major (do asmático, da família / cuidadores) Exposição: tabaco, aeroalergénios, outros poluentes ou irritantes inalatórios, particularmente quando coincidente com infecção viral Comorbilidades: obesidade, doença do refluxo gastresofágico, rinite / rinossinusite, dermatite atópica, alergia alimentar, anafilaxia, síndroma de apneia obstrutiva do sono, insuficiência cardíaca, tromboembolismo pulmonar Eosinofilia sanguínea ou na expectoração Gravidez (em especial na adolescente) Internamente anterior com ou sem ventilação mecânica |
| Factores de risco para desenvolvimento de obstrução brônquica fixa |
| Ausência de tratamento com corticóide inalado Exposição: tabaco (activo/passivo), poluentes químicos Redução do FEV1 inicial, grande variabilidade de FEV1 Broncorreia, eosinofilia sanguínea ou na expectoração Internamentos por asma História pregressa de bronquiolite grave, agudizações frequentes, parto pré-termo, baixo peso ao nascer |
| Factores de risco dependentes de efeitos adversos da terapêutica farmacológica |
| Sistémicos: ciclos frequentes de corticóides orais; duração prolongada de corticóides inalados em doses elevadas; terapêutica concomitante com inibidores do citocromo P450 Locais: corticóide inalado em altas doses; técnica inalatória deficiente; deficiente protecção da pele ou mucosa ocular quando utilizado corticóide inalado com câmara expansora com máscara facial. |
QUADRO 3 – Recomendações para tratamento inicial de controlo em crianças e adolescentes (adaptado de GINA / NOC 065/2011, revisão 2016)
| Sintomas e factores de risco na apresentação | Degraus terapêuticos iniciais indicados |
| Sintomas pouco frequentes (sintomas ou uso de terapêutica de alívio <2/mês e sem sintomas nocturnos nas últimas 4 semanas); ausência de factores de risco para agudizações e sem agudizações no último ano | Degrau 1 |
| Sintomas pouco frequentes, mas um ou mais factores de risco para agudizações | Degrau 2 |
| Sintomas frequentes (sintomas ou uso de terapêutica de alívio 2 ou mais vezes/mês e/ou sintomas nocturnos nas últimas 4 semanas) | Degrau 2 ou 3, consoante presença de sintomas nocturnos e/ou factores de risco para agudizações |
| Sintomas ou agudizações frequentes | Tratamento de agudização e terapêutica de controlo em Degrau 3 a 5 |
QUADRO 4 – Terapêutica por degraus para controlo da asma de crianças com 6 anos ou mais, adolescentes ou adultos
| Degrau | 1ª linha tratamento controlo | Outras opções (por ordem de custo/efectividade) |
Legenda: Ø, nenhuma. CI, corticóide inalado. LABA, agonista-β2 inalado de acção longa. LAMA, anticolinérgico de acção longa. | ||
| Degrau 1: | Ø | Ø |
| Degrau 2: | CI dose baixa | Antileucotrieno |
| Degrau 3: | CI dose baixa + LABA | – CI dose média – CI dose baixa + antileucotrieno – CI dose baixa + metilxantina (≥12 anos) |
| Degrau 4: | CI dose média/alta + LABA | – CI dose alta + antileucotrieno – Adicionar LAMA (≥12 anos) – CI dose alta + metilxantina (≥12 anos) |
| Degrau 5: | Considerar acrescentar: – LAMA (≥12 anos) – Omalizumab (anti-IgE) (asma alérgica grave, ≥6 anos) – Mepalizumab (anti-IL5) (asma eosinofílica grave, ≥12 anos) – Corticóide oral dose baixa | – CI dose alta + antileucotrieno – Adicionar LAMA (≥12 anos) – CI dose alta + metilxantina (≥12 anos) |
Em todos os degraus: · Medicação de alívio: 1º linha – β2-agonista– inalado de acção curta quando necessário, incluindo pré-exercício se broncoconstrição induzida pelo exercício. · Uma vez atingido o controlo e mantido por pelo menos 3 meses, deve ser tentada uma redução gradual da terapêutica, procurando-se assim identificar a terapêutica mínima que é capaz de controlar o asmático. | ||
QUADRO 5 – Terapêutica por degraus para controlo da asma de crianças menos de 6 anos
| Degrau | 1ª linha tratamento controlo | Outras opções (por ordem de custo/eficácia) |
Legenda: Ø. nenhuma. CI, corticóide inalado. LABA, agonista-β2 inalado de acção longa. | ||
| Degrau 1: | Ø | Ø |
| Degrau 2: | CI dose baixa | Antileucotrieno |
| Degrau 3: | CI dose média | – CI dose baixa + antileucotrieno – CI dose baixa + LABA (atenção idade de aprovação) |
| Degraus 4/5: | Aumentar dose de CI para controlo Doses adicionais CI durante agudizações Acrescentar antileucotrieno CI + LABA (atenção idade aprovação) Corticóide oral dose baixa | |
| Degrau 5: | Considerar acrescentar: – LAMA (≥12 anos) – Omalizumab (anti-IgE) (asma alérgica grave, ≥6 anos) – Mepalizumab (anti-IL5) (asma eosinofílica grave, ≥12 anos) – Corticóide oral dose baixa | |
Em todos os degraus: · Medicação de alívio: 1ª linha – β2-agonista inalado de acção curta quando necessário. | ||
Do diagnóstico ao tratamento de controlo
- Episódios de tosse, pieira e dificuldade respiratória são muito frequentes na criança desde os primeiros anos de vida. E se estas são manifestações que identificam doenças infecciosas agudas, como é o caso da bronquiolite vírica, são também características de patologias crónicas, como é o caso da asma. Um episódio de bronquiolite surgirá em proporções podendo atingir até 50% das crianças até aos 3 anos de idade, e episódios repetidos de sibilância irão ocorrer em cerca de 25% dos indivíduos do mesmo grupo etário. E se os episódios de dificuldade respiratória se repetem, sempre considerado o diagnóstico diferencial, será pertinente admitir que podemos estar perante fenótipos de asma, pois esta é uma doença heterogénea desde a primeira infância, com várias apresentações e evoluções (Quadro 6).
Fenótipos clássicos da síndroma asmática precoce na criança são:
- A sibilância transitória (que corresponde a cerca de metade destas crianças, em que os sintomas são transitórios e desaparecem antes da idade escolar, sendo sobretudo crianças prematuras, filhos de pais fumadores e sem atopia);
- A sibilância persistente não atópica (em 20% dos casos, os sintomas persistem até à adolescência e estes casos não têm habitualmente atopia, associando-se a um bom prognóstico clínico e funcional); e, finalmente,
- A sibilância persistente atópica (as crianças deste grupo têm atopia e irão na sua maioria manter os sintomas até à adolescência, continuando pela vida adulta, podendo ter um prognóstico desfavorável pelo risco de perda de função pulmonar).
QUADRO 6 – Probabilidade do diagnóstico de asma na criança em idade pré-escolar com sibilância recorrente
| Probabilidade Elevada | Probabilidade Baixa | |
| Características | ||
| Sintomas associados Sintomas recorrentes, com intervalos livres | Sibilância, tosse, dispneia | Tosse isolada |
| Sim | Sintomas agravados à noite, com esforço físico, exposição a alergénios, irritantes, frio, infecções virais | Não ou variável |
| Sim | Sintomas e sinais de eczema e/ou rinite | Não |
| Sim | História de atopia nos familiares directos | Não |
| Sim | Nas agudizações auscultação de sibilos, dispersos, bilaterais | Não |
| Sim pelo menos parcial | Resposta ao tratamento broncodilatador | Não ou variável |
| Não | Sintomas e sinais de doença sistémica | Sim |
| Não | Sintomas e sinais sugestivos de outros diagnósticos | Sim |
- Importa então diagnosticar correcta e precocemente, sendo este um passo essencial para obter o controlo, objectivo último da abordagem da asma. E o tratamento de agudização e, em especial, o de prevenção, pode e deve ser feito em todas as crianças com asma e não há idade mínima para o começar. É a qualidade de vida da criança que está a ser afectada. No início, um tratamento que frequentemente inclui inaladores (sempre com câmaras de expansão na idade pré-escolar) pode ser uma preocupação para os cuidadores. Mas logo nas primeiras semanas já se vê a diferença: as crianças já dormem bem, movimentam-se, brincam e sorriem sem sintomas ou limitações. A asma pode não ser uma doença para toda a vida mas, em cada momento, tem de estar controlada. E é essa a obrigação da equipa de saúde. Ter a competência para, em rede, ajudar o asmático e a sua família a alcançar o controlo desta doença, com uma mortalidade mínima na idade pediátrica, mas que mantém uma morbilidade inaceitável.
- No âmbito da actuação preventiva e terapêutica, importa realçar pontos fundamentais a inquirir e valorizar, nomeadamente na relação entre os sintomas e o diagnóstico:
- Episódios recorrentes de pieira?
- Tosse irritativa nocturna?
- Tosse ou pieira após exercício?
- Tosse, pieira, opressão torácica após exposição a aeroalergénios ou irritantes?
- Doenças respiratórias consideradas pelo paciente “Constipações que descem aos brônquios”?
- Resultado da resposta ao tratamento?
Em relação aos factores de agudização é necessário posicioná-los pela sua frequência: alergénios e infecções respiratórias víricas são responsáveis pela maioria das agudizações asmáticas; exercício, alterações climáticas, poluentes, como é a exposição tabágica, alimentos, aditivos e fármacos são, por ordem decrescente de frequência, factores a ter em conta.
Importa ainda salientar em relação ao início e persistência de sintomas, que a maioria da sibilância recorrente nos primeiros anos de vida é transitória, com bom prognóstico; no entanto, a maioria dos casos de asma grave começa nos primeiros anos de vida.
No que respeita à exposição a alergénios, cabe uma referência especial aos ácaros domésticos: a sensibilização a estes artrópodes de distribuição ubiquitária relaciona-se com os níveis e com a duração da exposição.
A redução da concentração de alergénios, podendo não impedir a sensibilização primária, influencia positivamente a evolução clínica. Para atingir tal objectivo utilizam-se métodos de barreira ou oclusivos – capas de colchão e das almofadas (permeáveis ou impermeáveis), idealmente aplicadas em colchões novos ou recentes, impedindo a colonização). - Para o controlo da maioria das situações clínicas de asma, importa conhecer aspectos relacionados com evicção alergénica e farmacoterapia, englobados num programa educativo e de promoção de saúde que será complexo e condicionado à necessidade de controlo da doença.
Avaliar, ajustar o tratamento (farmacológico e não farmacológico) e rever a resposta, deve ser o ciclo que se aplica e repete em cada consulta e que poderá permitir melhorar os resultados.
Um plano de acção escrito, individualizado, deve ser fornecido na primeira consulta e revisto nas subsequentes, devendo conter informação sobre os medicamentos diários de controlo; os sintomas e sinais sugestivos de agravamento ou perda de controlo; ajuste da terapêutica incluindo medicamentos a utilizar na agudização, definindo claramente quando e como iniciar terapêutica de alívio, nomeadamente com recurso a broncodilatadores de início de acção rápido por via inalatória e corticóides sistémicos; tratamento de comorbilidades que tenham sido identificadas.
Tratamento não farmacológico
Controlo ambiental – evicção alergénica
Se o controlo ambiental para alergénios do exterior dos edifícios se revela difícil (ex. pólenes e fungos atmosféricos), já algumas medidas visando o interior das residências podem ser essenciais:
- Lavagem da roupa da cama, incluindo almofada e edredão (que devem ser sintéticos), idealmente a mais de 55ºC; existem também capas para almofada e edredão, no caso de não ser possível a sua lavagem (essencial).
- Remover peluches da cama / lavagem regular (semanal a mensal), a 60ºC, dos que permanecerem; em alternativa congelar os peluches e lavar a temperaturas inferiores (essencial).
- Remover mobiliário acolchoado e alcatifas, particularmente se antigas, preferindo pavimentos em madeira, sintéticos ou aplicação de alcatifas laváveis; evitar livros no quarto (desejável).
- Aspiração semanal com dispositivo apropriado (aspirador com filtro de alta eficiência – high-efficiency particulate air – HEPA) (desejável).
- Limpar o pó com pano húmido (desejável).
- Redução da humidade relativa – desumidificadores e aumento da ventilação (desejável).
- Acaricidas – pouco relevantes em locais muito infestados, sendo considerado discutível o seu interesse clínico; indicados no pavimento se não é possível retirar alcatifas (desejável).
Animais domésticos ou de companhia – Em crianças com sensibilização clinicamente relevante, a exposição mantida associa-se a maior gravidade e, a exposição aguda, relaciona-se com agudizações.
- Medidas: Não ter animais de companhia ou retirá-los da residência (eficácia comprovada); atenção que o contacto também pode ocorrer noutras habitações ou mesmo no ambiente escolar. O benefício pode não ser imediato (níveis de alergénio podem reduzir-se progressivamente até durante 6 meses), mas será tanto mais rápido se associado a outras medidas (aspiração). Nos casos clínicos de sensibilização ao gato, nenhuma outra medida, se o animal estiver presente, poderá influenciar significativamente a exposição alergénica.
Se o animal permanece: Lavagem do(s) animal(is) permitindo reduzir transitoriamente (uma semana) os níveis de alergénios. Filtragem do ar (filtros HEPA ou ionizadores colocados no quarto de dormir). Aspiração regular (aspirador com filtro HEPA). Aplicação de capas no colchão e na almofada. Remoção de reservatórios de alergénios (alcatifas, carpetes, estofos).
Limitar a circulação dos animais nos quartos de dormir; porta do quarto sempre fechada.
Baratas – Factor de risco para a gravidade clínica, incluindo agudizações. Muito difícil a erradicação, particularmente em ambientes urbanos.
- Medidas: Inspecção e identificação dos insectos, permitindo prever locais principais de infestação.
Localização e erradicação de fontes de alimentos e de água.
Insecticidas, permitindo reduzir a população de baratas (exterminação) embora se mantenham os alergénios.
Limpeza da casa, não deixando restos de comida acessíveis, aspiração profunda e lavagem após aplicação das medidas anteriores. Há que ter cuidado com as condutas de lixo.
Fungos – A contaminação é habitualmente efectuada do exterior através das janelas (ex. Alternaria), embora alguns fungos possam ser predominantemente encontrados dentro dos edifícios.
- Medidas: Remover ou lavar materiais contaminados, como tapetes, mobiliário, papel de parede. Aplicação de fungicidas.
Prevenção da contaminação do exterior – fechar janelas; recurso a ar condicionado (caro).
Controle humidade relativa através da utilização de desumidificadores, aumento da ventilação (atenção às cozinhas e salas de banho).
Uso de filtros de alta eficiência – filtração do ar e aspiração (HEPA).
Secar bem as roupas antes de serem guardadas.
Evitar plantas nos quartos de dormir.
Pólenes – Para permitir alguma protecção ou minorar os sintomas.
- Medidas: Reduzir a actividade em ambiente exterior, particularmente em áreas de elevada polinização.
Evitar praticar desportos ao ar livre ou campismo; evitar caminhar em grandes espaços relvados ou cortar relva.
Manter as janelas fechadas quando as contagens de pólenes forem elevadas, particularmente em dias de vento forte, quentes e secos.
Usar filtros de partículas de grande eficácia nos carros e viajar com as janelas fechadas; no caso dos motociclistas, deverão usar capacete integral.
Usar óculos escuros nas actividades no exterior dos edifícios.
Tratamento farmacológico
No tratamento farmacológico, dispomos de vários recursos terapêuticos, que vão dos corticóides inalados e sistémicos, aos agonistas b2-miméticos de curta e longa duração de acção, aos anticolinérgicos, igualmente de curta e longa duração de acção, às metilxantinas e aos antagonistas dos leucotrienos, até vários agentes imunomoduladores.
Nesta secção procede-se à descrição dos principais fármacos utilizados no tratamento da asma e dos diversos esquemas de tratamento de acordo com os quadros clínicos (Quadros 4 e 5).
Fármacos
β2-agonistas:
Os β2-agonistas são os broncodilatadores mais potentes, actuando por estimulação dos receptores β-adrenérgicos. O Quadro 7 descreve os efeitos dos β2-agonistas em diferentes órgãos e sistemas.
QUADRO 7 – Efeitos principais dos β2-agonistas em diferentes órgãos/sistemas
| Tecido | Resposta |
| Vias aéreas | Relaxamento músculo liso – broncodilatação Aumento dos movimentos ciliares Aumento da secreção de muco Inibição da desgranulação mastocitária |
| Coração | Aumento da frequência cardíaca |
| Vasos | Vasodilatação Aumento da permeabilidade vascular |
| Efeitos metabólicos | Gluconeogénese Hipocaliémia Aumento da produção de lactato |
Na prática clínica são utilizados fundamentalmente dois tipos destes agonistas:
- de acção curta, como o salbutamol (albuterol), a terbutalina e o procateral.
Têm um início de acção rápida, em poucos minutos, atingindo o máximo de actividade cerca de 60-90 minutos após administração por via inalatória. Os seus efeitos duram até 4-6 horas, sendo o mais relevante o relaxamento do músculo liso; são o tratamento de primeira linha nas crises de asma/agudizações (Quadro 8).
QUADRO 8 – β2-agonistas
Puff<>insuflação sob pressão ou pressurização; Câmara expansora (ver adiante) | |||
• Broncodilatadores mais potentes, de primeira escolha no serviço de urgência • Via inalatória é a mais eficaz • Início de acção quase imediato • Efeitos secundários mínimos | |||
| Medicamento | Dose | Frequência | Observações |
Salbutamol (sol. respiratória) 1 ml = 0,5 mg | – 0,03ml/kg/dose (0,15 mg/kg) – 0,3 mg/kg/hora, até 30mg/hora | – 20/20 min – Nebulização contínua | – Monitorização dos efeitos secundários |
Salbutamol (+câmara expansora) pMDI: 100 μg /puff | 50 μg/kg/dose (máx. 10 puffs = 1.000 μg). Intervalo de 30 a 60 segundos entre cada puff | 20/20 min | – Limitação da dose pela monitorização dos efeitos secundários |
Procaterol (sol. respiratória) 1 ml = 100 μg | < 20 kg: 0,3 ml > 20 kg: 0,5 ml | 2/2 horas | |
Procaterol (+ câmara expansora) pMDI = 10 μg / puffs | < 12 anos: 1 puffs >12 anos: 2 puffs | 2/2 horas | – Na criança não existem estudos controlados dose/resposta |
- de acção prolongada, como formoterol e o salmeterol com efeito broncodilatador que dura cerca de 12 horas, aprovados para crianças acima dos 4-5 anos. O formoterol tem um ínicio de acção mais rápido (1-3 minutos após inalação) do que o salmeterol (cerca de 10-20 minutos). Ao cabo de 30 minutos a sua acção é comparável à do salbutamol (de curta acção). Recentemente foi disponibilizado o vilanterol, cuja duração de acção é de 24 horas, estando indicado a partir dos 12 anos de idade.
Estes fármacos estão contra-indicados em monoterapia, devendo ser sempre indicados em associações a corticóides, nomeadamente quando a corticoterapia inalada em dose baixa ou média não é suficiente para controlar a doença.
Corticóides:
Os corticóides, inalados ou sistémicos, são complemento essencial para o controlo do processo inflamatório subjacente às agudizações e ao processo inflamatório persistente. O Quadro 9 discrimina os corticóides inalados mais empregues e respectivas doses.
QUADRO 9 – Doses equipotentes estimadas de corticóides inalados
| Fármaco | Dose baixa diária (mcg) | Dose média diária (mcg) | Dose alta diária (mcg) |
| Adolescentes e adultos (≥ 12 anos) | |||
| Beclometasona (pMDI) | 100-200 | >200-400 | >400 |
| Budesonida (inalador pó seco/pMDI) | 200-400 | >400-800 | >800 |
| Fluticasona (propionato) (inalador pó seco/pMDI) | 100-250 | >250-500 | >500 |
| Fluticasona (furoato) (inalador pó seco) | 100 | 200 | |
| Mometasona (inalador pó seco) | 110-220 | >220-440 | >440 |
| Crianças dos 6 aos 11 anos | |||
| Beclometasona (pMDI) | 50-100 | >100-200 | >200 |
| Budesonida (inalador pó seco/pMDI) | 100-200 | >200-400 | >400 |
| Fluticasona (propionato) (inalador pó seco/pMDI) | 100-200 | >200-500 | >500 |
| Mometasona (inalador pó seco) | 110-220 | >220-440 | >440 |
| Crianças até aos 5 anos | |||
| Beclometasona (pMDI) | 100 | 200 | |
| Budesonida (pMDI) | 200 | ||
| Fluticasona (propionato) (pMDI) | 100-125 | 200-250 | |
No Quadro 10 são referidas as doses de metilprednisolona e prednisolona a usar por via sistémica (tratamento de curta duração, nomeadamente durante as agudizações).
QUADRO 10 – Corticosteróides
| • Anti-inflamatórios com papel reconhecido no controlo dos processos fisiopatológicos da asma (↓ morbilidade e mortalidade) • Melhoria da resposta aos agonistas β2 (actuação a nível dos receptores) • Via de administração sistémica • Início de acção em 2 a 8 horas • Efeitos secundários (raros durante cursos terapêuticos curtos até 3 dias) | |||
| Medicamento | Dose | Frequência | Observações |
| Metilprednisolona | 1 a 1,5 mg/kg/dose | Até 4/4 horas | Máximo 48 mg/dose EV ou oral |
| Prednisolona | 2 a 2,5 mg/kg/dose | Até 4/4 horas | Máximo 60 mg/dose EV ou oral |
Anticolinérgicos:
O brometo de ipratrópio, derivado sintético da atropina, é o anticolinérgico de curta acção actualmente mais empregue como broncodilatador. Comparativamente ao salbutamol, o brometo de ipratrópio tem um início de acção mais lento, com efeito máximo cerca de 60 minutos após inalação, durando a sua acção 4-8 horas. O Quadro 11 descreve a posologia (nebulização e pMDI).
Os anticolinérgicos têm a sua indicação em associação aos β2-agonistas nas agudizações moderadas a graves (podendo reduzir a taxa de internamento), ou em alternativa aos últimos se existir intolerância a estes fármacos.
Recentemente passou a estar disponível no tratamento de controlo da asma um anticolinérgio de acção prolongada, o tiotrópio (com dispositivo inalatório que disponibiliza pequenas partículas), com indicação a partir dos 12 anos, em casos de asma com agudizações apesar do tratamento com corticóides inalados e broncodilatadores β2-agonistas de longa acção. A dose é de 5µg/dia, numa toma única diária, estando o seu efeito benéfico relacionado com o facto de ser um antagonista preferencial dos receptores muscarínicos do tipo 3 e por ter uma dissociação lenta desses mesmos receptores.
QUADRO 11 – Brometo de ipratrópio: posologia
| Via | Idade | Frequência | |||
NB: Deve adicionar-se na mesma nebulização com salbutamol; não deve ser utilizado como terapia de 1ª linha isoladamente. | |||||
| Neonatal | 1 mês–2 anos | >2 – 12 anos | >12-18 anos | (nº tomas/dia) | |
| Aerossol (pMDI: 20 ug/puff) | Até 120 microgramas | ||||
| Nebulização (solução:250 ug/2mL) | Igual a < 1 ano | < 1 ano: 125μg ≥ 1 ano: 250μg | < 5 anos: 250μg ≥ 5 anos: 500μg | 500μg | Dose/nebulização (pode ser repetida entre cada 2/2 ou 6/6 horas) |
Xantinas:
As teofilinas são cada vez menos utilizadas, pois a um efeito broncodilatador menos potente, associa-se a probabilidade de ocorrência de efeitos secundários numa percentagem considerável de casos; a sua indicação fica reservada para quando existe insucesso no tratamento com agonistas β2.
Trata-se de fármacos rapidamente absorvidos por via oral, rectal ou parentérica, atingindo níveis séricos máximos cerca de 2 horas após a administração.
A dose recomendada para crianças com mais de 6 meses é 10mg/kg/dia até dose máxima inicial de 300 mg/dia; a dose pode ser aumentada de 3-3 dias até 16 mg/kg/dia (600mg/dia).
A “janela” terapêutica é estreita (5-15mg/ml); obtém-se broncodilatação a partir de concentração sérica de 5mg/ml.
Antagonistas dos receptores dos leucotrienos:
Para além de algum efeito broncodilatador, aditivo ao dos β2-agonistas, estes fármacos têm acção anti-inflamatória.
Em Portugal estão comercializados: montelucaste para crianças com idade superior a 6 meses (4mg/dia entre os 6 meses e os 5 anos e 5mg/dia para >5 anos) em dose única diária, oral, podendo ser administrado às refeições; zafirlucaste para > 12 anos em 2 doses diárias de 20mg por via oral.
Terapias biológicas com recurso a anticorpos monoclonais:
Estes tratamentos biológicos estão indicados no tratamento da asma alérgica grave, a partir dos 6 anos de idade (omalizumab) e na asma eosinofílica grave, a partir dos 12 anos de idade, estando a sua utilização reservada a centros hospitalares especializados, esgotados outros recursos terapêuticos de controlo.
Esquemas de tratamento
Para melhor compreensão do enquadramento dos fármacos (associados a outros procedimentos) no tratamento da asma, são consideradas duas situações:
- A agudização de asma como situação urgente ou emergente recorrendo-se ao serviço de urgência hospitalar.
- Actuação em regime ambulatório ou no domicílio (controlo a longo prazo).
A) Agudização de asma
Os Quadros 12, 13 e 14 esquematizam a actuação inicial perante respectivamente, agudização ligeira a moderada, grave e emergente.
QUADRO 12 – Agudização de asma ligeira a moderada
| • Salbutamol nebulizado ou em pMDI até 3 doses na 1ª hora • Oxigenoterapia para manter saturação em O2 > 95% • Corticóide sistémico oral se tiver havido administração recente de corticóide oral |
QUADRO 13 – Agudização de asma grave
| • Salbutamol e brometo de ipratrópio nebulizados ou em pMDI cada 20 minutos ou continuamente durante a 1ª hora • Oxigenoterapia para manter saturação em O2 > 95% • Corticóide sistémico oral |
QUADRO 14 – Agudização emergente
| • Entubação traqueal e ventilação mecânica com FiO2 a 100% • Salbutamol e brometo de ipratrópio nebulizados • Corticóide sistémico por via IV • Eventuais terapêuticas adjuvantes • Internamento em UCI |
Excluindo os casos que requerem terapia intensiva e reportando-nos apenas às formas de agudização moderada ou grave, os Quadros 15 e 16 sintetizam os passos seguintes, o que pressupõe reavaliação clínica, verificação da saturação em O2, e eventualmente outros exames, cerca de 1 hora após a terapêutica descrita anteriormente.
Mantendo-se os sintomas e sinais de agudização moderada, seguir-se-á o protocolo que integra o Quadro 15.
Ao cabo de 1-3 horas (Quadros 15 e 16) e ponderando cada caso de modo individualizado tendo em conta a verificação, ou não, de factores de risco (Quadro 17), o clínico poderá deparar essencialmente com três situações:
- Boa resposta mantida (durante pelo menos 1 hora) após o último tratamento, traduzindo-se por ausência de dificuldade respiratória e bom estado geral. Em tal caso o doente poderá ter alta para o domicílio continuando tratamento com salbutamol nebulizado ou em pMDI e ciclo de corticóide oral, sob vigilância médica, com reavaliação ulterior mais pormenorizada dentro de 1-4 semanas.
- Resposta incompleta, não resposta e/ou agravamento com hipercápnia, obnubilação ou estado confusional, implicando internamento hospitalar e eventual terapia em UCI, com execução de medidas terapêuticas descritas nos Quadros 7, 8 ou 10.
QUADRO 15 – Agudização moderada mantida
| • Salbutamol e brometo de ipratrópio nebulizados ou em pMDI cada 60 minutos • Oxigenoterapia • Corticóide sistémico por via oral • Continuação do tratamento durante 1 a 3 horas e eventual decisão de internamento caso não se verifique melhoria após 3-4 horas |
QUADRO 16 – Agudização grave associada a factores de risco (Quadro 17) e ausência de resposta ao tratamento inicial
| • Salbutamol e brometo de ipratrópio nebulizado cada 60 minutos ou continuamente • Oxigenoterapia • Corticóide sistémico por via oral • Eventuais terapêuticas adjuvantes • Continuação do tratamento durante 1 a 3 horas e eventual decisão de internamento caso não se verifique melhoria após 3-4 horas |
QUADRO 17 – Factores de risco/gravidade em contexto de episódio de asma
| • Antecedentes de agudizações graves e súbitas e de internamento em UCI com ventilação mecânica • Dois ou mais internamentos/ano, ou recurso ao SU, ou internamento no mês anterior • Consumo de >2 embalagens/mês de beta-2 agonistas inalados • Utilização, na data da exacerbação, de corticoides sistémicos ou sua interrupção recente • Comorbilidade (por ex. doença cardiovascular, DPOC, etc) • Doença psiquiátrica • Estado de precariedade socioeconómica • Residência em meio urbano • Toxicodependência |
B) Actuação em regime ambulatório ou no domicílio (controlo a longo prazo)
A alta para o domicílio após agudização asmática é uma decisão que deverá ser analisada caso a caso tendo em conta, designadamente, as características do quadro clínico durante o internamento e a existência de eventuais factores de risco. Uma das abordagens habituais de terapêutica a instituir inclui:
- salbutamol associado ao brometo de ipratrópio (idealmente com câmara expansora/pMDI) (Quadros 8 e 11) durante 5-7 dias, e corticóide oral durante 3-5 dias (Quadro 10).
- corticóides inalados (a longo prazo) a iniciar antes da saída do hospital, ou a sua retoma no caso de já constituir rotina no pré-internamento, ponderando-se a correcção de dose e a eventual inclusão de outros fármacos de controlo (Quadros 3 e 4).
NB – Se após 3 meses se obtiver controlo da situação, deverá proceder-se a redução gradual das doses, tentando as doses mínimas eficazes.
Relativamente às xantinas, cabe salientar que a sua utilização diminuiu significativamente, pois o seu efeito broncodilatador é pouco efectivo, não cumpre o objectivo de se obter efeito anti-inflamatório e a ocorrência de efeitos secundários pode ser significativa.
Na abordagem inicial da asma ligeira, pouco sintomática, está largamente demonstrado que o grupo farmacológico que é mais benéfico no controlo clínico e funcional da doença corresponde aos corticóides inalados, sendo recomendados como tratamento de primeira linha em todos os grupos etários (equivalência de doses encontra-se representada no Quadro 9). A utilização de antileucotrienos orais pode também se considerada como opção inicial em monoterapia embora seja de esperar uma percentagem inferior de sucesso terapêutico.
Quando os sintomas não se controlam com doses baixas ou médias de corticóides inalados, tende-se actualmente para uma utilização combinada de fármacos, permitindo um melhor controlo da doença, com a utilização de doses inferiores de corticóides inalados, obtendo-se uma elevada eficácia sem ocorrência de efeitos adversos significativos (Quadros 4 e 5).
Em todos os degraus e grupos etários é fundamental considerar a aplicação de medidas educacionais e a existência de um plano de acção escrito, para além da minimização do efeito de factores de risco susceptíveis de prevenção e controlo de comorbilidades, como é o caso da aplicação de medidas de controlo ambiental (ex. alergénios, tabagismo), bem como aconselhamento sobre dieta e actividade física.
Conhecendo-se actualmente muito da fisiopatologia, será ideal que o tratamento anti-asmático actue sobre todos, ou pelo menos num grande número, dos componentes que estão envolvidos. É esta a base científica para o uso da terapêutica combinada nas formas de asma de mais difícil controlo; os diferentes agentes vão actuar a diferentes níveis, complementando a sua acção.
Se pensarmos em algumas das combinações possíveis na abordagem da criança asmática, devemos tentar posicioná-las de acordo com a gravidade do quadro clínico.
Em conclusão, no tratamento da asma brônquica persistente, quando não se obtém o controlo com monoterapia, nomeadamente com o recurso a corticóides inalados, é preferível usar a combinação de doses baixas de corticosteróide inalado e b2-agonistas de acção prolongada ou antileucotrienos do que aumentar para doses mais elevadas de corticosteróide inalado.
Entre as combinações corticosteróide inalado e b2-agonista de longa acção versus antagonista dos leucotrienos e corticosteróide inalado, a primeira revela-se mais eficaz e de menor custo. A combinação dos broncodilatadores mais efectivos com os anti-inflamatórios de primeira escolha na maioria dos asmáticos (corticóides inalados), resulta claramente numa formulação eficaz em todo o espectro da asma persistente moderada a grave, e ainda nas formas ligeiras quando o componente de esforço se revele significativo. Aspectos como adesão e deposição pulmonar serão determinantes para o efeito sinérgico.
Uma palavra de atenção deve ser dada quanto ao uso da terapêutica combinada no tratamento da asma persistente: falamos do controlo da função respiratória, dos sintomas crónicos e do eventual alívio de alguns sintomas agudos; como foi referido, o tratamento das agudizações asmáticas moderadas a graves, pressupõe o uso de outras abordagens terapêuticas, quer em ambulatório, quer a nível dos serviços de urgência.
Terapêutica inalatória
Constitui actualmente o pilar fundamental no tratamento de várias doenças respiratórias, sendo consensual a escolha da via inalatória como preferencial para administração de fármacos no tratamento da asma. Comparada com a via sistémica, tem uma acção mais rápida utilizando doses menores. Consegue-se efeitos terapêuticos muito significativos com escassos efeitos secundários. No entanto, em idade pediátrica o reduzido calibre da via aérea, os fluxos inspiratórios baixos, a respiração nasal, os volumes correntes pequenos, as frequências respiratórias elevadas e a colaboração, por vezes deficiente, entre muitos outros factores, condicionam frequentemente o sucesso da inaloterapia.
Durante uma agudização de sintomas, para além da idade, pode também estar comprometida a utilização de inaladores que fazem depender a disponibilidade das partículas do débito inspiratório.
Assim, para rendibilizar a extrema rapidez de actuação e a eficácia desta via de administração, particularmente durante a crise, é importante que se respeitem algumas condicionantes relacionadas, quer com a idade da criança, quer com os dispositivos disponíveis.
Idade da criança – nos primeiros dois ou três anos de vida, a terapêutica, broncodilatadora ou anti-inflamatória indicada por via inalatória na agudização, terá de ser efectuada através de nebulizador (pneumático ou ultrassónico) ou, preferencialmente, com aerossol de dose calibrada (pressurized Metered Dose Inhalers – pMDI) associado a câmara de expansão, sempre com o uso de máscara.
A partir do terceiro ano de vida, logo que a colaboração o permita, deverá a inalação ser efectuada com o uso de peça bucal, pois a inalação do fármaco através das cavidades nasais (ou apenas o facto de haver respiração nasal com a utilização de máscara), pode reduzir a dose que chega ao pulmão para menos de metade. Se for possível a colaboração com a peça bucal, há que preferir o uso de câmaras de expansão (nomeadamente a nível dos serviços de urgência e enfermaria).
A partir dos 6 anos, por vezes antes, é já possível a utilização dos inaladores de pó seco, uni ou multidose (Dry Power Inhaler – DPI), para o tratamento dos sintomas. No entanto, em crianças que estão familiarizadas com câmaras de expansão, pode manter-se esta metodologia de administração durante toda a idade escolar, particularmente no domicílio. Nos serviços de urgência hospitalares devem estas crianças efectuar terapêutica com inaladores do tipo pMDI associados a câmaras de expansão com peça bucal.
Tipos de dispositivos para aerossolização – Como foi referido, os aerossóis utilizados na terapêutica da asma são produzidos por três tipos básicos de instrumentos de inalação, nomeadamente os nebulizadores, os pMDI e os DPI.
Os nebulizadores são aparelhos geradores de aerossóis a partir de soluções ou suspensões aquosas.
Embora difíceis de transportar, são muitas vezes úteis quando os outros dispositivos estão indisponíveis e podem transformar em aerossol, virtualmente, qualquer substância líquida. Como foi referido, os nebulizadores podem ser alimentados por ar comprimido, ou ser ultrassónicos; neles deve considerar-se que a dose colocada no dispositivo, aparentemente elevada (carga do nebulizador) sofre perdas a vários níveis, nomeadamente a dose que permanece no nebulizador (“volume morto”- geralmente cerca de 0,5 ml), perdas através do terminal do tubo, impacte de partículas a nível interno e as perdas durante a expiração; nestes aparelhos a geração de partículas não depende dos fluxos inspiratórios. Para os pMDI a energia é dada pelo próprio dispositivo, enquanto para os DPI esta energia tem de ser fornecida pelo doente através de um fluxo inspiratório que retira o pó do dispositivo, tornando problemática a sua utilização em episódios sintomáticos, mesmo em crianças que com eles é realizada a sua terapêutica de controlo.
Na terapêutica da crise de asma nos serviços de urgência devem ser usados sobretudo os pneumáticos, mais baratos e permitindo o uso de um adaptador bucal ou máscara. O nebulizador pneumático pode ser, ou não, reutilizado. Os dispositivos ultrassónicos podem produzir partículas menores, são silenciosos e actualmente bastante portáteis, mas não trazem benefício clínico adicional; têm mesmo um risco acrescido de infecções nosocomiais.
Para nebulização de broncodilatadores podem ser utilizados indistintamente aparelhos pneumáticos ou ultrassónicos (soluções); para a nebulização de corticóides (fluticasona ou budesonido) os únicos aparelhos a utilizar são os pneumáticos (suspensões). Este factor poderá ser muito importante no caso de se recomendar a compra de um aparelho gerador de aerossóis.
O tempo ideal para uma nebulização será de 8 a 10 minutos (factor que condiciona o volume a nebulizar que deve ser colocado no dispositivo, pelo que não podem existir “receitas” universais, por exemplo, do volume de soro fisiológico a adicionar). A frequência das nebulizações poderá ser de 20/20 ou de 30/30 minutos.
A associação do inalador pressurizado com uma câmara de expansão, revela-se como um meio de eleição para a administração de terapêutica, quer na crise, quer como terapêutica de controlo, em idade pré-escolar. Aumenta a deposição no pulmão, diminui a deposição na boca e vias aéreas superiores à custa de uma maior deposição na câmara, sendo uma alternativa portátil à utilização dos nebulizadores, tal como na agudização da criança asmática observada no serviço de urgência. A respiração pode ser feita em volume corrente, durante cerca de 20 a 30 segundos, após cada pressurização (puff).
Nas crises e em ambulatório os DPI são habitualmente indicados nas crianças que já os utilizam quotidianamente (geralmente em crianças com 6 ou mais anos), não devendo ser utilizados a nível dos serviços de saúde no tratamento de crise, levantando óbvios problemas na reutilização (perigo de contaminação).
A principal vantagem em relação aos pMDI consiste no facto de não ser necessária a coordenação mão-pulmão, tornando a técnica mais fácil (embora o uso de pMDI isolados não seja habitualmente recomendada em idade pediátrica; a existência de dispositivos accionados pela manobra inspiratória, do tipo autohaler, ou MDI geradores de nuvens muito suaves, com partículas de pequena dimensão, poderá modificar esta conduta. Exigem uma inspiração forçada para uma boa deposição pulmonar, com um fluxo inspiratório relativamente alto (débito inspiratório superior a 30L/minuto) o que não é possível em crianças muito pequenas. São igualmente portáteis e discretos, não contendo propelentes (podem conter lactose). Permitem também um melhor controlo da quantidade do medicamento gasto e do restante.
Os dispositivos multidose são os mais utilizados por serem mais práticos. Menos usados, os sistemas unidose apresentam o medicamento em forma de pó, contido numa cápsula, que é perfurada ou partida antes da inalação. As principais vantagens em relação aos sistemas multidose serão um melhor controlo da dose, a verificação de que esta foi de facto retirada da cápsula e a possibilidade de repetir a inalação até desaparecimento total do pó. No entanto são menos práticos, e preferidos por uma minoria de doentes.
A adesão à terapêutica é também um problema central, sendo necessário proceder à correcta administração do fármaco prescrito. Esta tarefa é dificultada quando estamos perante crianças difíceis, que choram durante a administração da terapêutica. É fundamental que os profissionais de saúde, os pais e as crianças compreendam a necessidade de utilizarem o fármaco prescrito e que aceitem o uso do dispositivo seleccionado para o efeito. As acções de formação devem ser iniciadas nos profissionais, terminando na própria criança, sempre que o grupo etário o permita.
Em ambulatório ou no serviço de urgência deverá ser efectuado o ensino da utilização dos diversos tipos de inaladores e reavaliada a técnica regularmente.
A escolha do método de inalação constitui uma etapa fundamental do tratamento das doenças respiratórias da criança; o ensino e avaliação da adequação só são possíveis com a colaboração de técnicos treinados e experientes.
Em síntese,
- para o tratamento das crises de asma no serviço de urgência é prática tradicional o recurso aos nebulizadores, de preferência devendo estes ser pneumáticos. O seu uso estendeu-se ao tratamento domiciliário, inclusive comparticipado pelo Serviço Nacional de Saúde;
- numerosos estudos têm vindo a demonstrar que as combinações pMDI / câmara expansora são preferíveis, sendo mais eficazes, mais portáteis e menos dispendiosos.
- deve ser incrementado o uso de câmara expansora nos serviços de urgência, na maioria das crianças com crise de asma, pelo menos como opção aos nebulizadores.
- nalguns lactentes e crianças em idade pré-escolar, a nebulização com máscara pode ser mais bem aceite, particularmente em situações mais graves, em que criança se encontra exausta, por vezes febril, não sendo de esperar então grande colaboração com a técnica requerida para uma câmara expansora (Quadro 18).
QUADRO 18 – Dispositivo inalatório para crianças até 5 anos
| Idade | Dispositivo preferível | Dispositivo em alternativa |
| 0-3 anos | Inaladores pressurizados associados a câmaras expansoras com máscara | Nebulizador com máscara (excepcional) |
| 4-5 anos | Inaladores pressurizados associados a câmaras expansoras com peça bucal | -Inaladores pressurizados associados a câmaras expansoras com máscara -Nebulizador com máscara ou peça bucal (excecional) |
Asma induzida pelo exercício
A asma induzida pelo exercício (AIE), ou que também pode ser referida de um modo mais abrangente como broncoconstrição induzida pelo exercício, define-se como o aumento transitório da resistência das vias aéreas resultante da broncoconstrição que ocorre após esforço físico, inerente a prática desportiva, mas também facilmente desencadeável após situações tão comuns como rir ou chorar.
Os sintomas de AIE, semelhantes aos de outras formas da doença, podem incluir tosse, pieira, dispneia, opressão torácica ou cansaço que surgem durante e principalmente após cessar o exercício; estes sintomas são de curta duração e acompanham-se de hiperinsuflação e hipoxémia arterial. A broncoconstrição máxima ocorre geralmente 3-10 minutos após o esforço físico, sendo habitual uma recuperação espontânea num intervalo de 30-60 minutos.
FIGURA 3. Mecanismos etiopatogénicos na AIE
A prevalência de AIE é variável, podendo ocorrer em até 80% dos doentes asmáticos, em especial na idade pediátrica; é frequentemente causa de queixas e de frustração pelas dificuldades na integração das actividades de grupo, nomeadamente no meio escolar e desportivo.
A gravidade da resposta broncoconstritora ao exercício depende de vários factores, tais como da intensidade do exercício, das condições climáticas e da reactividade basal das vias aéreas. A magnitude da resposta dependerá do grau de controlo da doença, do uso prévio de medicação anti-asmática e do intervalo de tempo que decorreu desde um episódio anterior de broncoconstrição induzida pelo exercício, conceito conhecido como período refractário; em cerca de 50% dos asmáticos a resposta broncoconstritora ao exercício é atenuada se este for repetido em período até 30 minutos. A gravidade da AIE pode também ser indirecta e negativamente influenciada pela exposição a alguns factores, tais como alergénios, poluentes e infecções víricas.
As actividades desportivas consideradas como mais asmogénicas englobam os desportos que exigem altos níveis de ventilação, como a corrida de fundo, o ciclismo, o futebol, o basquetebol e o raguebi, e modalidades praticadas em ambiente frio e seco como vários desportos de Inverno, particularmente o esqui, o hóquei e a patinagem no gelo.
Relativamente à etiopatogénese, os mecanismos pelos quais a AIE ocorre não estão completamente esclarecidos. A desidratação da mucosa brônquica, consequência da hiperventilação que ocorre durante o exercício, constitui a explicação mais aceite. O mecanismo pelo qual esta perda de água pela mucosa desencadeia a broncoconstrição resulta provavelmente de uma conjugação de dois mecanismos anteriormente propostos como distintos: o estímulo térmico; e o estímulo osmótico (Figura 3). Os leucotrienos, potentes mediadores de broncoconstrição libertados por várias células inflamatórias incluindo mastócitos e eosinófilos, têm os seus níveis elevados após broncoconstrição induzida pelo exercício.
O objectivo primordial do tratamento é prevenir ou pelo menos atenuar a resposta broncoconstritora ao exercício de modo a que não constitua restrição à escolha de uma actividade física ou limitação ao nível de desempenho. Para tal, importa em primeiro lugar conseguir o melhor controlo possível da asma.
Medidas não farmacológicas como mudar as condições do ar inalado, quando a actividade ocorre em espaços fechados, evitar fazer exercício em ambientes frios e secos, limitar a exposição a poluentes, têm-se revelado benéficas. É igualmente importante fazer um adequado período de aquecimento antes da realização de esforço físico mais intenso.
Vários fármacos têm sido propostos no controlo da AIE. Na maioria dos casos que têm uma função respiratória basal normal a AIE pode ser prevenida pela administração prévia ao exercício de um agonista b2-adrenérgico por via inalatória (exs. salbutamol ou terbutalina), eficaz em reduzir a AIE em até 90% dos doentes, independentemente da gravidade, podendo também ser usados como medicação em SOS para tratar a broncoconstrição desencadeada pelo esforço. Esta abordagem exige uma atempada previsão das horas de maior esforço, sabendo-se que em idade pediátrica o exercício constitui um acontecimento imprevisível, pelo que se torna mais difícil de controlar a AIE na criança. Os broncodilatadores b2-adrenérgicos de acção prolongada (ex. formoterol, salmeterol e vilanterol) têm então indicação óbvia uma vez que exercem o seu efeito protector de forma mais duradoura, entre de 12 a 24 horas. A associação destes fármacos com corticosteróides inalados é sempre obrigatória. As terapêuticas combinadas num só dispositivo (fluticasona com formoterol, salmeterol ou vilanterol e budesonido com formoterol) simplificam a terapêutica permitindo uma maior adesão.
Os antagonistas dos receptores dos leucotrienos (ex. montelucaste) oferecem em formas ligeiras de asma de esforço, para além da comodidade posológica, protecção efectiva de sintomas ao longo das 24 horas, não parecendo este efeito reduzir-se com a sua toma regular.
Dada a elevada incidência de AIE em atletas de competição, incluindo a nível olímpico, e consequente necessidade de uso de medicação anti-asmática, o Comité Olímpico Internacional (COI) aceita o uso de agonistas b2-adrenérgicos, de curta e longa acção, corticóides por via inalatória e antagonistas dos receptores dos leucotrienos. Para que a medicação anti-asmática prescrita não seja considerada dopante, nomeadamente em competições internacionais, é necessária a comprovação com uma notificação escrita, em impresso próprio fornecido pelo Conselho Nacional Antidopagem (CNAD), acompanhada de relatório médico incluindo resultados de provas funcionais respiratórias, comprovando o diagnóstico de asma e a consequente indicação terapêutica.
BIBLIOGRAFIA
Anderson WC 3rd, Szefler SJ. New and future strategies to improve asthma control in children. J Allergy Clin Immunol 2015;136: 848-59
Bush A, Saglani S. Management of severe asthma in children. Lancet 2010; 376: 814-25
Castro-Rodriguez JA, Rodrigo GJ, Rodriguez-Martinez CE. Principal findings of systematic reviews for chronic treatment in childhood asthma. J Asthma. 2015;52:407-16
Fajt ML, Wenzel SE. Asthma phenotypes and the use of biologic medications in asthma and allergic disease: the next steps toward personalized care. J Allergy Clin Immunol 2015;135: 299-310
Ferreira-Magalhães M, Sá-Sousa A, Morais-Almeida M, et al. High prevalence of hospitalisation for asthma in a population-based paediatric sample. Arch Dis Child 2015;100: 507-508
Global Initiative for Asthma. Global strategy for asthma management and prevention. WHO/NNHLBI Workshop Report, 2016. www.ginasthma.org.
Gomersal T, Harnan S, Essat M, et al. A systematic review of fractional exhaled nitric oxide in the routine management of childhood asthma. Pediatr Pulmonol 2016; 51: 316-328
Martineau AR, Cates CJ, Urashima M, et al. Vitamin D for the management of asthma. Cochrane Database Syst Rev 2016; 9: CD011511
Mokhallati N, Guilbert TW. Moving towards precision care for childhood asthma. Curr Opin Pediatr 2016; 28: 331-338
Muraro A, Lemanske R, Hellings P, et al. Precision medicine in patients with allergic diseases: Airway diseases and atopic dermatitis—PRACTALL document of the European Academy of Allergy and Clinical Immunology and the American Academy of Allergy, Asthma & Immunology. J Allergy Clin Immunol 2016;137:1347-1358
Nadif R. Genetic insights into moderate-to-severe asthma. Lancet Respir Med 2019; 7: 2-3
Nagakumar P, Thomas H. Management of severe asthma in children. Paediatrics and Child Health 2013; 23: 291-295
Norma de Orientação Clínica Nº 065/2011 (revisão 2016): Monitorização e Tratamento Para o Controlo da Asma na Criança, no Adolescente e no Adulto (Direcção Geral da Saúde / Ordem dos Médicos). Lisboa: DGS/OM, 2016
Norma de Orientação Clínica N.º 021/2011: Cuidados Respiratórios Domiciliários: Prescrição de Aerossolterapia” (Direcção Geral da Saúde / Ordem dos Médicos). Lisboa: DGS/OM, 2011
Orientação Nº 10/2013 da Direcção Geral da Saúde: Utilização de Dispositivos Simples em Aerossolterapia.
Pereira AM, Morais-Almeida M, Santos N, et al. Severity of rhinitis and wheezing is strongly associated in preschoolers: A population-based study. Pediatr Allergy Immunol 2015; 26: 618-627
Permaul P, Kanchongkittiphon W, Phipatanakul W. Childhood asthma and obesity–what is the true link? Ann Allergy Asthma Immunol 2014; 113: 244-246
Pité H, Gaspar A, Morais-Almeida M. Preschool-age wheezing phenotypes and asthma persistence in adolescents. Allergy Asthma Proc 2016; 37: 231-241
Pité H, Morais-Almeida M, Mensinga T, et al. Non-invasive biomarkers in asthma: promises and pitfalls. In: Pereira C (ed). Asthma. Rijeka, Croatia: Intech, 2016
Pité H, Morais-Almeida M. Particularidades da terapêutica inalatória na criança. In Cordeiro MC, (ed). Terapêutica Inalatória: Princípios, Técnica de Inalação e Dispositivos Inalatórios. Lisboa: Lusodidacta, 2014;141-156
Rosado Pinto J, Morais-Almeida M (eds). A Criança Asmática no Mundo da Alergia. Lisboa: Euromédice, 2003
Szczepankiewicz D, Sobkowiak P, Narożna B. Leptin gene polymorphism affects leptin level in childhood asthma. World J Pediatr 2018; 14: 601-606
Willis JC, Lord GM. Immune biomarkers: the promises and pitfalls of personalized medicine. Nat Rev Immunol 2015;15: 323-329
Yoseph RB, Livnat G, Schnapp Z, et al. The effect of vitamin D on airway reactivity and inflammation in asthmatic children: a double-blind placebo-controlled trial. Pediatr Pulmonol 2015; 50: 747 – 753