*Revisão de Aguinaldo Cabral
Introdução
A glicose é para as células dos mamíferos a fonte primária de energia, podendo ser armazenada na forma macromolecular como glicogénio para uso ulterior. A galactose e a frutose também constituem fontes de energia, embora em menor grau que a glucose.
Assim, os hidratos de carbono com implicações clínicas mais relevantes nas doenças hereditárias do metabolismo (DHM) compreendem três monossacáridos (glucose, galactose e frutose), três dissacáridos (lactose<>galactose+glucose, isomaltose<>glucose+glucose, e sacarose<>frutose+glucose), e um polissacárido (o já referido glicogénio).
A galactose entra na composição de certos glicolípidos, glicoproteínas e glicosaminoglicanos.
O suprimento contínuo de glucose a partir da alimentação, gluconeogénese e glicogenólise mantém a normalidade do nível de glucose no sangue.
Recorda-se que:
|
As alterações do metabolismo dos hidratos de carbono mais importantes são: os defeitos hereditários do metabolismo da galactose e frutose, defeitos da neoglucogénese, doenças de armazenamento de glicogénio (glicogenoses), defeitos do metabolismo do glicerol, do metabolismo das pentoses, do transporte da glicose, e o hiperinsulinismo congénito.
Neste capítulo são abordadas, pela sua maior frequência, as glicogenoses, a galactosémia e a intolerância hereditária à frutose.
1. GLICOGENOSES
Introdução
As glicogenoses são afecções hereditárias relacionadas com defeitos genéticos originando défice congénito de determinadas enzimas intervindo no metabolismo do glicogénio e caracterizadas pela acumulação do mesmo, de estrutura normal ou anormal (em quantidade e qualidade ou ambas) nas células de diferentes tecidos.
O resultado final das alterações do metabolismo do glicogénio (essencialmente dizendo respeito a glicogénese, glicogenólise e respectiva regulação) é o surgimento de um largo espectro de doenças de grande heterogeneidade genética e clínica.
Tais afecções constituem uma das formas das chamadas doenças de armazenamento (tesaurismoses) – neste caso, do glicogénio, distinguindo-se as formas hepáticas, musculares e generalizadas.
Metabolismo do glicogénio e nosologia
Para a compreensão da patogénese e fisiopatologia das glicogenoses, importa sintetizar alguns tópicos sobre o metabolismo do glicogénio.
A formação do glicogénio ocorre a partir da glicose (glicogénese) em praticamente todos os órgãos e tecidos, mas principalmente no fígado e músculo.
A glicogenólise (no citoplasma e nos lisossomas), processo inverso da glicogénese, consiste na degradação do glicogénio.
A glicose pode sofrer dois diferentes destinos: – ser degradada (glicólise); ou -sair da célula e ser utilizada.
A regulação do metabolismo do glicogénio faz-se essencialmente através de duas enzimas fundamentais: a glicogénio-sintetase e a fosforilase. O AMP cíclico desempenha um papel fundamental na regulação destas enzimas pois, mediando a fosforilação destas enzimas, inibe a sintetase e estimula a fosforilase com consequente glicogenólise.
A regulação do metabolismo do glicogénio do músculo é do tipo hormonal, através da adrenalina e da insulina. Tal regulação ao nível do fígado faz-se através da glucagina (ou glucagom), do cálcio, da insulina e da própria glucose.
Os aspectos fundamentais da síntese e degradação do glicogénio estão resumidos na Figura 1.
Figura 1. Metabolismo do glicogénio.
São conhecidas actualmente mais de 12 glicogenoses que podem ser: predominantemente hepáticas, preferencialmente musculares, ou generalizadas.
As glicogenoses hepáticas compreendem os seguintes tipos: I (Ia e I não a), III, IV, VI, IX, XI e O.
As glicogenoses musculares mais frequentes são tipo V e VII, não esquecendo o envolvimento muscular, por vezes muito relevante, nas glicogenoses III e IX, e na forma juvenil/ adulto da glicogenose tipo II; outras: defeito da fosfogliceratoquinase, fosfogliceratomutase, defeito da desidrogenase láctica, defeito da frutose-1, 6-difosfato aldolase A, defeito da isoforma muscular da piruvatoquinase, e defeito da fosfogluco-isomerase.
A glicogenose generalizada é essencialmente a glicogenose tipo II (doença de Pompe), embora se reconheça carácter sistémico à glicogenose tipo IV.
Glicogenose tipo I
Como foi referido, é uma das mais frequentes glicogenoses (cerca de 1/4 de tais afecções); distinguem-se dois subtipos, resultantes respectivamente:
- do defeito da subunidade catalítica da glucose-6-fosfatase (tipo Ia ou doença de von Gierke); e
- do defeito da translocase da glucose-6-fosfato (tipo I não-a ou tipo Ib).
Quanto às manifestações clínicas em relação com a etiopatogénese, há a salientar: hipoglicémia recorrente (de jejum curto), convulsões por hipoglicémia, hepatomegália, acidose láctica e hiperventilação. Outros sinais frequentes são: baixa estatura, fácies de boneca, obesidade do tronco, abdómen saliente por grande hepatomegália, postura lordótica, musculatura hipotrófica, hipotonia, equimoses e epistaxes. O coração tem tamanho normal e os rins estão simetricamente aumentados. (Figura 2)
O tipo Ib, menos frequente, apresenta ainda: esplenomegália, infecções bacterianas ou fúngicas recorrentes devidas a neutropénia, anomalias fagocitárias e outras anomalias da imunidade. Neste tipo é também frequente a doença inflamatória intestinal (semelhante à doença de Crohn), diarreia prolongada, anemia e artrite ocasional. A morte pode ocorrer por sépsis.
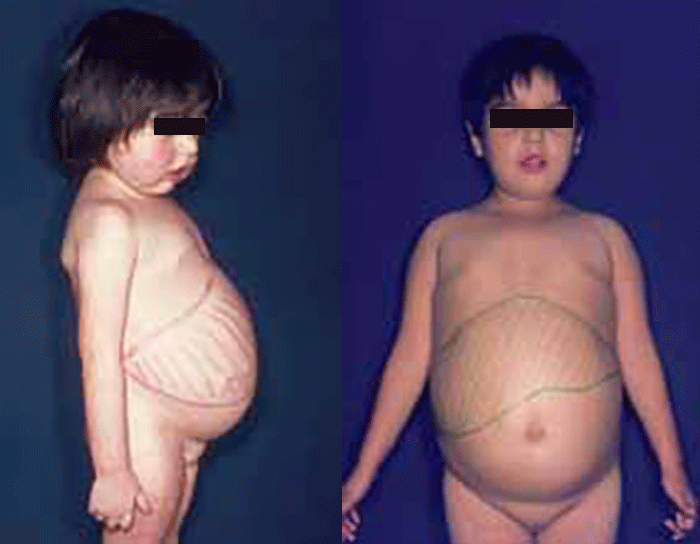
FIGURA 2. Fenótipo de crianças com glicogenose do tipo Ia (von Gierke). Fácies de boneca, grande distensão abdominal por hepatomegália importante e obesidade. (NIHDE)
No que respeita ao diagnóstico, este deve basear-se na clínica, e nos resultados de análises bioquímicas e genéticas (mutacionais). Os achados de hepatomegália, hipoglicémia de jejum curto, acidose láctica, hiperlipidémia e hiperuricémia são altamente sugestivos. Poderá ser necessário realizar uma prova de tolerância à glucose oral (2 g/kg, até máximo de 50 g, com colheitas de sangue aos 30, 60, 90, 120 e 180 minutos) para destrinça diagnóstica: na glicogenose de tipo I (Ia ou Ib) verifica-se diminuição da lactacidémia, enquanto nas outras glicogenoses se verifica aumento.
A prova do glucagom (500 µg ou 30-100 µg/kg IM com determinação da glicémia aos 15, 30, 45 e 60 minutos) mostrará falta de resposta hiperglicémica (ausência de incremento de 25 mg/dL em 45 minutos e marcada elevação da lactacidémia), salientando-se que poderá surgir neste contexto hipoglicémia ou acidose grave. Só raramente será necessário proceder a biópsia hepática para o estudo enzimático (fígado fresco, idealmente não congelado).
Sob o ponto de vista de novas tecnologias aplicadas à semiologia, com implicações práticas importantes no tratamento, cita-se um novo sensor que, para além da monitorização contínua subcutânea da glicémia, permite igualmente proceder em 1 minuto à determinação do nível plasmático de lactato (Lactate-Pro).
Nas glicogenoses tipo I, os objectivos do tratamento são evitar a hipoglicémia e alterações metabólicas secundárias, promover o crescimento normal e prevenir a nefropatia. Assim, torna-se fundamental propiciar um suprimento exógeno de glucose continuamente, dia e noite, a um ritmo que mantenha a glicemia acima do limiar dos mecanismos de contrarregulação.
Salienta-se, a propósito, que as necessidades diárias de glucose vão diminuindo com a idade: 0-12 meses à 7-9 mg/kg/minuto; >1-3 anos (A) → 6-8 mg/kg/minuto; > 3-6 A → 6-7 mg/kg/minuto; > 6-12 A → 5-6 mg/kg/minuto; adolescente → 5 mg/kg/minuto; adulto → 3-4 mg/kg/minuto.
O valor calórico total (VCT) deverá ser repartido do seguinte modo: hidratos de carbono à 60-70%; gorduras à 20-30%, substituindo as gorduras saturadas por insaturadas; proteínas à 10-15%.
As necessidades são cobertas por refeições frequentes, ricas em hidratos de carbono durante o dia e, durante a noite, com a chamada alimentação contínua nocturna (ACN) de acordo com o seguinte esquema: duração ~12 horas até aos 6 anos, cobrindo ~50-35% do VCT; duração ~10 horas após os 6 anos até ao fim da adolescência (~30% do VCT); e duração ~8 horas no adulto (~25% VCT).
Para evitar a hipoglicémia, a ACN deve iniciar-se, no máximo, 1 hora após a última refeição do dia; e, na manhã seguinte, deve iniciar-se a alimentação do doente cerca de 15-30 minutos depois de terminada a ACN. Após 1 ano de idade emprega-se o amido cru: de 4-4 horas até aos 2 anos de idade; e, depois, de 6-6 horas.
Nos casos em que não é possível a ACN, está indicada a administração de alimentos ricos em hidratos de carbono a intervalos regulares, de 2-2, 3-3, ou 4-4 horas, também durante a noite.
Quanto aos hidratos de carbono de absorção rápida, salienta-se a necessidade de restringir a lactose e evitar a sacarose.
Em função do contexto clínico de cada caso, poderá ser necessário recorrer a terapêuticas complementares dirigidas a situações específicas, como: hiperlipidémia, proteinúria mantida, nefrocalcinose, nefrolitíase, hiperuricémia, osteopénia, osteoporose, restrição do crescimento (a hormona de crescimento/GH não traz benefícios) etc..
Por vezes é necessário recorrer a transplantes: hepático, de hepatócitos, e renal.
Como novas terapias, citam-se a dieta rica em ácidos gordos de cadeia média, e novo amido modificado proporcionando melhor tolerância em jejum.
Nos doentes com mau controlo metabólico, não explicado por deficiente adesão às orientações médicas, é fundamental avaliar a função tiroideia pelo risco de hipotiroidismo. Efectivamente, a intensa terapia com hidratos de carbono, alterando o padrão alimentar, poderá originar carências nutricionais específicas, designadamente em vitamina B12, cálcio e selénio.
Na glicogenose do tipo Ib o tratamento é semelhante ao do tipo Ia; contudo, face às respectivas manifestações clínicas (ver atrás) existem certas particularidades:
- a gastrostomia está contraindicada;
- precaução com o suprimento de amido cru, susceptível de exacerbar doença inflamatória intestinal;
- a utilização de antbióticos profilácticos deverá ser ponderada;
- a utilização de G-CSF (factor estimulante do crescimento dos granulócitos), não glicosilado que, aumentando significativamente o número de neutrófilos (se neutropénia < 1.500/mmc), contribui para a diminuição da frequência e gravidade das infecções, a melhoria da cicatrização de abcessos e úlceras, e a melhoria da doença inflamatória intestinal;
- a utilização de IECA diminui a hiperfiltração, a proteinúria e a hipertensão arterial;
- eventualidade de esplenectomia nos casos de esplenomegália irreversível, resultante do tratamento com G-CSF.
Novas propostas de tratamento incluem: adalimumab (anticorpo monoclonal cujo alvo é o factor alfa de necrose tumoral); suplementação com vitamina E (antioxidante); terapia nutricional com dieta polimérica suplementar com TGF-Beta2 (Modulen-IBD):
Como complicações da glicogenose do tipo I há a referir: adenoma hepático, que pode evoluir para carcinoma hepatocelular; doença renal que se inicia precocemente e pode levar à necessidade de transplante renal; gota; cálculos renais; pancreatite; anemia; osteopénia; ovários poliquísticos; hipertensão pulmonar; hipocrescimento; atraso pubertário; tendência hemorrágiaca; e envolvimento neurológico. O atraso mental é raro.
Glicogenose tipo II (doença de Pompe)
Esta forma de glicogenose, mais rara que as de tipo I (incidência estimada em ~1/50.000 nados-vivos, correspondendo nas estatísticas de vários centros a 1/5 de todas as glicogenoses), resulta do défice da enzima maltase ácida lisossomal (alfa-1,4 glucosidase ácida) cujo gene estrutural está localizado no cromossoma 17q25.2. Importa salientar que foram identificadas diversas mutações.
Estão descritas duas formas principais: neonatal/ infantil (mais frequente) e juvenil/ adulto, conforme a data de início de manifestações; contudo existem formas com início em diversas idades e de evolução lenta caracterizadas essencialmente por miopatia.
Na forma neonatal/ infantil – início nas primeiras semanas ou nos primeiros meses de vida ou já no RN – são notórios hipotonia generalizada (floppy baby) com massas musculares de volume normal, perturbações da deglutição, macroglóssia (por vezes o primeiro sinal que chama a atenção), cardiomegália exuberante e progressiva/ cardiomiopatia hipertrófica, e insuficiência cardiorrespiratória que pode conduzir à morte nos primeiros meses (< 1-2 anos). Não existe hepatomegália ou a mesma é discreta. O ECG, muito típico na forma infantil, revela encurtamento de P-R e complexos QRS de alta voltagem. (Figuras 3 e 4)
Existe uma variante muscular com início nos primeiros 6 meses de vida, com sintomatologia muscular predominante, geralmente sem compromisso cardíaco.
A forma juvenil caracteriza-se fundamentalmente por fraqueza muscular proximal, sobretudo nos membros inferiores e tronco, incapacidade progressiva e impossibilidade da marcha autónoma ao longo dos anos, com desfecho fatal em idade variável, em geral por volta dos 30 anos. O EMG revela sinais de irritabilidade eléctrica.
No adulto simula outras miopatias. A miopatia proximal é lentamente progressiva sem atingimento cardíaco, ou mínimo.
Os achados laboratoriais são semelhantes nas duas formas: demonstração de vacúolos nas células (musculares, leucócitos, fibroblastos) que se coram para o glicogénio, e elevação da fosfatase ácida, CK e, por vezes de ALT e AST. A glicémia, a lactacidémia, a prova de tolerância à glucose oral e a do glucagom são normais.
Outros exames:
- EMG com padrão miopático em todos os fenótipos;
- Avaliação da função pulmonar, evidenciando marcada diminuição da capacidade vital e fadiga diafragmática precoce.
A confirmação do diagnóstico faz-se:
- Pela demonstração do défice enzimático; e
- Por análise mutacional, segundo a metodologia já referida para outras doenças hereditárias do metabolismo (biópsia muscular, fibroblastos, etc.).
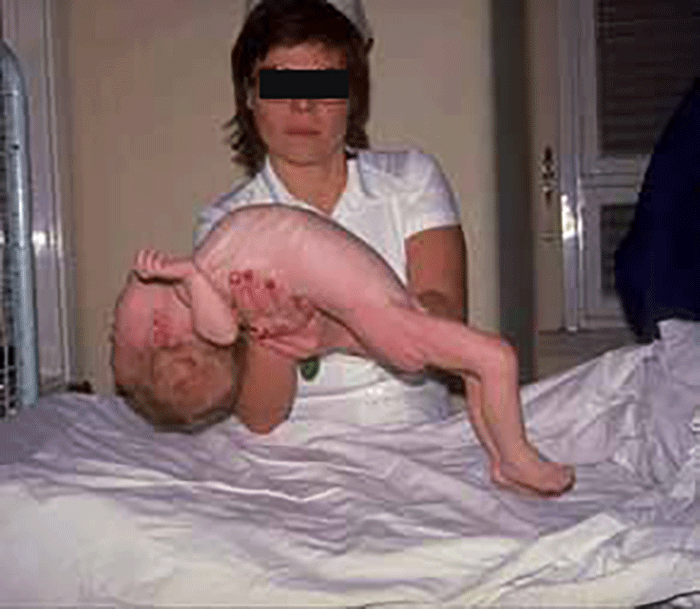
FIGURA 3. Lactente com hipotonia generalizada (floppy baby) no contexto de glicogenose tipo II (doença de Pompe). (NIHDE)
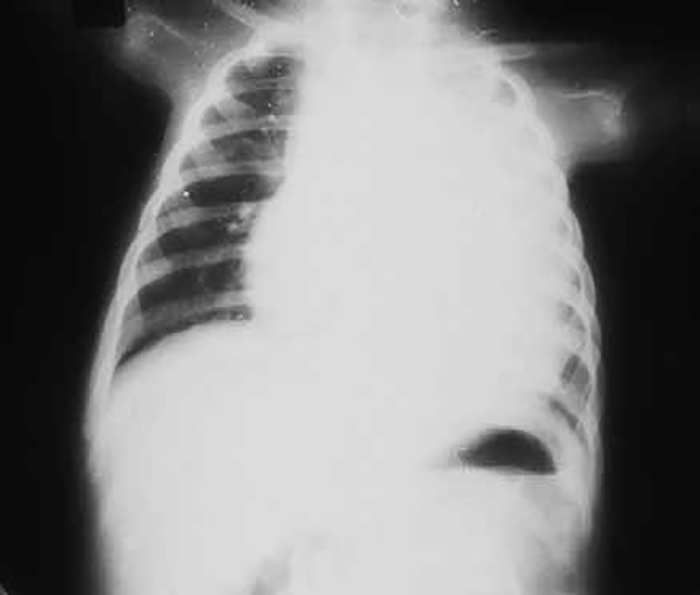
FIGURA 4. Sinais radiológicas de cardiomegália em criança com doença de Pompe. (NIHDE)
É possível o diagnóstico pré-natal.
O tratamento tem uma base multidisciplinar (dietética, suporte ventilatório e fisioterapia) enquanto não se inicia a terapêutica enzimática de substituição (TES):
- Dieta – elevado suprimento proteico (20-30% do VCT) com ou sem misturas de AA ramificados e suprimento calórico adedquado;
- Suporte ventilatório – por vezes há que recorrer a traqueostomia e ventilação mecânica;
- Fisioterapia – é importante o treino dos músculos inspiratórios;
- TES – procede-se a terapia endovenosa semanal, geralmente com boa tolerância: diminui a dependência do ventilador, melhoria da CM, motora e da função respiratória.
2. GALACTOSÉMIA
Metabolismo da galactose e nosologia
A galactosémia é uma doença hereditária traduzindo-se por valor elevado de galactose no sangue e integrando três formas clínicas associadas, respectivamente, a deficiência de três diferentes enzimas que integram o metabolismo da galactose.
Tais enzimas são: a galactose-1-fosfato-uridil transferase (GALT), a galactoquinase (GALK) e a uridina difosfato galactose-4-epimerase (GALE ).
A designação de galactosémia, embora apropriada para qualquer das deficiências enzimáticas referidas, na generalidade é atribuída à forma clássica (GALT), mais prevalente, em que se verifica deficiência completa da enzima GALT.
A propósito do metabolismo da galactose, cabe recordar que a lactose, dissacárido constituído por glicose e galactose, é o principal hidrato de carbono do leite. Ao ser ingerida, a lactose é hidrolisada no intestino por acção da lactase, em glicose e galactose; a galactose é depois fosforilada em galactose-1-fosfato (Gal-1-P) pela galactoquinase (GALK).
Outra enzima, a galactose-1-P-uridil transferase (GALT) converte a Gal-1-P e a uridina difosfato glicose (UDP glucose) em uridina difosfato galactose-4-epimerase (GALE ou UDP-galactose) e em glucose-1-P, sendo esta metabolizada em glucose-6-P, a partir da qual se formam glicose, piruvato e lactato. [UDP <> Uridina Di Fosfato] [F<>Phosphate].
A galactose pode ser também convertida em galactitol (causa primária das cataratas) por acção da aldolase redutase; por sua vez, a UDP glicose pode ser convertida em UDP galactose pela UDP galactose epimerase.
A UDP galactose é utilizada na síntese de glicoconjugados e intervém nas vias de síntese de novo, isto é, de produção endógena de galactose, facto que parece explicar muitas complicações tardias da galactosémia; a produção endógena, que é contínua, da ordem de 0,53-1,05 mg/kg/hora, pode conduzir a verdadeira intoxicação do SNC.
A fonte principal de galactose é o leite e produtos lácteos, existindo livre nas frutas e vegetais.
Aspectos epidemiológicos e genética
A galactosémia, doença autossómica recessiva, surge com incidência na Europa entre 1/18.000 e 1/60.000 na sua forma clássica, mais frequente na Irlanda. A mesma resulta da deficiência completa de GALT, com consequente acumulação de galactose-1-fosfato (Gal-1-P), exercendo acção lesiva nas células parenquimatosas do rim, fígado e cérebro.
De realçar que outras variantes derivam de graus diversos de deficiência parcial de GALT, como a variante Duarte que, em homozigotia, tem uma actividade enzimática de 50%.
A deficiência GALK, rara, com consequente acumulação nos tecidos de galactitol, tem sido descrita com maior incidência na Roménia. A deficiência GALE é a mais benigna, descrevendo-se o incremento de UDP-galactose nos tecidos e apenas deficiência enzimática ao nível de leucócitos e eritrócitos, sem desregulação metabólica noutros tecidos.
O gene para a transferase GALT localiza-se no cromossoma 9p13. Relativamente à forma GALK foram descritos dois genes: GK1 no cromossoma 17q24 e GK2 no cromossoma 15. O gene para a epimerase (GALE) localiza-se no cromossoma 1p-35-36.
Manifestações clínicas
A forma clássica (GALT), mais grave, tem início de forma aguda por volta da 1ª semana de vida após ingestão de leite, incluindo leite materno: vómitos, diarreia, perda ponderal, letargia, hipotonia, icterícia por hiperbilirrubinémia não conjugada ou mista, hepatomegália, disfunção hepática, hemorragias; tais manifestações podem ser fatais. As cataratas podem estar presentes desde os primeiros dias de vida ou observar-se mais tarde.
Na sua forma crónica verifica-se, em geral, anorexia persistente, vómitos frequentes, restrição do crescimento e alterações do desenvolvimento. (Figura 5)
Uma constelação de achados clínicos no RN e lactente, como doença hepática, diátese hemorrágica, icterícia, vómitos recorrentes, não progressão do peso, etc. devem levantar a suspeita diagnóstica de galactosémia, sendo que o diagnóstico de sépsis é muitas vezes o primeiro a ser sugerido. Por outro lado, há que ter em atenção que a septicémia por E. coli surge com frequência nos doentes com galactosémia.
Quanto às manifestações clínicas da forma GALK, dentro da raridade, citam-se: catarata e sinais de pseudotumor cerebri causados pelo galactitol.
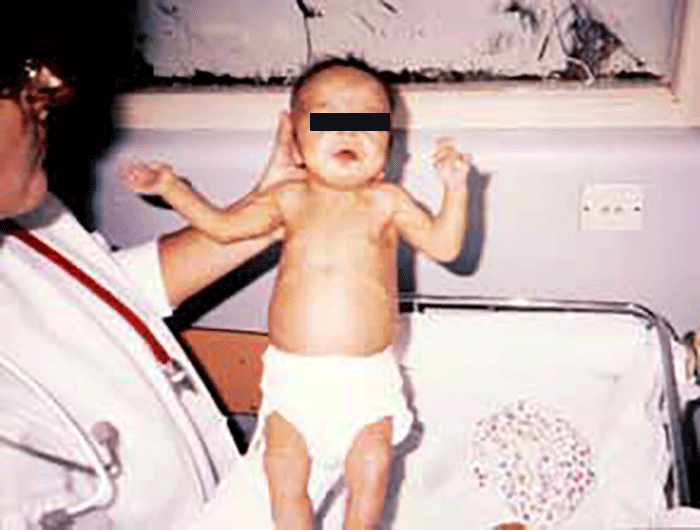
FIGURA 5. Lactente com galactosémia: icterícia, desnutrição e distensão abdominal notórias. (Cortesia do Dr. Aguinaldo Cabral)
Exames laboratoriais
Como achados laboratoriais há a realçar acidose metabólica, glicosúria, galactosúria, albuminúria, e aminoacidúria relacionáveis com disfunção tubular renal.
A positividade de substâncias redutoras na urina, embora não seja um achado muito sensível, pode fortalecer a suspeita.
Obtém-se maior sensibilidade e maior especificidade com o chamado teste de Beutler (fluorescent spot test), realizado com amostra de sangue total: não se observa fluorescência em caso de deficiência de GALT; esta análise só deverá ser executada 120 dias após eventual transfusão de sangue.
O resultado positivo apontará para suspeita diagnóstica de galactosémia, a confirmar mediante:
- Análise mutacional, genética, pesquisando mutações: no nosso país, a mais prevalente é a Q188R;
- Determinação da actividade enzimática nos eritrócitos – “método padrão de ouro” (só após 120 dias de transfusão).
Na forma GALK o diagnóstico final é feito demonstrando actividade normal de GALT e ausência de actividade de GALK nos eritrócitos.
Diagnóstico precoce
O diagnóstico precoce (antes das manifestações clínicas) pode ser feito após o nascimento. O rastreio alargado para a galactosémia clássica é feito na Europa apenas em 10 países (dados de 2014). A este propósito, importa referir que foi introduzida nova estratégia para diminuir os resultados falsos positivos: nos casos em que a actividade enzimática é < 15% faz-se o teste da galactose-desidrogenase, avaliado por fluorescência com radiação ultravioleta.
Tratamento
O tratamento baseia-se na exclusão da galactose e lactose da alimentação. Assim, em caso de suspeita de doença, deve excluir-se de imediato a galactose da alimentação, designadamente interrompendo:
- O aleitamento materno e/ou fórmulas convencionais (derivadas do leite de vaca); e
- Os produtos lácteos e derivados.
Na fase aguda é importante a administração de vitamina K e plasma fresco; a fototerapia raramente é necessária.
A dieta específica levará em geral a uma melhoria rápida, especialmente da função hepática e da doença tubular renal e, mais tardiamente, das cataratas.
Ultrapassada a fase aguda, o único tratamento específico é a dieta. Contudo, não é possível prevenir as complicações neurológicas tardias.
Deve proceder-se à administração de suplementos de cálcio, escolhendo cautelosamente os preparados sem lactose.
A falência ovárica evidencia-se por hipogonadismo hipergonadotrófico, o qual atinge cerca de 90% das mulheres doentes; são comuns a puberdade atrasada, a amenorreia e a oligomenorreia. As mulheres galactosémicas grávidas devem continuar a dieta sem lactose durante a gravidez.
O marcador mais importante para monitorizar o tratamento é a medição da Gal-1-P nos eritrócitos, admitindo-se como valor no limite superior aceitável: 150 µmol/L.
Os doentes com galactosémia necessitam de seguimento especializado, com especial atenção para o desenvolvimento na área da fala e para a vertente endocrinológica (em relação com início de tratamento hormonal – anticoncepção – nas raparigas, pelos 12-13 anos).
A forma GALE não necessita de tratamento. Nas formas assintomáticas, identificadas em programas de rastreio, aconselha-se, não dieta livre de galactose, mas apenas restrição, dado o papel importante da galactose no desenvolvimento do sistema nervoso.
Complicações
Mesmo nos doentes tratados poderão surgir complicações tardias frequentes como moderada restrição do crescimento, atraso da fala, dispraxia (movimentos “desajeitados e descoordenados” – incluindo ao nível dos músculos que intervêm na fala – sem que haja parésia ou ataxia), hipotonia, tremor, deficiência psíquica, deficiência da visão e percepção, disfunção ovárica conduzindo a infertilidade, ataxia, etc.. Por isso, o prognóstico final poderá ser problemático, tendo em conta designadamente que o QI diminuindo durante a infância, sofrerá progressivo agravamento com a idade.
3. INTOLERÂNCIA HEREDITÁRIA À FRUTOSE
Metabolismo da frutose e nosologia
A intolerância hereditária à frutose (IHF) é uma afecção causada por deficiência da actividade da aldolase B (frutose1,6 – difosfato) no fígado, rim e intestino. É explicável por mutações no gene da aldolase B no cromossoma 9q22.3.
A aldolase B catalisa a hidrólise da frutose 1,6 difosfato em triose fosfato e gliceraldeído fosfato; hidrolisa igualmente a frutose-1-fosfato (F-1-P).
Quando se verifica ingestão de frutose, o resultado do défice enzimático é o surgimento de sintomas por acumulação de frutose 1-fosfato com acção tóxica tecidual, devida a redução do ATP intracelular e inibição da glicogenólise.
A frutose é importante fonte dietética de hidratos de carbono, encontrando-se no mel, vegetais, leguminosas, frutos, sacarose, sorbitol (este último, poliálcool que resulta da redução enzimática da glicose). Dum modo geral, um adulto consome diariamente cerca de 100 gramas de frutose, consumo que, infelizmente, está em crescendo.
Distinguem diversas entidades clínicas, entre elas:
- A frutosúria essencial ou benigna, assintomática, resultante de défice da frutoquinase (que catalisa a fosforilação da frutose em frutose-1-fosfato), com incidência ~1/120.000; e
- A intolerância hereditária à frutose (IHF) por défice da aldolase B [ou aldolase da frutose 1,6-difosfato (F-1,6 DP)] ao nível do fígado, rim e intestino delgado, com uma incidência aproximada de 1/23.000.
Neste capítulo é dada ênfase à IHF.
Manifestações clínicas
Como regra geral, os indivíduos de qualquer idade com a anomalia não evidenciam sintomatologia até ingerirem alimentos contendo frutose ou sacarose (açúcar de mesa). Os RN e lactentes alimentados exclusivamente com leite materno estão assintomáticos.
Existem formas de apresentação aguda e crónica. O modo mais frequente corresponde ao início da diversificação alimentar com a introdução de fruta ou sacarose: palidez, vómitos, diarreia, hipoglicémia, sudorese, tremor, choque, icterícia, diátese hemorrágica, apatia, coma, edema, ascite, oligoanúria, hepatomegália e, por vezes, esplenomegália, insuficiência hepática aguda e disfunção tubular renal que podem ser fatais. (Figura 6) A sintomatologia inicial é semelhante à da galactosémia.
A sensibilidade à frutose é variável: enquanto certos doentes exibem sintomas com pequenas doses de frutose, outros poderão tolerarar até 250 mg/kg/dia; dum modo geral, a exuberância de manifestações é directamente proporcional ao teor de frutose ingerido.
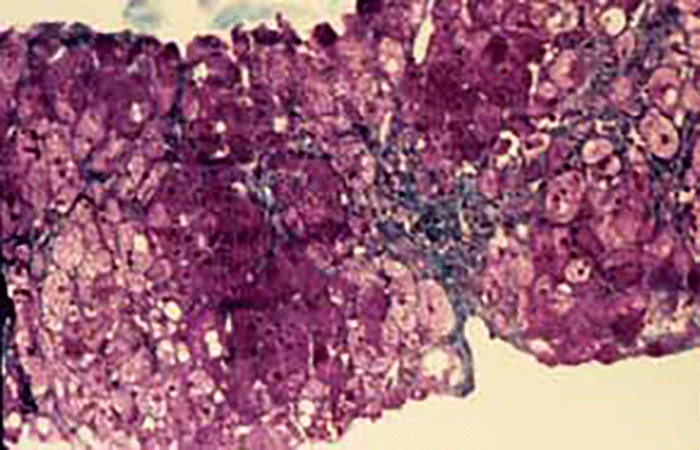
FIGURA 6. Imagem de histologia hepática: lactente com IHF, sendo notórias alterações cirróticas no contexto de hepatomegália em regressão com dieta. (Cortesia do Dr. Aguinaldo Cabral)
Poderá desenvolver-se aversão aos doces e hábitos alimentares peculiares, o que tem efeito protector pela menor ingestão do nutriente: típica ausência de cárie).
Poderá haver atraso do diagnóstico correcto, conhecendo-se casos em que tal é somente realizado na idade adulta. Deve reforçar-se a ideia de que os doentes não identificados estão em risco de vida.
Havendo suspeita da doença, deve proceder-se a um conjunto de exames laboratoriais:
- Análise de urina (incluindo pesquisa de substâncias redutoras); os achados clássicos em caso de intolerância à frutose são: frutosúria, glicosúria, fosfatúria, proteinúria, aminoacidúria testemunhando disfunção tubular renal;
- Análise de sangue: pH, fósforo, potássio, glicose diminuídos; e lactato, ALT, AST elevados; alteração dos factores de coagulação;
NB- a hipoglicémia verificada num tempo curto após exposição à frutose poderá escapar à detecção. |
- Análise de ADN permite confirmação diagnóstica em mais de 95% dos casos), pesquisando a mutação prevalente na Europa (A149P);
- Análise – medição da actividade enzimática, de preferência nas células hepáticas ou, como alternativa, no intestino delgado (biópsia), havendo dúvidas; salienta-se que tal medição não deve ser realizada nas células do sangue nem nos fibroblastos, os quais somente expressam a aldolase A.
Notas importantes:
|
Tratamento
O tratamento consiste em prescrever para toda a vida um regime alimentar isento de frutose, assim como de seus precursores como sacarose e sorbitol. Uma vez ultrapassada a fase aguda, o cumprimento de tal dieta permite, em geral, um curso benigno.
As fórmulas infantis não devem conter frutose nem sacarose.
Alguns autores preconizam a suplementação de vitamina C e de folatos.
BIBLIOGRAFIA
Aeppli TRJ, Rymen D, Allegri G. Glycogen storage disease type VI: clinical course and molecular background. Eur J Pediatr 2020;179:405-413
Arad M, Maron BJ, e tal. Glycogen storage disease presenting as hypertrophic cardiomyopathy. NEJM 2005;352:362-372
Bosch AM. Classical galactosaemia revisited. J Inherit Metab Dis 2006; 29: 516-525
Bouteldja N, Timson DJ. The biochemical basis of hereditary fructose intolerance. J Inherit Metab Dis 2010;33:105-112
Cabral A. Enfermedades del almacenamiento del glicógeno y defectos de la gluconeogénesis. In Sanjurjo P, Baldellou A (eds). Diagnóstico y Tratamiento de las Enfermedades Metabólicas Hereditarias. Madrid: Ergon, 2006;263-282
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Kollberg G, Tulinius M, Gilljam T, et al. Cardiomyopathy and exercise intolerance in muscle glycogen storage disease. NEJM 2007;357:1507-1514
Lyon G, Kolodny EH, Pastores GM (eds). Neurology of Hereditary Metabolic Diseases of Children. New York: McGraw-Hill, 2006
Marion RW, Paljevic E. The glycogen storage disorders. Pediatr Rev 2020;41:41-44
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Saudubray JM, Garcia – Cazorla A. Inborn errors of metabolism overview: pathophysiology, manifestations, evaluation and management. Pediatr Clin N Am 2018;65:179-208
Theodore M, Morava E. Congenital disorders of glycosylation. Curr Opin Pediatr 2011;23:581-587