Introdução
O crescimento fetal pode estar desviado, por excesso ou por defeito (restrição). Em qualquer das circunstâncias tal situação pode constituir um epifenómeno de patologia de etiopatogénese diversa com implicações diagnósticas e terapêuticas específicas, ou apenas representar uma variante da normalidade.
1. RESTRIÇÃO DO CRESCIMENTO INTRAUTERINO (RCIU)
Definição
A restrição do crescimento intrauterino (RCIU) – termo considerado actualmente mais adequado por muitos autores do que o anterior, de “atraso de crescimento intrauterino” – é definida no sentido lato como a perda de oportunidade de o feto atingir o respectivo potencial de crescimento. No sentido estrito, o critério de definição mais utilizado baseia-se exclusivamente no peso ao nascer: recém-nascido (RN) com peso inferior ao que corresponde ao percentil 10 para a respectiva idade de gestação e género, isto é, leve para a idade de gestação (LIG) em valores representativos da população.
Outros autores preferem utilizar como valores de corte, o percentil 5, o percentil 3, ou dois desvios-padrão abaixo da média.
Embora a condição LIG possa constituir um razoável indicador de RCIU, em rigor, os conceitos de LIG e RCIU, não são sinónimos, dado que cada situação poderá ocorrer na ausência de outra. Há recém-nascidos (RN) LIG constitucionalmente pequenos, considerados saudáveis, assim como casos de desnutrição intrauterina com inflexão da trajectória do crescimento fetal em que o peso no momento do nascimento se situa entre os percentis 3 e 97 (RN adequados para a idade de gestação, designados pela abreviatura AIG).
Nesta última circunstância, é essencial recorrer a outros indicadores de desnutrição fetal, referidos mais adiante.
Aspectos epidemiológicos e diagnóstico pré-natal
A incidência de RCIU varia, de acordo com diversos estudos epidemiológicos, entre 3% e 7% dos RN; trata-se dum problema ao qual se associa risco significativo de mortalidade e morbilidade perinatais, especialmente na ausência de diagnóstico pré-natal. O método mais fidedigno para o diagnóstico de RCIU assenta na avaliação de, pelo menos, duas avaliações da biometria fetal por ultrassonografia, sendo o perímetro abdominal o parâmetro mais sensível. A hemodinâmica avaliada por ecografia-Doppler, designadamente através de medições do fluxo nas artérias umbilical, cerebral média e uterina, reveste-se de grande utilidade no diagnóstico de insuficiência útero-placentar, o principal factor etiológico de RCIU.
Etiopatogénese e classificação
Para compreender as diferentes classificações de RCIU, é importante recordar as três fases de crescimento fetal. Na primeira, predomina a hiperplasia celular, caracterizada por rápido aumento do número de células até às 16 semanas de vida intrauterina.
Na segunda, entre as 16 e as 32 semanas de gestação, há um abrandamento da hiperplasia e um progressivo aumento to tamanho das células (hipertrofia).
Na terceira, após as 32 semanas, predomina a hipertrofia, com rápido aumento da dimensão celular.
Os dois tipos mais usados de classificação de RCIU são o etiológico e o clínico.
Pela classificação etiológica, a RCIU pode ser de origem fetal (explicável por patologia intrínseca do feto, útero-placentar), ou materna (explicável por factores extrínsecos).
A classificação clínica assenta na proporcionalidade corporal. Ou seja, a RCIU é classificada em função da “simetria” ou “assimetria” dos parâmetros do numerador e denominador de fracção em que o peso ocupa o numerador e o comprimento o denominador, por exemplo: índice peso-comprimento, índice de massa corporal e índice ponderal.
O índice ponderal de Rohrer tem sido o indicador antropométrico mais utilizado para avaliar a proporcionalidade ao nascer: [Peso (em g)/ Comprimento3 (em cm)]x100]. Este índice tem vindo a cair em desuso, porventura por incluir o comprimento elevado ao cubo; ao ser uma medição difícil de se obter com rigor, qualquer erro se amplia pelo facto de o valor estar elevado à potência.
Na RCIU simétrica, harmoniosa, ou proporcionada, tanto o peso como o comprimento estão diminuídos. Quando o peso é predominantemente afectado, a RCIU é designada assimétrica, desarmoniosa ou desproporcionada.
Esta terminologia, muito utilizada, poderá originar erroneamente a ideia de que a RCIU simétrica, harmoniosa ou proporcionada representará um processo mais “benigno”. De facto, assim não é.
Tipicamente, a RCIU simétrica está associada a patologia intrínseca do feto, como infecções intrauterinas (rubéola, citomegalovírus, toxoplasmose, sífilis, paludismo, etc.), anomalias cromossómicas, síndromas dismórficas e noxas maternas actuando no feto – tabaco, álcool, cocaína, heroína e certos fármacos como o propranolol e os corticosteróides. Neste tipo de RCIU, a alteração do crescimento manifesta-se precocemente na gravidez, podendo atingir a fase de hiperplasia celular e organogénese e levar a uma redução do número total de células.
A RCIU assimétrica, mais frequente, inicia-se tardiamente na gravidez e está associada a causas maternas e útero-placentares, pré-eclâmpsia, hipertensão crónica e anomalias uterinas. Nestas circunstâncias, é frequente encontrar enfartes ou alterações microvasculares da placenta.
A desnutrição fetal aguda ocorrendo no último trimestre, em geral apenas atinge a fase de hipertrofia celular e associa-se à redução das reservas adiposa e de glicogénio, com consequente diminuição dos tecidos subcutâneo, muscular e hepático (redução do perímetro abdominal). Além do défice de suprimento de nutrientes, na insuficiência útero-placentar frequentemente coexiste menor fornecimento de oxigénio e consequente hipoxia pré- e perinatal. (Quadro 1)
Há autores, porém, que questionam a relação entre a conformação somática do RN e os factores etiopatogénicos referidos.
No Quadro 2, complemento do Quadro 1, são discriminados os factores que mais frequentemente estão associados a RCIU.
Demonstrou-se que a angiogénese, processo fundamental para o crescimento e desenvolvimento, designadamente da placenta, está alterada em múltiplas situações acompanhadas de RCIU.
Diversos estudos chamaram a atenção para o papel do factor de crescimento endotelial vascular (VEGF ou vascular endothelial growth factor) como mediador da angiogénese, o qual exerce o seu efeito através da cooperação de 2 receptores aos quais se liga: VEGFR-1 e VEGFR-2, sendo que o VEGFR-1 constitui um potente inibidor de VEGF e dum factor de crescimento placentar.
Outros estudos concluíram que a concentração sérica de VEGFR-1 solúvel está muito elevada nos RN com RCIU no 1º dia de vida, o que pode reflectir hipóxia intrauterina e disfunção placentar, traduzindo provavelmente papel importante como factor de risco de RCIU.
Recentemente tem-se demonstrado a acção deletéria de poluentes a que a grávida está exposta, tais como monóxido de carbono e certos compostos hidrocarbonados aromáticos policíclicos; os efeitos são diversos: défice de oxigenação fetal a par de estresse oxidativo, lesão do ADN, etc..
Manifestações clínicas, complicações e avaliação
À RCIU associa-se maior risco de mortalidade e morbilidade neonatais, designadamente na de tipo simétrico.
Apesar de os RN com RCIU terem maior capacidade termogénica, estão mais propensos à hipotermia pela menor espessura da gordura subcutânea.
Relativamente à conformação corporal, a RCIU de tipo assimétrico associa-se a maior risco de hipoglicémia e asfixia, enquanto a de tipo simétrico, a maior taxa de prematuridade e complicações perinatais.
A hipoglicémia constitui a principal complicação metabólica do RN com RCIU, por diminuição das reservas fetais de glicogénio e compromisso da neoglicogénese e da glicogenólise hepáticas. A hipocalcémia ocorre essencialmente em RN com RCIU e sinais de hipotrofia e/ou que sofreram asfixia perinatal.
A asfixia perinatal está intimamente relacionada com a hipoxia crónica por insuficiência útero-placentar a qual, por sua vez, pode associar-se a síndroma de aspiração de mecónio, hipertensão pulmonar e policitémia por estimulação da eritropoietina fetal.
QUADRO 1 – Tipos de restrição do crescimento intrauterino (RCIU).
| Assimétrica | Simétrica | |
| Biometria – Parâmetro afetado | Peso | Peso, comprimento e perímetro cefálico |
| Causa | Extrínseca | Intrínseca ou extrínseca |
| Incidência | 80% | 20% |
| Início na gravidez | Tardio | Precoce |
| Fase da gravidez | Hipertrofia celular | Hiperplasia celular |
| Patogénese | Insuficiência útero-placentar: défice de suprimento de nutrientes | Diminuição do número de células |
| Tecidos e órgãos | Diminuição do tecido adiposo, muscular e hepático | Diminuição do encéfalo |
| Placenta | Alterações histológicas | Histologia normal (exceto na embriopatia infeciosa) |
QUADRO 2 – Factores frequentemente associados a RCIU.
Fetais |
Placentares |
Maternos |
Nos RN com RCIU pode verificar-se diminuição da absorção entérica de macromoléculas, nomeadamente de lípidos e de proteínas.
Determinados sinais clínicos indicam hipoxia pré-natal. A presença de líquido amniótico tinto de mecónio é um sinal de sofrimento fetal agudo, enquanto o líquido com aspecto de “puré de ervilha” sugere um processo mais prolongado de hipoxia intrauterina. Neste caso, é habitual o RN evidenciar sinais de dismaturidade, apresentando um aspecto “envelhecido”, pele enrugada e descamativa e olhar alerta, não condizente com o peso deficitário e o aspecto emagrecido. Tratando-se de um RN com RCIU, de termo, o mesmo evidenciará a postura típica com membros superiores e inferiores em flexão, semelhante à postura do RN de termo sem RCIU, e diversa da do RN pré-termo cujos segmentos dos membros estão em extensão. (Figuras 1 e 2)
Na RCIU simétrica devem ser procurados sinais de dismorfia:
- Ou enquadrados em síndromas polimalformativas;
- Ou que sugiram infecção intrauterina do grupo TORCHS. Neste caso é necessário pesquisar microcefalia, hepatosplenomegália, exantema e outros sinais biológicos.
Alguns parâmetros somatométricos podem auxiliar no diagnóstico de desnutrição fetal e prever o risco metabólico precoce. O mais fácil de avaliar é o peso, mas como foi referido, muitos RN LIG não têm patologia, enquanto outros têm peso adequado à idade de gestação e sofreram desnutrição intrauterina. Uma desproporcionalidade corporal em que o peso é afectado, mas não o comprimento, pode ser um bom indicador desta condição; a pouca espessura das pregas cutâneas e outros índices poderão ser tão bons ou melhores indicadores. Entre estes, incluem-se os valores baixos da razão perímetro braquial/perímetro cefálico, da razão peso/comprimento, e valores baixos das áreas da secção transversal do braço (áreas adiposa e braquial) calculadas a partir da prega cutânea tricipital e do perímetro braquial.
No entanto, vários autores questionam a confiabilidade da medição das pregas cutâneas no RN, a validade das áreas da secção transversal do braço e o valor da conformação corporal na previsão do risco metabólico precoce. (Figura 1)
Em comparação com os RN de equivalente idade de gestação e peso adequado, os pré-termo com RCIU têm maior risco de complicações inerentes à prematuridade. (Figura 2)
Embora haja a ideia de que o estresse a que é submetido o RN com RCIU induz a maturidade pulmonar, foi demonstrado que o RN pré-termo com esta condição tem maior probabilidade de ter doença da membrana hialina.
A maior prevalência de asfixia perinatal e consequente redistribuição do fluxo sanguíneo, hiperviscosidade por policitémia e a própria prematuridade, predispõem à enterocolite necrosante.
Outras complicações da RCIU relacionadas com a prematuridade são a sépsis, a hemorragia intraperiventricular e as sequelas neurológicas.
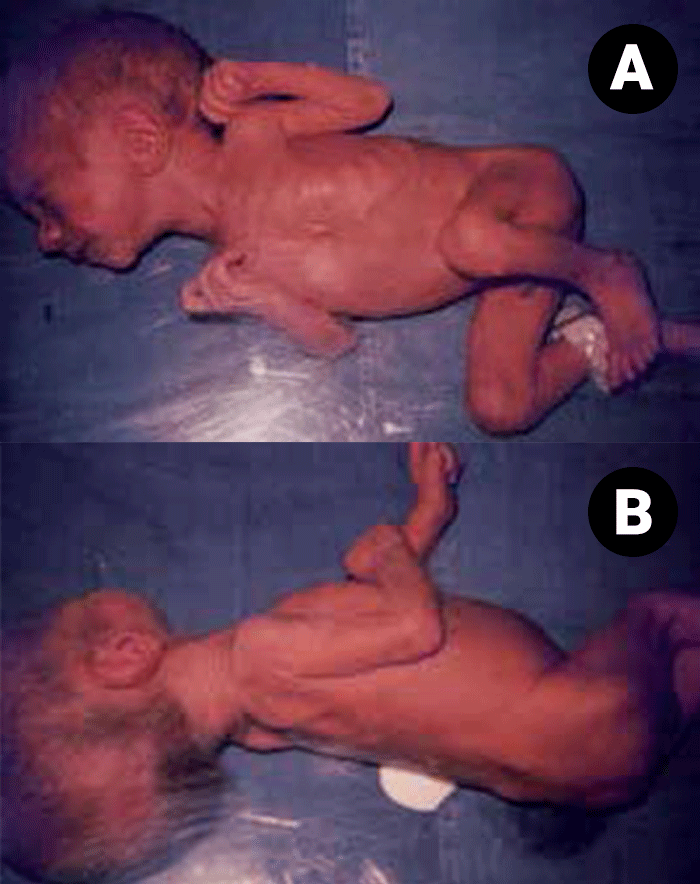
FIGURA 1. RN de termo com RCIU. Aspecto geral desnutrido; postura em flexão dos membros superiores e inferiores compatível com a idade gestacional. (URN-HDE)
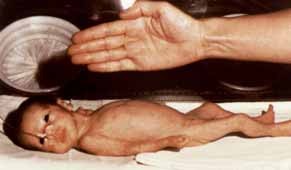
FIGURA 2. RN pré-termo com peso de nascimento semelhante ao da Figura 1: postura dos membros inferiores em extensão, e hipotonia marcada, compatíveis com a idade gestacional. (URN-HDE)
Importância do problema e implicações futuras
Barker, especulando sobre os mecanismos que determinam a repercussão a longo prazo da desnutrição fetal, deu origem a uma teoria conhecida por “hipótese de Barker” ou “hipótese da poupança” (thrifty hypothesis). Segundo esta teoria, o feto responde à desnutrição com uma série de mecanismos de adaptação, que incluem o armazenamento de gordura, redução do metabolismo não essencial, restrição do crescimento e redistribuição do fluxo sanguíneo e nutrientes para órgãos nobres (designadamente, cérebro, coração e suprarrenais) em detrimento doutros nos quais se verificam alterações de que resultam lesões permanentes. A privação nutricional pode influenciar de modo programado o feto (ou originar, assim, uma “programação” ou “marca” no mesmo, levando mais tarde a lesões estruturais e metabólicas permanentes). Estas alterações não se tornam tão evidentes se o indivíduo, após o nascimento, continuar a crescer em ambiente nutricionalmente deficitário, representando tal ambiente a continuidade de condições que já se verificavam antes (in utero) e uma “vantagem” em termos metabólicos”, facilitando os mecanismos de adaptação do feto à vida extrauterina.
No entanto, ao ser exposto a meio nutricionalmente rico, a “programação” pré-natal torna-se inadequada e no indivíduo em causa poderá desenvolver-se tardiamente a chamada síndroma metabólica, dominada por alterações da homeostasia da glicose-insulina. Nesta síndroma, incluem-se a diabetes de tipo 2 (DT2), a doença coronária, a hipertensão arterial, o perfil lipídico aterogénico e a obesidade de predomínio troncular.
Estudos em modelos animais permitem explicar alguns mecanismos patogénicos desta síndroma. A exposição a um regime nutricional intrauterino pobre em proteína, origina no pâncreas fetal uma diminuição da proliferação das células-β dos ilhéus pancreáticos e redução da dimensão dos mesmos por défice de vascularização. A redistribuição de nutrientes também pode levar à redução permanente dos transportadores de glicose no músculo, iniciando o círculo vicioso: hiperglicémia, aumento do estímulo para produção da insulina e exaustão e apoptose das células-β pancreáticas e diminuição da expressão da insulin-like growth factor II.
Relativamente à hipertensão e doença cardiovascular, foram observadas: alterações da angiogénese; exposição do feto a níveis elevados de glucocorticóides, aumento da expressão do respectivo receptor, e estímulo para a activação do sistema renina-angiotensina; mecanismos epigenéticos, envolvendo a metilação do ADN; e doença renal por redução fetal do número de nefrónios.
Entre os mecanismos favorecendo a futura obesidade, foram descritas no feto: selecção de clones celulares associados à produção endógena de lípidos; supressão da lipólise induzida pela insulina em adipócitos malnutridos.
Na espécie humana, foi descrita alteração congénita do padrão do apetite e saciedade resultante das adaptações metabólicas referidas. Um dos factores que participam nesta programação pode relacionar-se com a grelina, péptido orexigénico cujos níveis estão aumentados em indivíduos nascidos LIG.
Existem outros efeitos não relacionados com a futura síndroma metabólica, mas também resultantes da redistribuição do fluxo sanguíneo e de nutrientes, justificando a hipocelularidade e hipoplasia de outros órgãos e tecidos, como: eventual redução da massa muscular (sarcopénia) e osteopénia; diminuição do desenvolvimento e função do timo e tecido linfóide; e maior susceptibilidade a infecções respiratórias e diarreias durante a infância, por afecção de componentes do sistema imunitário, particularmente sensíveis a défice nutricional precoce.
Nos primeiros anos de vida, é notório o hipocrescimento estaturo-ponderal na RCIU de tipo simétrico. Contudo, a médio e longo prazo, o prognóstico parece melhor. No entanto, cerca de 10% a 15% de indivíduos nascidos com RCIU não recuperam o crescimento aos 2 anos de idade, estão em maior risco de terem baixa estatura na idade adulta e poderão beneficiar de tratamento com hormona de crescimento.
Curiosamente, mulheres que nasceram com RCIU podem ter maior predisposição para gerar filhos com a mesma condição, estabelecendo-se assim um efeito transgeracional. Isto verificou-se não só em mães que sofreram desnutrição aguda, da coorte de Holandeses sujeitos a fome extrema durante a segunda guerra mundial (Dutch Famine Cohort), mas também em mães suecas de meio favorecido. Em parte, o efeito transgeracional pode dever-se às pequenas dimensões do útero e ovários, observado em adolescentes que sofreram RCIU.
2. HIPERCRESCIMENTO INTRAUTERINO
Definição
Considera-se que um RN teve um crescimento intrauterino excessivo (ou hipercrescimento) quando o peso de nascimento é superior ao percentil 97 ou dois desvios padrão acima da média para a idade de gestação e género numa curva representativa da população; tal RN é designado grande (ou pesado) para a idade de gestação (GIG).
Os RN GIG de termo são geralmente macrossómicos (ou macrossomáticos), termos que significam peso de nascimento superior a 4.000 gramas.
Aspectos epidemiológicos e diagnóstico pré-natal
Estima-se que 9% a 13% dos RN sejam GIG, condição associada a certo número de complicações no período perinatal.
Frequentemente, a condição de feto macrossómico (macrossomia) não é detectada durante a gravidez e o trabalho de parto, pelo facto de a sensibilidade e especificidade das estimativas ultrassonográficas ficarem aquém do desejado. Um dos parâmetros com maior sensibilidade diagnóstica é o perímetro abdominal.
Existem classificações, como as de White e de Pedersen, com valor prognóstico para o feto de mãe diabética.
A macrossomia é típica do RNMD, entidade clínica descrita noutro capítulo.
Etiopatogénese
Um RN GIG pode constituir manifestação de determinada patologia (como RN de mãe diabética – RNMD) e determinadas síndromas, enquadrar-se no contexto de gigantismo de início pré-natal, ou corresponder apenas uma situação de RN constitucionalmente grande/pesado, sem patologia subjacente.
Mais raramente, a condição de GIG pode associar-se à eritroblastose fetal grave, hidropisia fetal e transposição das grandes artérias.
A classificação do RN GIG, baseada no índice ponderal individualizado, veio mudar a perspectiva etiopatogénica: não se consegue determinar a causa da macrossomia em cerca de 1/3 dos RN GIG, sendo que os RNMD não representam mais do que 10% daqueles, ao contrário do que se julgava.
Manifestações clínicas e complicações
Pelas dimensões do feto, o parto por via vaginal comporta maior risco de distócia de ombros, de fractura da clavícula e dos membros, e de asfixia perinatal.
Ao RNMD associam-se intolerância alimentar, hipoglicémia, hipocalcémia, policitémia, hiperbilirrubinémia não conjugada e atraso na produção de surfactante com consequente quadro de SDR (doença da membrana hialina). Uma vez que a incidência de anomalias congénitas é significativamente superior nos RNMD, torna-se necessário proceder ao respectivo rastreio em tal circunstância (cita-se como exemplo a cardiomiopatia hipertrófica. (Figura 3)
O exame objectivo de um RN macrossómico obriga à detecção de determinadas lesões traumáticas tais como fractura da clavícula e dos membros, traumatismo das partes moles, lesão do plexo braquial e céfalo-hematoma, designadamente se o parto se tiver realizado por via vaginal.
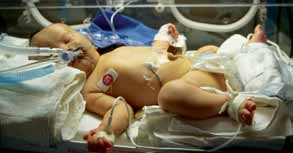
FIGURA 3. RN macrossomático (RNMD) com insuficiência respiratória submetido a terapia em UCIN. (URN-HDE)
No RN GIG e/ou macrossómico devem ser pesquisados determinados sinais classicamente associados à entidade “RNMD”, se houver antecedentes maternos sugestivos.
O RNMD tem um fenótipo característico, com acumulação de gordura na face e tronco. Pode ter aspecto pletórico, tremor, taquipneia e icterícia. A antropometria poderá ajudar a definir melhor o referido fenótipo. Há autores sugerindo que a acumulação da gordura troncular pode ser mais bem avaliada pelo índice de gordura centrípeta (ainda não validado), baseada na medida das pregas cutâneas subescapular (PSE), suprailíaca (PSI), tricipital (PT) e bicipital (PB): (PSE + PSI)/(PT + PB + PSE + PSI).
Outros, sugerem medidas antropomórficas que poderão sugerir se a distocia de ombros no RNMD foi ou não motivada por ombros e perímetros dos membros desproporcionadamente grandes.
Retomando a noção de proporcionalidade corporal atrás explicitada, na prática este critério permitirá a destrinça entre GIG e verdadeiro macrossómico.
A macrossomia pode também enquadrar-se num gigantismo de início pré-natal, com aumento excessivo do comprimento ao nascer e outras características sindromáticas evidentes desde o período neonatal: a síndroma de Sotos, associando dificuldades em se alimentar, hipotonia, macrocefalia com dolicocefalia e abaulamento do frontal, palato ogival, extremidades acromegalóides e idade óssea avançada; a síndroma de Beckwith-Wiedemann, associando hipoglicémia, letargia, macroglossia, hiperplasia de órgãos internos, pregas típicas nos pavilhões auriculares, onfalocele e outros defeitos da parede abdominal, e criptorquidia; a síndroma de Weaver, associando anomalias craniofaciais típicas, choro rouco e agudo, hipertonia e camptodactilia; a síndroma de Marshall, associando anteversão das narinas, achatamento da base do nariz, espaçamento dos olhos aparentando macroftalmia, espessamento da parte superior da calote craniana, calcificações intracranianas, catarata e anomalias do palato; e a síndroma de Perlman, associando displasia renal, tumor de Wilms, hiperplasia do pâncreas endócrino e outras anomalias congénitas.
Noções práticas sobre a avaliação do estado de nutrição em crianças nascidas pré-termo
A avaliação do estado de nutrição em crianças nascidas pré-termo baseia-se fundamentalmente na antropometria e na medição de marcadores bioquímicos usados frequentemente na clínica. Em determinados centros de investigação, e segundo a experiência do autor (LPS) podem ser utilizados métodos biofísicos, mais sofisticados, para caracterização da composição corporal e requerendo ainda validação, tais como os baseados na impedância bioeléctrica (BIO), na densitometria (DXA), ultrassonografia (US) e ressonância magnética (RM) (ver adiante).
Antropometria
As medidas antropométricas clássicas [utilizando instrumentos rudimentares como fita métrica, craveira e balança, e devendo ser interpretadas utilizando curvas e valores de referência adequados], têm especial utilidade com três objectivos essenciais: diagnóstico de desnutrição fetal ao nascer, vigilância do crescimento e do estado de nutrição após nascimento e identificação precoce de desnutrição ou de sobrenutrição.
- Peso, embora seja o parâmetro mais frequentemente utilizado, não fornece informação sobre os compartimentos corporais.
- Comprimento, reflectindo o crescimento esquelético, é um indicador da massa magra; o rigor na sua medição (ver adiante) é essencial.
- Perímetro cefálico (PC) indica o crescimento do cérebro; há que atender à possibilidade de ser afectado por factores relacionados com a morbilidade associada à prematuridade, e não com a nutrição.
- Perímetro braquial (PB) é fácil de medir; a sua avaliação longitudinal indica razoavelmente as variações da adiposidade corporal.
- Pregas cutâneas estimando satisfatoriamente a gordura somática, não são, no entanto, representativas da gordura intrabdominal.
- Ratio peso/comprimento [quer utilizando o índice de massa corporal, quer o índice ponderal] tem sido usada para avaliar a proporcionalidade corporal ao nascer. Estes e outros índices antropométricos, como a ratio perímetro braquial/perímetro cefálico (PB/PC) e as áreas da secção transversal do braço (por ultrassonografia ou por ressonância magnética), podem fornecer boa estimativa da composição corporal, embora necessitem de ser validados. (Consultar www.growthcalculator.org)
Marcadores bioquímicos
Os marcadores bioquímicos, devendo ser utilizados como complemento da antropometria, permitem avaliar o status sérico ou sanguíneo electrolítico e metabólico (essencialmente cloro, sódio potássio e glucose) assim como a nutrição em ferro, proteica (azoto ureico, pré-albumina sérica, proteína ligada ao retinol e transferrrina sérica) e óssea (calcémia, fosforémia, combinação fosfato sérico e fosfatase alcalina, fosfatase alcalina, assim como certos marcadores urinários).
Um valor baixo de azoto ureico pode indicar suprimento insuficiente de proteínas. Pela semivida curta, a pré-albumina e a proteína de ligação ao retinol são bons marcadores da nutrição proteica atual, mas podem ser afetados por fatores não nutricionais. A combinação da hipofosforémia com o nível sérico elevado de fosfatase alcalina é o melhor indicador bioquímico precoce de doença óssea metabólica.
Eis alguns dos resultados mais representativos:
- Azoto ureico com valor baixo sugere suprimento proteico insuficiente. De salientar que valores moderadamente elevados são difíceis de interpretar, podendo indicar suprimento adequado de aminoácidos, baixo suprimento energético em relação ao proteico, ou intolerância aos aminoácidos.
- Pré-albumina e proteína de ligação ao retinol, pela semivida curta, constituem bons marcadores de nutrição proteica actual: valores baixos <> suprimento proteico insuficiente. De salientar, contudo, que os valores poderão ser afectados, quer no contexto de inflamação/infecção, quer no contexto de carência em ferro, zinco ou vitamina A.
- Transferrina sérica: tal como foi referido no âmbito do capítulo sobre anemia ferropénica, valor elevado <> carência em ferro, independentemente do estado de nutrição.
- Cálcio, fósforo e fosfatase alcalina: os respectivos valores séricos são em geral utilizados para avaliação da mineralização óssea. Salienta-se que o valor baixo da fosforemia corresponde a elevada especificidade para o diagnóstico de doença metabólica óssea (DMO). Quanto à fosfatase alcalina, níveis > 900 U/L associam-se a especificidade de 71% e a sensibilidade de 88% para DMO, o que é considerado limitação para o referido diagnóstico; no entanto, valores de fosforémia < 5,6 mg/dL (< 1,8 mmol/L) associados a fosfatase alcalina > 900 U/L, evidenciam sensibilidade de 100% e especificidade de 70%, o que confere a tal associação a característica de melhor marcador bioquímico precoce de DMO.
- Marcadores urinários de cálcio e fósforo: classicamente, poderão ser utilizados os parâmetros ratio cálcio/creatinina, fosfatúria e reabsorção tubular de fosfato; na prática, importa salientar que os referidos valores são influenciados pelo tipo de alimentação, quer da mãe, quer do filho.
Medições e técnicas
- Perímetro cefálico – Utilização de fita métrica inextensível de largura < 1 cm, bem aplicada em torno da cabeça, num plano – fronte, por cima das arcadas orbitárias – proeminência occipital – em posição que permita a leitura do valor máximo em três tentativas. Consultar curvas de crescimento.
- Perímetro braquial (lado esquerdo) – Utilização de fita métrica inextensível de largura < 1 cm, a meia distância entre o acrómio e o olecrânio; o membro superior deve ficar pendente com flexão do antebraço sobre o braço garantindo ângulo de 90°. (Consultar tabelas de Frisancho e bibliografia).
- Prega tricipital – Utilização de calibrador de espessura (por ex. calibrador de Harpenden) pregueando ou “pinçando” a pele previamente com os dedos, na região tricipital, a meia distância entre o acrómio e o olecrânio; a pressão exercida pelas pinças do calibrador deve ser constante.
- Peso – Pressupõe-se que a balança deve estar correctamente calibrada.
- Comprimento/estatura – Quer utilizando craveiras para bebés, quer estadiómetros para crianças maiores em quem se consiga a posição bípede estável, haverá necessidade de o observador ser ajudado por outra pessoa para evitar oscilação da bacia, garantindo membros inferiores em extensão completa, pés formando ângulo de 90° com as pernas sem arquear o dorso, cabeça no plano do tronco, e bordo inferior das órbitas no mesmo plano dos meatos auditivos.
Prognóstico e implicações futuras
Às condições GIG e macrossomia natal, independentemente de resultarem de diabetes materna, associam-se futuro risco de obesidade, de doença metabólica e de doença cardiovascular.
BIBLIOGRAFIA
Alberry M, Soothill P. Management of fetal growth restriction. Arch Dis Child Fetal Neonatal Ed 2007; 92: F62-7
Barker DJP. Fetal origins of cardiovascular disease. Ann Med 1999; 31: S3-S6
Beune IM, Bloomfield FH, Ganzevoort W, et al. Consensus based definition of growth restriction in the newborn. J Pediatr 2018; 196: 71-76.e1
Das UG, Sysyn GD. Abnormal fetal growth: intrauterine growth retardation, small for gestational age, large for gestational age. Pediatr Clin North Am 2004; 51: 639-654
DeFelice C, Tassi R, De Capua B, et al. A new phenotypical variant of intrauterine growth restriction? Pediatrics 2007; 119: e 983-e990
Eriksson JG. The fetal origins hypothesis- 10 years on. BMJ 2005; 330: 1096-1097
Fewtrell M, Michaelsen KF, van der Beek E, an Elburg R, eds. Growth in Early Life: Growth Trajectory and Assessment, Influencing Factors and Impact of Early Nutrition. Queensland: John Wiley & Sons Australia, 2016
Forsum EK, Flinke E. The body composition study group. Premature birth was not associated with increased body fatness in four‐year‐old boys and girls. Acta Paediatrica 2020; 109: 327-331. DOI: 10.1111/apa.14990
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Goto E. Maternal blood leptin concentration in small for gestational age: a meta-analysis. Eur J Pediatr 2019; 178: 763-770 https://doi.org/10.1007/s00431-019-03351-6
Gupta P, Ray M, Dua T, et al. Multimicronutrient supplementation for undernourished pregnant women and the birth size of their offspring. Arch Pediatr Adolesc Med 2007; 161: 58-64
Ibañez L, Potau N, Enriquez G, Marcos MV, de Zegher F. Hypergonadotrophinaemia with reduced uterine and ovarian size in women born small-for-gestational-age. Hum Reprod 2003; 18: 1565-1569
Kistner A. Does low birthweight matter? Editorial. Acta Paediatrica 2019; 109: 228-230. DOI: 10.1111/apa.15064
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
MacDonald MG, Seshia MMK (eds). Avery’s Neonatology: Pathophysiology and Management of the Newborn. Philadephia, PA: Lippincott Williamas & Wilkins, 2015
Martorell R, Stein AD, Schroeder DG. Early nutrition and later adiposity. J Nutr 2001; 131: 874S-880S
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Nold JL, Georgieff MK. Infant of diabetic mothers. Pediatr Clin North Am 2004; 5: 619-637
Olsen IE, Lawson ML, Meinzen-Derr J, Sapsford AL, Schibler KR, Donovan EF, et al. Use of a body proportionality index for growth assessment of preterm infants. J Pediatr 2009; 154: 486-491
Pereira-da-Silva L, Rosado L, Gomes-da-Costa MG, Sacramento-Monteiro ME, Antunes JA. Um caso de gigantismo cerebral (Síndrome de Sotos). Bol Clin Hosp Civis Lisboa 1985; 42: 23-27
Pereira-da-Silva L, Moura-Pires F, Rebelo I, Ferreira GC, Veiga M, Estrada J, Videira-Amaral JM, Monteiro MES. Evolução antropométrica do atraso de crescimento intrauterino simétrico. Resultados preliminares. Rev Port Pediatr 1990; 21: 427-434
Pereira-da-Silva L. Neonatal anthropometry: a tool to evaluate the nutritional status, and to predict early and late risks. In: Preedy VR, ed. The Handbook of Anthropometry: Physical Measures of Human Form in Health and Disease. Springer, New York, 2012, Chapt. 65; 1079-104
Pereira-da-Silva L. Nutrição e atraso de crescimento intrauterino. Nascer e Crescer 1993; 2: 97-99
Pereira-da-Silva L, Veiga Gomes J, Clington A, Videira Amaral JM, Bustamante SA. Upper arm measurements of healthy neonates comparing ultrasonography and anthropometric methods. Early Hum Dev 1999; 54: 117-128
Pereira-da-Silva L, Virella D, Videira-Amaral JM, Guerra A. Antropometria no Recém-Nascido: Revisão e Perspectiva Actual. Lisboa: Nestlé Nutrition Institute, 2007
Pereira-da-Silva L. Nutrição durante a gravidez e o crescimento fetal: Implicações imediatas e futuras. In: Cordeiro-Ferrreira G, Pereira-da-Silva L (eds). Intervenção Nutricional na Infância e Aspectos Preventivos. Lisboa: Nestlé Nutrition Institute, 2007; 1-18
Pereira-da-Silva L, Abecasis F, Virella D, Videira-Amaral JM. Upper-arm anthropometry is not a valid predictor of regional body composition in preterm infants. Neonatology 2009; 95: 74-79.
Pereira-da-Silva L, Virella D. Accurate direct measures are required to validate derived measures. Neonatology. 2018; 113: 266.
Raggal NME, Mohamed MH, Atef SH, Salem FA. Soluble vascular endothelial growth factor receptor-1 in intrauterine growth restricted neonates. J Neonatal Perinatal Medicine 2009; 2: 169-174
Sayer AA, Cooper C. Fetal programming of body composition and musculoskeletal development. Early Hum Dev 2005; 81: 735-744
Schegal A, Dahlstrom JE, Chandy Y, et al. Placental histopathology in preterm growth restriction. J Paediatr Child Haelth 2O19; 55: 582-587
Smarr MM. Vadillo-Ortega F, Castillo-Castrejon M, et al. The use of ultrasound measurements in environmental epidemiological studies of air pollution and fetal growth. Curr Opin Pediatr 2013; 25: 240-246
Takayanagi T, Shichijo A, Egashira M, et al. Extrauterine growth restriction was associated with short stature and thinness in very low birthweight infants at around six years of age. Acta Paediatr 2019; 108: 112-117
Vural I, Ozdemir H, Teker G, et al. Delayed cord clamping in term large for gestational age infants. J Paediatr Child Haelth 219; 55: 555-560