Introdução
Entre as arboviroses tropicais, surgem três entidades clínicas de grande importância epidemiológica e de saúde pública, sobretudo na América Latina, transmitidas pelo mosquito Aedes. Trata-se da Dengue, da Doença por vírus Chikungunya e da Doença por vírus Zica. A Dengue, depois da Malária, é considerada a mais importante doença transmitida por vector na actualidade. Recorda-se, a propósito, a definição de Arbovírus <> abreviatura do termo em Inglês-arthropod-borne virus.
Neste capítulo é dada ênfase à Dengue, e à Doença por vírus Chikungunya. A Doença por vírus Zica é abordada no Capítulo sobre Infecção Congénita, na Parte sobre Perinatologia e Neonatologia (XXXI).
DENGUE
Definição
A dengue, incluída no grupo das chamadas febres hemorrágicas víricas, é uma doença infecciosa aguda transmitida ao homem pela picada do mosquito, vector do género Aedes infectado com o vírus da dengue, vírus de RNA da família Flaviridae, género Flavivirus, com 4 serótipos, DEN-1, DEN-2, DEN-3 e DEN-4.
Frequentemente autolimitada e benigna, a doença pode, no entanto, assumir formas graves e fatais, com número crescente da forma clínica chamada dengue grave, na actual nomenclatura, com uma mortalidade ~ 2,5%.
Aspectos epidemiológicos e importância do problema
A nível mundial estima-se que ocorram anualmente 50 a 100 milhões de novos casos, englobando cerca de 500 mil novos casos de dengue grave. Cerca de 2.500 milhões de pessoas no mundo encontram-se em situação de risco de padecer da doença, o que é explicável sobretudo pelo crescimento populacional, pela urbanização não planificada, pelo inadequado ordenamento ambiental, pela migração e turismo, e pelas alterações climáticas.
A doença é endémica em mais de 100 Países distribuídos predominantemente pelas grandes regiões do globo – África, América do Sul, Mediterrâneo Oriental, Sueste Asiático e Pacífico Oeste. Em 2010, de acordo com dados da OMS, surgiram em todo o mundo cerca de 390 milhões de casos de dengue. No Brasil, num surto ocorrido em 2013, foram notificados 1,5 milhões de casos, 7.000 dos quais corresponderam a formas graves.
Na Europa, em 10 países, têm sido descritos casos importados, sobretudo do Sueste Asiático, realçando-se o primeiro caso fatal surgido no Reino unido em 1997. No continente europeu têm sido relatados anualmente entre 100 e 170 casos importados, quase metade originados no Sueste Asiático.
Quanto a casos autóctones na Europa, importa referir o seu surgimento recente na França e Croácia.
Em Portugal, na Região Autónoma da Madeira (RAM), o vector Aedes aegypti foi detectado pela primeira vez em 2004; o primeiro surto, notificado em 2012, manteve-se até 2013, tendo sido identificado o serótipo DEN-1 com origem na Venezuela, Colômbia e Norte do Brasil.
Até à data, em Portugal Continental ainda não foram identificados mosquitos do género Aedes, pelo que não parece existir o risco de emergência de casos autóctones.
Refira-se que o Aedes aegypti e o vírus da dengue são endémicos em todos os continentes excepto na Europa e na Antártida; a dengue grave ocorre preferencialmente na Ásia e Américas. (Figura 1)
Etiopatogénese
A doença é causada por qualquer dos serótipos do vírus anteriormente descritos (DEN 1, 2, 3 e 4). Actualmente já se conhecem mutantes, mas o respectivo impacte clínico não está ainda estabelecido.
A infecção por um serótipo produz imunidade específica permanente e, ainda que não imunidade cruzada para os outros serótipos, pode verificar-se imunidade cruzada heterotípica, a qual se pode manter entre 2 e 12 meses.
Os vírus são transmitidos por um eficiente vector existente em extensas áreas do Globo, particularmente em regiões tropicais e subtropicais. O mosquito/artrópode Aedes aegypti, mais frequente nas Américas e a principal espécie responsável pela transmissão a nível mundial, tem hábitos diurnos, domésticos e preferência por recipientes com água onde deposita ovos e larvas; um único mosquito infectado pode transmitir o vírus a vários indivíduos numa pequena área.
Importa referir que o artrópode a seguir, em importância, é o Aedes albopictus (Figura 2), confinado ao Sueste Asiático. Noutras regiões têm papel mais reduzido o Aedes polynesiensis e o Aedes scutellaris (Figura 3).
A transmissão do vírus da dengue por picada do artrópode infectado (originando virémia) depende da estirpe do mesmo vírus, do vector, da susceptibilidade da população e dos factores ambientais já descritos anteriormente.
Pode verificar-se transmissão vertical se a picada se verificar na grávida (durante a fase virémica da doença), com potencial impacte no recém-nascido. Em diversos estudos não foram notados efeitos lesivos, designadamente quanto a baixo peso e/ou defeitos congénitos.
O ciclo biológico é iniciado quando a fêmea do mosquito ingere o sangue da pessoa infectada em fase de virémia; esta ingestão leva à infecção do epitélio do intestino médio do mosquito e disseminação pela hemolinfa atingindo outros órgãos, como as glândulas salivares e o sistema reprodutivo do mesmo.
Geralmente decorrem 7 a 10 dias entre a ingestão do sangue contaminado e a eliminação do vírus pela saliva, sendo esta fase designada por período de incubação extrínseco. A duração deste período é inversamente proporcional à temperatura ambiente; aduza-se que, uma vez infectado, o mosquito carrega o vírus até ao fim da sua vida.
Uma vez transmitido o vírus ao humano por picada do mosquito infectado (vírus na saliva do mosquito), existe um período de incubação intrínseco sem sintomas com a duração média de 4-7 dias e limites entre 2-14 dias: surgindo então replicação vírica no órgão-alvo, atingimento dos leucócitos e tecidos linfáticos, a que se segue a virémia.

FIGURA 1. Aedes aegypti.

FIGURA 2. Aedes albopictus.
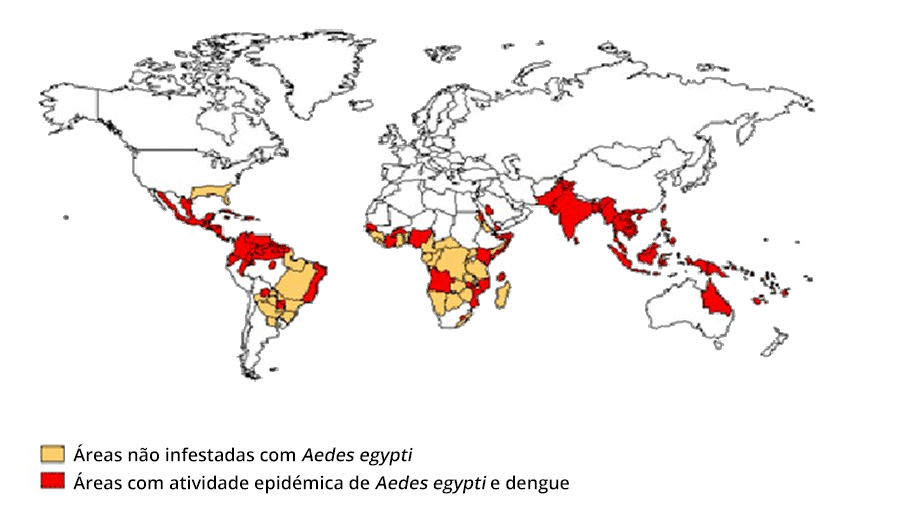
FIGURA 3. Epidemiologia da infecção pelo vírus da dengue.
Trata-se, pois, dum processo de transmissão homem-mosquito-homem.
A transmissão do vírus entre mosquito e primatas não humanos foi demonstrada na Ásia e África, mas não está provado que desta transmissão a primatas não humanos resulte potencial reservatório para a transmissão a humanos. Cabe referir que há relatos de transmissão através do sangue e de exposição mucocutânea.
Sobre a patogénese importa salientar que a dengue é uma doença sistémica, com atingimento de vários órgãos e sistemas, largo espectro de manifestações, desde formas assintomáticas e oligossintomáticas, a formas graves que podem ser fatais.
Devido à sua característica hepatotrófica, o vírus exerce acção citopática mais acentuada ao nível dos hepatócitos, replicando-se nas células de Kupffer (que fazem parte do sistema mononuclear fagocítico), do que resulta citólise com aumento das aminotransferases, directamente proporcional à magnitude do dano. A hepatomegália é frequente, podendo verificar-se insuficiência hepática.
Outros órgãos atingidos são o coração (por mecanismo imunomediado), o pulmão (sede de edema pulmonar) e o sistema nervoso central. As manifestações neurológicas podem ter como substracto diversos quadros, tais como, de encefalite, síndroma de Guillain-Barré, mielite transversa, etc..
As manifestações hemorrágicas surgem de modo esporádico e em grau variável. A este propósito, importa referir que a clássica designação de “dengue hemorrágica” passou a ser considerada errónea, por levar a pensar que a hemorragia era sinal cardinal de gravidade: na verdade, a principal causa de mortalidade é, sim, a extravasão de plasma por aumento da permeabilidade capilar, levando a choque. De facto, reforça-se a noção de que, o que diferencia as formas graves das mais ligeiras, é a verificação do aumento da permeabilidade capilar nas primeiras.
Demonstrou-se que o efeito duma segunda infecção (infecção secundária) tem efeito patogénico 100 vezes superior ao verificado durante um primeiro episódio da infecção (infecção primária). Ou seja, a exposição prévia do hospedeiro a um serótipo heterólogo predispõe a forma grave, o que poderá ser explicado pela teoria da imunopotenciação mediada por anticorpos (ADE, antibody dependent enhancement). Esta teoria postula o seguinte:
- Aquando dum estímulo antigénico inicial (primeira infecção ou infecção primária) verifica-se sensibilização do sistema imune envolvendo linfócitos T e B;
- Os pacientes sensibilizados a determinado serótipo do vírus desenvolvem anticorpos incapazes de neutralizar os outros serótipos, mas facilitando o ingresso do vírus no monócito;
- Os anticorpos heterólogos correspondentes ao serótipo da dengue pré-existente (infecção primária) reconhecem de forma cruzada o novo vírus infectante, doutro serótipo (infecção secundária), não o neutralizando; aliás, formam complexos antigénio-anticorpo, os quais se ligam ao receptor Fc para imunoglobulina nos macrófagos, facilitando assim o ingresso do vírus na célula, onde se vai replicar;
- Aquando duma segunda infecção ou infecção secundária, verifica-se uma rápida activação e proliferação das células T e monócitos previamente sensibilizados (resposta imunitária ampliada), com lise dos monócitos infectados pelos vírus da dengue, libertação de mediadores inflamatórios e procoagulantes como interleucinas, factor de necrose tumoral, factor activador das plaquetas, interferão gama, e consequente aumento da permeabilidade vascular com extravasão de plasma, hipovolémia e hipotensão.
Comprovou-se que os linfócitos T têm um papel preponderante no processo descrito devido a resposta aberrante.
A imunidade é duradoura, mas serótipo-específica. A resposta humoral é vigorosa: são detectados anticorpos específicos da classe IgM (contra o serótipo infectante) após o quarto dia de início dos sintomas; os referidos anticorpos atingem níveis elevados cerca de 7-8 dias após o início dos sintomas, declinando lentamente e passando a não ser detectáveis após alguns meses.
Quanto à IgG específica, os seus níveis elevam-se após o quarto dia de sintomas, atingindo altos teores em duas semanas, passando a ser detectáveis por vários anos (Figura 4).
Para além da importância de se tratar de infecção primária e infecção secundária, na patogénese há ainda que considerar os seguintes factores:
- Factores relacionados com os vírus. Demonstrou-se que o serótipo 2, o mais virulento de todos, está ligado às formas graves acompanhadas de choque, frequentes no Sueste Asiático; ainda há que atender aos factos de: – determinado serótipo poder incluir diversos genótipos; e de – haver variação importante entre as estirpes de determinado serótipo;
- Particularidades quanto a serótipos infectantes. Em estudos epidemiológicos verificou-se que a gravidade da doença é maior quando o serótipo 1 é seguido do serótipo 2;
- Outros factores patogénicos incluem: – susceptibilidade do foro genético do hospedeiro, variável; – idade do paciente, sendo que o prognóstico é mais reservado em crianças com < 5 anos e gravidade, e menor gravidade após os 12 anos; – género feminino, mais susceptível; -doença crónica de base associada a pior prognóstico.
Manifestações clínicas e laboratoriais
A dengue é uma doença sistémica cujo espectro inclui formas graves e não graves. Na idade pediátrica, parcela significativa de pacientes pode apresentar-se sob a forma oligossintomática, o que torna difícil o diagnóstico diferencial com outras doenças víricas comuns nesta faixa etária.
Após o período de incubação variável – como média entre 5 e 10 dias – (ver atrás) a doença apresenta-se abruptamente e pode manifestar-se em 3 fases: 1- febril; 2- crítica; 3- de recuperação ou convalescença.
Fase febril: manifesta-se com febre de início abrupto, em geral durando 2 a 7 dias.
Fase crítica: febre desaparecendo em lise (defervescência). Nesta fase, os doentes poderão melhorar ou piorar. Os que melhoram, evidenciam quadro designado por dengue sem sinais de alarme; os que pioram, correspondem aos casos de dengue com sinais de alarme.
Fase de recuperação ou convalescença: produz-se a reabsorção gradual dos fluidos do espaço extravascular nas 48-72 horas seguintes. Verifica-se estabilização hemodinâmica, melhoria da diurese e diminuição do hematócrito por reabsorção dos fluidos. Seguidamente, elevação do número dos leucócitos e das plaquetas. (Figura 5)
Classificação da dengue
De acordo com a última revisão da classificação da OMS (de 2009), são consideradas as seguintes formas clínicas: Dengue sem sinais de alarme; Dengue com sinais de alarme; e Dengue grave.
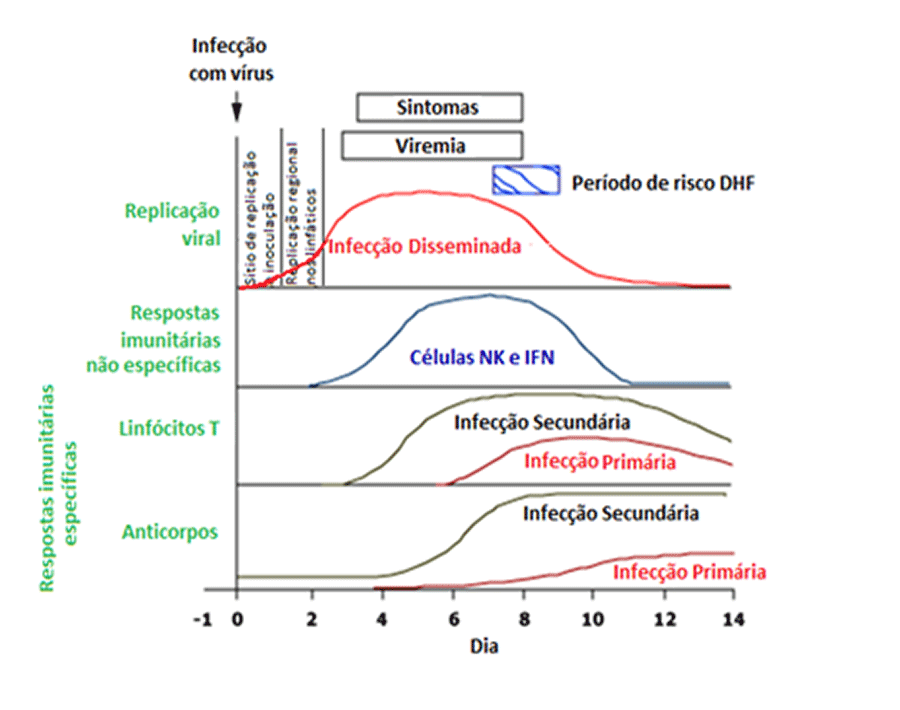
FIGURA 4. Evolução clínica e resposta imunitária ao vírus da dengue.
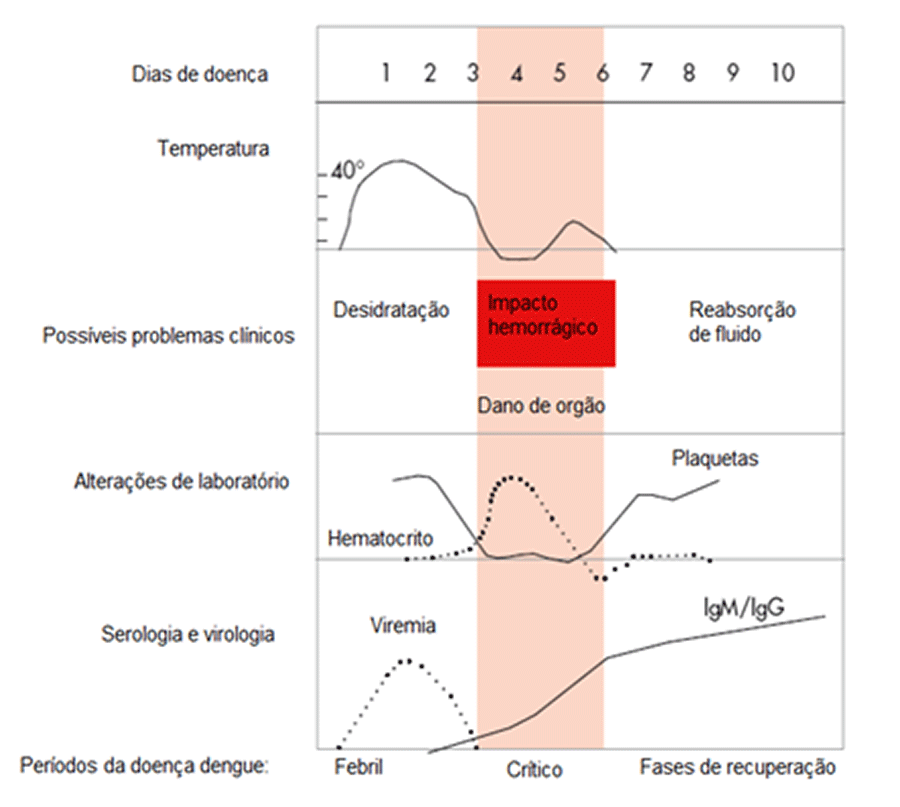
FIGURA 5. Diagnóstico e manifestações clínicas da dengue.
Dengue sem sinais de alarme
Nesta forma clínica poderão surgir os seguintes sinais e sintomas: febre, letargia, hiperestesia cutânea, injecção conjuntival, cefaleia frontal e/ou retro-orbitária intensificando-se com o movimento dos olhos; mialgia generalizada, mais intensa na região lombar; linfadenopatia cervical; exantema morbiliforme em cerca de 50% dos casos atingindo face, tronco, e membros, não poupando plantas dos pés e palmas das mãos; pode surgir hiperémia difusa com áreas esbranquiçadas arredondadas de pele normal, prurido e sensação de “calor”; a prova de Rumpell-Leed é positiva (aparecimento de 20 ou mais petéquias numa área de 2,5 cm2 após insuflação de braçadeira de esfigmomanómetro no braço com valor da média aritmética das pressões sistólica e diastólica durante 5 minutos).
Em zonas endémicas ou nos casos em que se verificou viagem para as mesmas, suspeitar-se-á de dengue ante a presença de febre associada a dois ou mais dos seguintes critérios: náuseas, vómitos, exantema, artralgias, petéquias ou prova de Rumpell-Leed positiva e leucopénia.
Dengue com sinais de alarme
Num doente: – que esteja febril ou, – que esteja na fase de defervescência, e se verifique um dos sinais de alarme descritos a seguir, tal significa que se trata de situação acompanhada de aumento da permeabilidade capilar nesse momento.
Descrevem-se os seguintes sinais de alarme:
- Dor abdominal intensa e contínua, por vezes localizada ao hipocôndrio direito, correspondendo a sinal de líquido extravasado para zonas renais e perirrenais;
- Vómitos persistentes ( > 3 em 1 hora, ou > 5 em 6 horas);
- Hemorragias das mucosas (gengivorragias, epistaxes, hematúria, hematemeses, melenas, hemorragias vaginais);
- Alteração da consciência (agitação ou letargia, escala de Glasgow < 15);
- Aumento do hematócrito com diminuição brusca do número de plaquetas;
- Hepatomegália (> 2 cm abaixo do rebordo costal);
- Acumulação de líquidos/derrames cavitários (derrame pleural, ascite, derrame pericárdico detectados clinicamente ou por ecografia, não associados a dificuldade respiratória nem a compromisso hemodinâmico.
Dengue grave
Esta forma clínica é definida pela verificação dos seguintes critérios:
- Choque por extravasão de plasma e/ou acumulação de líquidos, associado a dificuldade respiratória;
- Hemorragia grave;
- Atingimento grave de órgãos (fígado: citólise, elevação de ALT e AST > 1.000 U/mL, insuficiência hepática; SNC: encefalite, alterações sensitivas; coração: miocardiopatia).
O choque, que pode ser precedido por sinais de alarme e a principal causa de morte, surge quando desaparece a febre, entre o 4º e 5º dia de doença. A gravidade deste quadro de dengue poderá também integrar, com incidência baixa, síndroma de Reye, síndroma de dificuldade respiratória tipo adulto.
Exames complementares
Em contexto de epidemia, o exame clínico rigoroso é em geral suficiente para diagnosticar a maioria dos casos. Noutras circunstâncias, dada a variedade de sintomas, em geral inespecíficos, associados a esta entidade, o diagnóstico clínico não é muito confiável. Nesta perspectiva, há que recorrer a exames complementares.
Os principais métodos diagnósticos são: o isolamento do vírus, a identificação de serótipos, a detecção de ácido nucleico, a detecção de antigénios e a enzimoimunoanálise (ELISA) para provas serológicas.
Em Portugal, o Instituto Nacional de Saúde Ricardo Jorge (INSA) é o laboratório de referência para o diagnóstico laboratorial da dengue, que se faz através de:
- Pesquisa de anticorpos específicos: detecção de IgM por ELISA na fase aguda da doença (no sangue ou SNC) presentes após o quinto dia de início do quadro clínico ou subida de 4 vezes do título de IgG entre a data da amostra colhida logo após o princípio dos sintomas, e uma segunda, obtida cerca de duas semanas depois (2 mL de sangue em tubo seco ou 1 mL de líquor);
- Pesquisa de componentes víricos/ácidos nucleicos a realizar até ao 5º dia da doença por meio da reacção em cadeia da polimerase com transcriptase reversa (RT-PCR) no sangue ou LCR (2 mL de sangue em tubo com EDTA);
- Todas as amostras positivas colhidas em laboratórios públicos ou privados devem ser enviadas (refrigeradas no próprio dia ou mantidas no frigorífico se não for possível) para o INSA, acompanhadas por formulário preenchido para estudo epidemiológico e virológico. Os casos devem ser notificados à Direcção-Geral da Saúde (dengue@dgs.pt).
No que respeita à avaliação laboratorial podem ainda ser úteis os exames complementares e procedimentos a seguir descritos:
- Hemograma: é um exame importante a ser feito aquando da primeira observação. A verificação de leucopénia reforça o diagnóstico provável de dengue. Uma diminuição do número de plaquetas, associada a uma elevação do hematócrito, sugere extravasamento de plasma. Se o hematócrito não tiver sido registado no início deve ser efectuado o cálculo da variação do seu valor utilizando os valores de referência da população geral, ajustados à idade e sexo;
- Transaminases: elevação de AST e ALT, observada em 30% dos pacientes com dengue em geral, e em cerca de 90% dos casos de dengue grave;
- Ecografia: útil para identificar a presença de líquido livre em cavidade abdominal ou espaço pleural, ou ainda para detectar derrame pericárdico ou sinais de espessamento da parede da vesícula biliar.
Diagnóstico diferencial
A dengue pode confundir-se com diversas infecções bacterianas, parasitárias e víricas, tais como doença meningocócica, choque séptico, febre tifóide, escarlatina, sarampo, rubéola, gripe, doenças por enterovírus, herpes vírus, parvovírus B19, leptospirose, hepatite, malária, febre amarela, febre e outras infecções por Flavivirus. Obviamente que no âmbito raciocínio clínico importa valorizar a região onde decorreu o caso.
A dor abdominal intensa poderá ser confundida com apendicite aguda, colecistite aguda e perfuração intestinal. A febre, a polisserosite, a hemoconcentração, a trombocitopénia e a ausência de compromisso renal permitem estabelecer a destrinça entre dengue e outras febres hemorrágicas.
Para finalizar o tópico sobre diagnóstico diferencial, importa uma referência a três infecções víricas transmitidas por artrópodes tal como a dengue, ocorrendo noutras latitudes (África, Ásia, América Latina, Estados Unidos e Médio Oriente). São consideradas pela patogénese e pelas afinidades quanto às manifestações clínicas, doenças simile dengue; trata-se: – da febre Chikungunya, por Togavirus, transmitida por Aedes aegypti e Aedes albopictus; – da infecção por vírus ZICA (ZICV), da família Flaviviridae, transmitida por Aedes aegypti e Aedes albopictus; – da febre O’nyong-nyong, por Togavirus, transmitida por Anopheles funestus; e – da febre do Nilo/West Nile, por Flavivirus, transmitida por Culex molestus ou Culex univittatus.
Tratamento
Não existe tratamento específico. A doença deve ser tratada com medidas sintomáticas; o tratamento da febre deverá ser feito apenas com paracetamol, estando o ibuprofeno e outros AINE contraindicados.
Na dengue grave a perda de líquidos para o espaço extravascular é o determinante fisiopatológico mais importante, sendo fundamental iniciar precocemente a reposição de volume (com hidratação venosa vigorosa) quando se verifica esta situação.
Sobre o tratamento da reidratação e do choque aconselha-se a consulta de capítulos próprios abordando estas temáticas.
Prevenção
A prevenção deve ser feita:
- Pelo controlo do vector, destruindo-o na fase larvar do ciclo de vida dos mosquitos e eliminando-o na fase adulta dos mosquitos; – por educação ambiental, eliminando locais de águas estabilizadas e detritos urbanos, utilizando repelentes com N-dieSl-metatoluamida (DEET), usando vestuário apropriado (roupas frescas, claras, que cubram a maior área possível), optando por alojamentos com ar condicionado e redes mosquiteiras;
- Por estratégias de comunicação/informação às populações, com utilização de diferentes meios de divulgação, informação precisa e concisa, não alarmista, sobre medidas que potenciem a diminuição da densidade de mosquitos e medidas a tomar nas viagens/estadias/residência, educação para a saúde nas escolas de ensino básico e secundário;
- Outras medidas de controlo incluem identificação de locais propícios para criadouros e larvas, identificação das empresas registadas como estando a trabalhar na actividade de desinfestação, recenseamento dos locais de cultivo de plantas para exportação, identificação de residências abandonadas/devolutas ou não habitadas em permanência que contenham criadouros de mosquitos;
- Por vacinação: o método ideal, incluindo os 4 serótipos, conferindo imunidade perene ainda não se encontra disponível; uma vacina viva atenuada recombinante CYD-TDV – está actualmente na fase II de investigação.
DOENÇA POR VÍRUS CHIKUNGUNYA
Definição e aspectos epidemiológicos
Esta doença, provocada pelo vírus Chikungunya (CHKV), também conhecida por febre Chikungunya (palavra que significa “aqueles que se dobram” num dialecto da Tanzânia, fazendo referência ao andar curvado das pessoas acometidas por essa doença que “provoca dores”), foi descoberta pela primeira vez em 1953 na Tanzânia durante uma epidemia de doença febril. Verificando-se posteriormente várias epidemias intervaladas entre 2 e 20 anos na África e Ásia, a partir de 2004 adquiriu características de expansão global afectando milhões de pessoas até à actualidade.
Uma das epidemias mais conhecidas ocorreu na Ilha da Reunião em 2005, afectando mais de 300.000 casos, com 219 mortes. Posteriormente foram registados surtos na Itália, França, Canadá, Brasil, Estados Unidos e Guiana. Mais recentemente, em 2013, na Ilha de San Martin, Caraíbas, comprovou-se a existência de casos autóctones.
Determinados factores predisponentes, tais como as condições climáticas, a presença de artrópode vector e uma população susceptível sob o ponto de vista imunológico influenciaram a disseminação da doença no continente americano.
Etiopatogénese
Trata-se duma arbovirose produzida por um vírus ARN pertencente ao género Alphavirus e uma das 29 espécies da família Togaviridae. Após a picada do mosquito (especialmente da família Aedes) infectado pelo vírus, este transmite-se aos fibroblastos e macrófagos dérmicos, replicando-se nesta localização. Disseminando-se ulteriormente pelos nódulos linfáticos, passam para a circulação originando virémia. Seguidamente, com nova disseminação, são atingidos os órgãos periféricos, designadamente, os músculos, o baço, continuando a replicação.
Neste processo, foram identificadas diversas fases: aguda, subaguda e crónica. Estão documentadas infecções pré-natal, perinatal e formas atípicas da doença.
Para além da transmissão do vírus pelo mosquito, estão descritos casos de transmissão através de transfusões de sangue.
O Homem é o reservatório principal; secundariamente, alguns vertebrados.
Manifestações clínicas
O período de incubação oscila entre 3 e 7 dias. A percentagem de casos assintomáticos varia entre 3% e 28%. Nos indivíduos sintomáticos as manifestações mais típicas na fase aguda são: febre alta de início abrupto podendo durar 7 dias, poliartralgias simétricas, frequentemente incapacitantes, sobretudo ao nível das mãos e pés, zonas proximais, e exantema maculopapular pruriginoso atingindo as palmas das mãos e plantas dos pés.
Têm sido descritos outros sinais e sintomas, tais como: astenia, cefaleia, mialgias, dores torácicas, náuseas, vómitos, conjuntivite, faringite e linfoadenopatias.
Poderá surgir uma fase subaguda ou pós-aguda, iniciada após os 21 dias e prolongando-se por 2 a 3 meses, rara na idade pediátrica, caracterizada essencialmente por poliartralgias incapacitantes associadas a tenossinovites.
Descreve-se ainda uma fase crónica, com artralgias acentuadas e incapacitantes, de duração superior a 3 meses, também rara em idade pediátrica.
Existe uma forma clínica de infecção perinatal por CHIKV: quando uma mãe está sintomática no período periparto (entre 4 dias antes e 1 dia após o parto), o risco de transmissão vertical do vírus é de 50%. Em tal circunstância, as manifestações clínicas no RN surgem em geral cerca de 4 a 9 dias após o parto: febre, edema nas extremidades, irritabilidade, prostração, recusa alimentar e exantema. A médio e longo prazo poderá verificar-se alteração no neurodesenvolvimento, convulsões, e paralisia cerebral.
Diagnóstico
O diagnóstico baseia-se em critérios clínicos, epidemiológicos e laboratoriais. Os critérios clínicos e epidemiológicos permitem identificar, respectivamente, caso possível e caso provável
Critérios clínicos: febre de início abrupto > 38,5ºC e artrite ou artralgia acentuada; nesta circunstância faz-se o diagnóstico diferencial com dengue, malária endémica ou doença com artrite (caso possível).
Critérios epidemiológicos: residência em, ou visita a, área endémica dentro do período de 15 dias precedendo o início de sintomas (caso provável).
Critérios laboratoriais: fundamentalmente, importa avaliar os seguintes parâmetros: isolamento do vírus, presença de ARN vírico, anticorpos (IgM específica e IgG com títulos determinados seriadamente em períodos separados 2 a 3 semanas. Bastará a positividade de apenas 1 (caso confirmado).
Quanto às provas laboratoriais como instrumento de avaliação citam-se: PCR-RT (reacção em cadeia da polimerase com transcriptase inversa) para identificação de virémia, a realizar nos primeiros 5-7 dias após início dos sintomas; provas serológicas para IgM e IgG, sendo de anotar que com as provas serológicas se poderá verificar reactividade antigénica cruzada com outros arbovírus.
Diagnóstico diferencial
Faz-se com as seguintes situações: dengue, zica, malária, leptospirose, influenza, febre amarela, sépsis, rubéola, sarampo, e infecções por alfaviroses (vírus Mayaro, Ross River, Barmah Forest, O´nyong e Sindbis).
Prevenção e tratamento
Como medidas preventivas gerais citam-se as seguintes:
- Evitar picadas de mosquitos, limitando a exposição aos mesmos;
- Restringir as viagens a áreas endémicas, incluindo, claro, das grávidas;
- Usar vestuário protector e repelentes de insectos;
- Providenciar ambiente interior com ar condicionado.
Quanto ao tratamento, perante a inexistência de fármacos anti- CHIKV, são adoptadas medidas gerais de suporte. A hospitalização está indicada perante: febre alta > 5 dias, sintomatologia neurológica, irritabilidade, vómitos, oligúria, quadro clínico em RN e presença de comorbilidade.
INFECÇÃO POR VÍRUS ZICA
Consultar Capítulo “Infecção Congénita” na Parte sobre Perinatologia e Neonatologia (XXXI).
BIBLIOGRAFIA
Alves JGB, Ferreira OS, Maggi RRS, Correia JB. Fernando Figueira Pediatria (eds). Rio de Janeiro: Medbbok Editora, 2011
Biswal S, Reynales H, Saez‐Llorens X, et al. Efficacy of a tetravalent dengue vaccine in healthy children and adolescents NEJM 2019;381:2009-2019. DOI:10.1056/NEJMoa1903869
Castro L, Marçal F, Gonçalves J, Oliveira J, et al. Dengue em Portugal – Experiência da Região Autónoma da Madeira. Acta Pediatr Port 2014;45:198-203
Cherry J, Demmler-Harrison GJ, Kaplan SL, Steinbach WJ, Hotez P (eds). Feigin and Cherry’s Textbook of Pediatric Infectious Diseases. Philadelphia: Elsevier Saunders, 2014
Deseda CC. Epidemiology of Zica. Curr Opin Pediatr 2017;29:97-101
Direcção Geral da Saúde/DGS. Abordagem de casos de Dengue. Orientação da DGS nº 14/2012.http: // www.dgs.pt/upload/membro. id/ficheiros/i017887.pdf
Direcção Geral da Saúde/DGS. Casos de dengue na Região Autónoma da Madeira – actualização 10/10/ 2012. Comunicado nº 46.03.v1. http://www.dgs.pt
Elling R, Henneke P, Hatz C, et al. Dengue fever in children: where are we now? Pediatr Infect Dis J 2013;32:1020-1022
Farhat CK, Carvalho LHFR, Succi RCM. Infectologia Pediátrica. São Paulo: Atheneu, 2008;569-580
Gabaglia CR. Zica virus and diagnosis. Curr Opin Pediatr 2017;29:107-113
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Gjenero-Margan I, Aleraj B, Krajcar D, et al. Autochthonous dengue fever in Croatia, August–September 2010. Euro Surveill. 2011;16(9):pii=19805
Goldman L, Schafer AI (eds). Goldman – Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Halstead SB. Controversies in dengue pathogenesis. Pediatr Int Child Health 2012;32 (Suppl 1):5-9
Harapan H, Michie A, Mudatsir M. et al. Chikungunya virus infection in Indonesia: a systematic review and evolutionary analysis. BMC Infect Dis 19, 243 (2019). https://doi.org/10.1186/s12879-019-3857-y
Honein MA, Cetron MS, Meaney-Delman D. Endemic Zika virus transmission: implications for travellers. Lancet Infect Dis 2019;19:349-351
Jelinek T. Trends in epidemiology of dengue fever and their relevance for importation to Europe. Euro Surveill. 2009;14(25):pii=19250
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: McGraw Hill Education, 2018
La Ruche G, Souarès Y, Armengaud A, et al. First two autochthonous dengue virus infections in metropolitan France. Euro Surveill 2010;15(39):pii=19676
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
MacDonald MG, Seshia MMK (eds). Avery’s Neonatology: Pathophysiology and Management of the Newborn. Philadelphia, PA: Lippincott Williams & Wilkins, 2015
Martins KA, Gregory MK, Valdez SM, et al. Neutralizing antibodies from convalescent Chikungunya virus patients can cross-neutralize Mayaro and Una viruses. Am J Trop Med Hyg 2019;100:1541-1544. doi: 10.4269/ajtmh.18-0756
Moro M, Málaga S, Madero L (eds). Cruz tratado de Pediatria. Madrid: Panamericana, 2015
Oeser C, Ladhani S. An update on Zika Virus and congenital Zika Syndrome. Paediatr Child Health 2019;29:34-37
Pawitan JA. Dengue virus infection: predictors for severe dengue. Acta Med Indones 2011;43:129-135
Poland GA, Ovsyannikova IG, Kennedy RB. Zika vaccine development: current status. Mayo Clin Proc 2019;94:2572-2586
Ranjit S, Kissoon N. Dengue hemorrhagic fever and shock syndromes. Pediatr Crit Care Med 2011;12:90-100
Ritz N, Hufnagel M, Gerardin P. Chikungunya in children, Pediatr Infect Dis J 2015;34:789-791
Rolph FJ, Rulli NE, et al. Diagnostic criteria for chikungunya virus fever. Lancet 2012;379:662-668
Rothman AL, Srikiatkhachorn A, Kalayanarooj A. Clinical presentation and diagnosis of dengue virus infections. http//www.uptodate.com.
Rothman AL. Epidemiology of dengue virus infections. http://www.uptudate.com.
Secretaria de Estado de Saúde/SES do Rio de Janeiro. Dengue: cenário epidemiológico e perspectiva para o ano de 2016. R Janeiro: SES, 2015
Simmons CP, Farrar JJ, Nguyen VV, et al. Dengue. N Engl J Med 2012;366:1423-1432
Weaver S, Lecuit M. Chikungunya virus and the global spread of a mosquito-borne disease. N Engl J Med 2015;372:1231-1239
Wichit S, Hamel R, Zanzoni A, et al. SAMHD1 enhances Chikungunya and Zika virus replication in human skin fibroblasts. Int J Mol Sci 2019 Apr 5;20(7). pii: E1695. doi: 10.3390/ijms20071695
Wichmann O, Jelinek T. TropNetEurop: Surveillance of imported dengue infections in Europe. EuroSurveill 2003;7(32):pii=2271
World Health Organization/ WHO. Dengue: guidelines for treatment, prevention and control. Geneve: WHO, 2009
Yacoub S, Mongkolsapaya J, Screaton G. The pathogenesis of dengue. Curr Opin Infect Dis 2013;26:284-289