Definição e importância do problema
A febre escaronodular (FEN), designação dada por Ricardo Jorge em Portugal em 1930, também conhecida por febre botonosa ou febre exantemática mediterrânica, é uma doença infecciosa aguda causada pela bactéria Rickettsia conorii.
Trata-se duma zoonose (doença transmitida de animal vertebrado para o Homem), característica dos meses quentes nos países mediterrânicos. Nos últimos anos, especialmente no sul da Europa, parece existir um recrudescimento da doença, provavelmente devido ao maior número de cães nas cidades, à maior mobilidade das populações, bem como às alterções climáticas, e em particular à menor pluviosidade.
Aspectos epidemiológicos
A FEN, a riquetsiose mais frequente nos países do sul da Europa, é especialmente prevalente nos países mediterrâneos desde Espanha até Israel, embora também se verifique em África, Índia e Sudoeste Asiático. Em Portugal, é a zoonose mais prevalente; entre 2010 e 2013 foram declarados 564 casos, na sua maioria entre os meses de Julho e Setembro, dos quais 208 até aos 14 anos (36,8% do total). Todavia, o número real de casos de doença deve ser bem superior, pois a notificação da doença nem sempre é levada a cabo, em especial nos serviços de urgência, local onde o diagnóstico é geralmente realizado.
O maior número de casos verifica-se no Verão e princípio do Outono embora nalgumas regiões a doença possa ser transmitida noutras épocas do ano permitindo, em função das condições climáticas, que o vector se mantenha activo fora da época estival. Refira-se que a carraça somente transmite a infecção se permanecer entre 6-20 horas em contacto com a pessoa, o que acontecerá se as medidas de higiene básica forem precárias.
Etiopatogénese
Rickettsia conorii, o agente infectante, é uma bactéria gram-negativa intracelular obrigatória, com uma forma coco-bacilar que se multiplica por divisão binária. Na bacia mediterrânica o principal vector é o ioxídeo conhecido por carraça do cão (Rhipicephalus sanguineus) em estádios de desenvolvimento diversos – larva, ninfa ou adulto. Os principais reservatórios são os cães, raposas, lebres e outros roedores. Na carraça (a qual funciona também como reservatório), a bactéria pode alojar-se nas células de múltiplos órgãos, incluindo os ovários. O organismo humano constitui um hospedeiro acidental.
A doença transmite-se ao organismo humano pela picada da carraça infectada enquanto esta efectua a sua refeição sanguínea, ou através da contaminação de mucosas com macerados de ioxídeos infectados. Depois da picada, Rickettsia conorii provoca lesão da íntima e a média dos vasos, desencadeando no organismo humano fenómenos de vasculite, com infiltrado perivascular rico em linfócitos e histiócitos. Neste processo inflamatório são notórios: activação das plaquetas, aumento de tromboxano A2, libertação de endotelina e aumento da permeabilidade capilar.
O compromisso dos vasos da derme é responsável pelo exantema característico da doença. A lesão endotelial capilar que pode ocorrer é responsável pela bacteriémia e compromisso doutros órgãos, sendo o pericárdio e o pulmão os mais atingidos. Nestas circunstâncias, podem coexistir pericardite ou pneumonite. Raramente, surgem lesões ao nível do SNC.
No local da picada forma-se uma lesão castanha escura ou escara, denominada tâche noire pelos autores franceses, que é consequência da necrose provocada pelo infiltrado inflamatório oriundo de substâncias produzidas, quer pela R. conorii, quer pela própria carraça. De realçar que a maioria das carraças do cão não está infectada, pelo que o detectar-se uma carraça numa pessoa não implica que a mesma contraia a doença.
Manifestações clínicas
A doença surge após um período de incubação variando entre 4 a 12 dias (em média, cerca de uma semana). Verifica-se um período prodrómico de quatro a cinco dias, semelhante à síndroma gripal, com início abrupto: febre alta (39-40ºC), arrepios, cefaleia intensa, mialgias e prostração; poderá verificar-se também dor abdominal.
Entre o 4º e 6º dia de doença, surge o exantema maculopapular, discretamente nodular, rosado, irregular, com lesões de cerca de 1 a 4 mm, que se inicia pelos membros inferiores e que atinge tipicamente a palma das mãos e a planta dos pés, e que se pode ou não generalizar a todo o corpo. Inicialmente de cor rósea, pode evoluir para purpúrico ou petequial com ulterior evolução para pigmentação residual. Este exantema pode ser pruriginoso e persistir cerca de 15 dias após a regressão dos sinais gerais. (Figura 1)
A lesão de inoculação da carraça, escara ou tâche noire, indolor e raramente pruriginosa, embora patognomónica da doença, nem sempre está presente. Trata-se duma lesão arredondada, de cerca de 1 cm de diâmetro, negra (lesão ulcerosa coberta por escara negra e rodeada por halo eritematoso) que deve ser procurada em qualquer zona do corpo, nomeadamente no couro cabeludo, regiões retroauricular, inguinal ou internadegueira; na criança predomina no couro cabeludo, enquanto nos adultos predomina nos membros inferiores, mas também na cintura (Figura 2). A referida lesão desaparece lentamente em 10 a 20 dias sem deixar cicatriz, e acompanha-se de adenopatia satélite.
No exame objectivo pode ainda ser evidente hepatosplenomegália em cerca de 20% dos doentes. A hepatomegália pode acompanhar-se de discreta elevação do valor das transaminases séricas. Nas crianças anteriormente saudáveis o curso da doença é benigno, ocorrendo resolução do quadro clínico em cerca de 10 a 20 dias.
Complicações
As complicações mais frequentemente descritas, correspondendo ao compromisso possível de qualquer órgão ou sistema, são: cardiovasculares (pericardite, miocardite, arritmia, flebotrombose), respiratórias (pneumonite, derrame pleural), oculares (retinite, uveíte), renais (proteinúria, insuficiência renal), gastrintestinais (gastrenterite, pancreatite, hemorragia digestiva), osteomusculares (artrite), hematológicas (CIVD, anemia e trombocitopénia autoimune, síndroma mononucleósica) e neurológicas (radiculonevrite, meningoencefalite, AVC). Nas formas clínicas de evolução grave e por vezes fatal, poderão surgir vasculite generalizada, insuficiência renal, choque e CIVD.
Como factores predisponentes relevantes das complicações apontam-se a diabetes mellitus e a deficiência em desidrogenase da glucose-6-fosfato.
Exames complementares e diagnóstico
O diagnóstico da FEN é essencialmente clínico. As características do exantema associado ao quadro febril e a sinais gerais conduzem à suspeita do diagnóstico. Se o exame objectivo permitir identificar a tâche noire, o diagnóstico pode considerar-se definitivo.
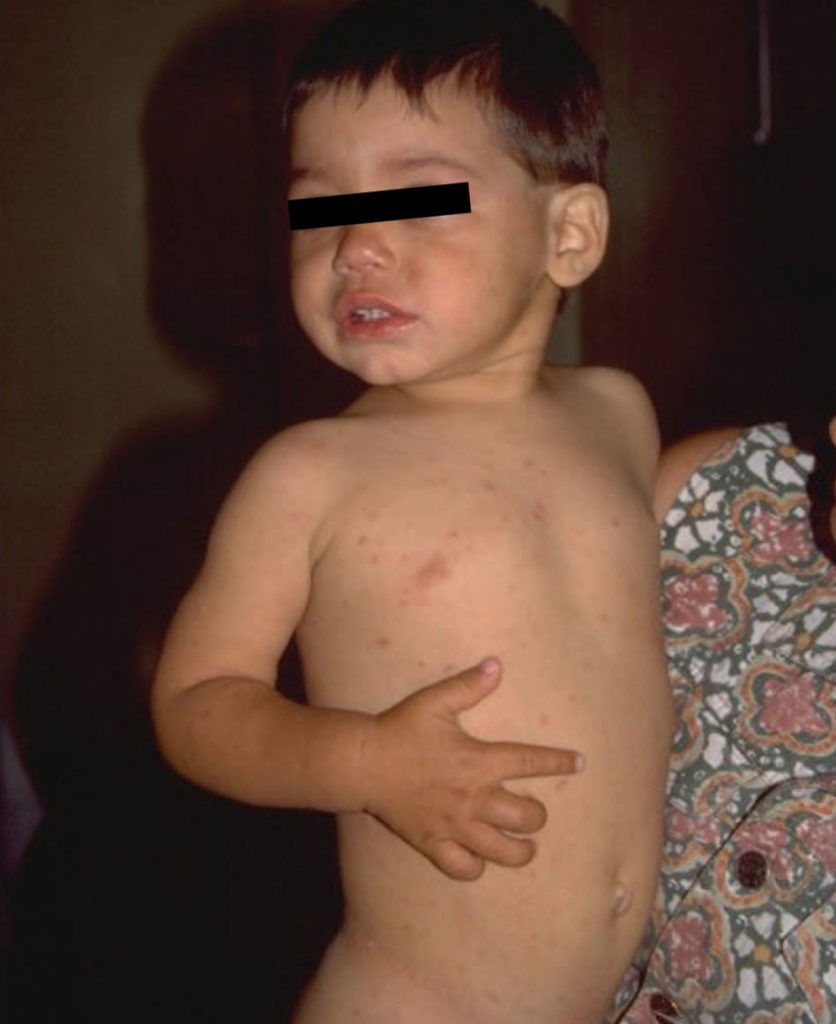
FIGURA 1. Exantema da FEN. (NIHDE)
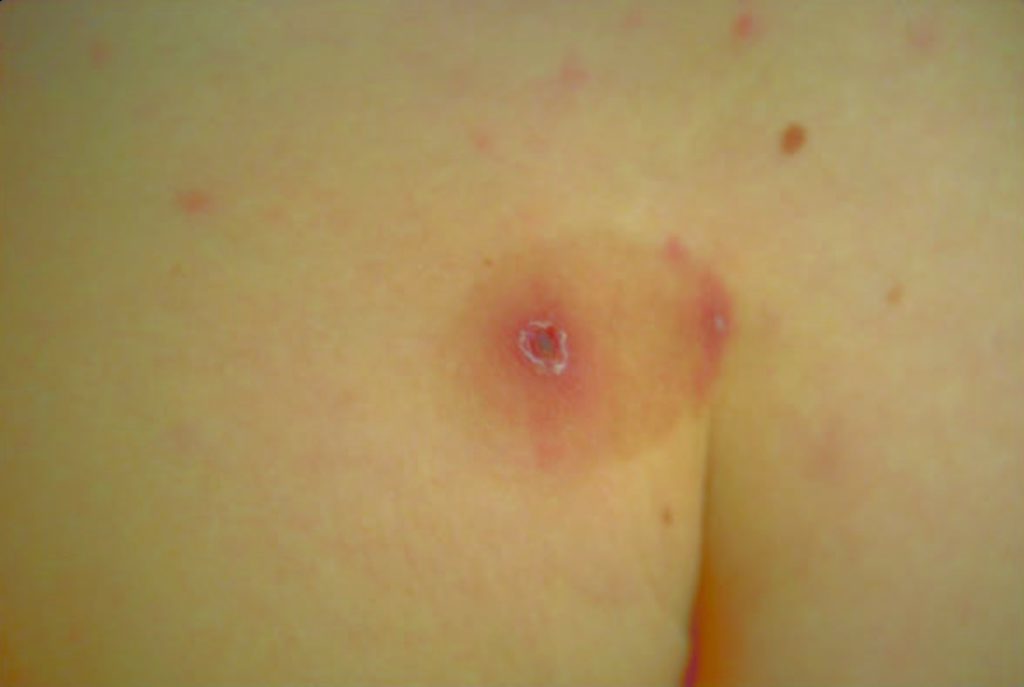
FIGURA 2. FEN: lesão de inoculação da carraça (escara). (NIHDE)
O estudo serológico para detecção de anticorpos por imunofluorescência indirecta pode ser conclusivo verificando-se títulos de anticorpos: IgG ≥ 128 e IgM ≥ 32, sendo de referir que somente se verifica positividade na segunda semana de doença. O critério de diagnóstico baseia-se na seroconversão ou no aumento do título (4 vezes) em duas amostras colhidas com intervalo de 2 a 4 semanas (entre a fase aguda e a fase de convalescença), pelo que este exame apenas é útil na confirmação ulterior da doença, não contribuindo para o diagnóstico na fase aguda.
A detecção directa da Riquétsia na fase aguda é possível, quer através do seu isolamento pela técnica de “shell vial”, quer por detecção do genoma da riquétsia – técnica PCR em amostras de sangue ou biópsias de pele (exantema e/ou escara), somente disponível em laboratórios especializados.
A reacção de Weil-Félix, método clássico para pesquisa de anticorpos, é hoje em dia considerada obsoleta por sensibilidade e especificidade baixas.
Regra geral, o hemograma não evidencia alterações significativas. Pode ocorrer anemia hemolítica autoimune, assim como leucopénia, leucocitose e trombocitopénia. A velocidade de sedimentação, assim com as enzimas hepáticas e musculares pderão revelar valores elevados, designadamente nas formas clínicas complicadas.
Diagnóstico diferencial
O diagnóstico diferencial faz-se essencialmentre com outras riquetsioses, primoinfecção por VIH, meningococcémia, infecções víricas exantemáticas (por ex. vírus Coxsackie, sarampo) e toxidermias.
Tratamento
O tratamento precoce é da maior importância por encurtar a duração dos sintomas o que, por sua vez, diminui a probabilidade de complicações.
O antibiótico de eleição é a doxiciclina PO, 4 mg/kg/dia em duas doses (máxima dose diária: 200 mg). A duração do tratamento é de 10 dias, ou até verificação de 2 dias de apirexia na condição de antibioticoterapia com duração mínima de 5 dias.
Como alternativas podem ser utilizados macrólidos PO:
- azitromicina (10 mg/kg/dia) numa dose diária durante 3 dias; ou
- claritromicina (15 mg/kg/dia) em duas doses diárias durante 7 dias.
Prognóstico
Na idade pediátrica, o prognóstico da FEN pode considerar-se, em geral, bom, sem sequelas, nomeadamente se não existir doença crónica subjacente.
Prevenção
Com o objectivo de diminuir a probabilidade de picada da carraça podem ser adoptadas determinadas medidas contra reservatórios e vectores e na própria espécie humana:
- desparasitação de animais domésticos;
- utilização de repelentes (por ex. N, N-dietil-m-toluamida – DEET) após o 1 ano de idade;
- cuidados básicos de higiene;
- nas situações de risco (actividades no campo, por ex.) utilização de roupa branca para mais fácil identificação da carraça; a roupa deverá ficar justa ao corpo para servir de barreira àquela, evitando o seu contacto com a pele.
Se eventualmente for identificada a carraça, deve proceder-se do seguinte modo:
- aplicação local de éter ou cloreto de etilo para matar a carraça;
- retirar a carraça completamente com pinça fina de bordos finos, sem garras.
BIBLIOGRAFIA
Amaro M, Bacellar F, França A. Report of eight cases of fatal and severe mediterranean spotted fever in Portugal. Ann N Y Acad Sci 2003;990:331-343
Bergelson JM, Shah SS, Zaoutis TE. Pediatric Infectious Diseases. The Requisites in Pediatrics. Philadelphia: Mosby Elsevier, 2008;262-265
Blanton LS, Walker DH. Rickettsioses and Rickettsiae. Am J Trop Hyg 2017;96:53-56
Cherry J, Demmler-Harrison GJ, Kaplan SL, Steinbach WJ, Hotez P (eds). Feigin and Cherry’s Textbook of Pediatric Infectious Diseases. Philadelphia: Elsevier Saunders, 2014
Crespo P, Seixas D, Marques N, Oliveira , Cunha S, Meliço-Silvestre A. Mediterrean spotted fever: case series of 24 years (1989-2012). Springer Plus 2015;272:1-7
Direcção Geral da Saúde. Doenças de Declaração Obrigatória (2010-2013). Lisboa: DGS, 2015
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Goldman L, Schafer AI (eds). Goldman-Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Kimberlain D, Brady M, Jackson M, Long S (eds). Red Book. Elk Gove Village, IL: American Academy of Pediatrics, 2015
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
Marques L, Mesquita S, Tavares E, Guedes M. Febre escaronodular (Protocolo/Consensos em Infecciologia Pediátrica/SPP). Acta Pediatr Port 2005;36:257-263
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Rizzo M, Mansueto P, Di Lorenzo G, Morselli S, Mansueto S, Rini G B. Rickettsial disease: classical and modern aspects. Microbiol 2004;27:87-103
Rovery C, Brouqui P, Raoult D. Questions on mediterranean spotted fever a century after its discovery. Emerging Infect Dis 2008;14:1360-1367
Sousa R, Nóbrega S, Bacellar F, Torgal J. Mediterranean spotted fever in Portugal: risk factors for fatal outcome in 105 hospitalized patients. Ann N Y Acad Sci 2003;990:285-294